
- •Міністерство освіти і науки україни
- •Харків - 2003
- •Загальні методичні вказівки до виконання контрольних робіт
- •1. Фізичні основи класичної механіки Методика розв’язування задач
- •1.1 Кінематика
- •1.2 Динаміка
- •Приклади розв’язування задач
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Контрольна робота №1
- •2. Молекулярна фізика та термодинаміка
- •Методика розв’язування задач
- •2.1 Молекулярна фізика
- •2.2 Термодинаміка
- •2.3 Явища переносу
- •Приклади розв’язання задач
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Задача 3. Яка частина молекул водню при ˚c має швидкість в інтервалі від 2000 до 2100 м/с?
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Густину газу визначимо з рівняння стану ідеального газу
- •Фізичний аналіз
- •Розв’язання Визначимо зміну ентропії, що відбувається в системі, за формулою:
- •Фізичний аналіз
- •Розв’язання
- •Контрольна робота № 2
- •Додаток а
- •Основні рівняння і формули кінематики прямолінійного руху
- •Основні рівняння і формули кінематики обертального руху
- •Додаток б
- •Вимоги до оформлення контрольних робіт
- •Даньшева Світлана Олегівна Омеляненко Іван Федорович
- •Підготовлено та віддруковано рвв
2. Молекулярна фізика та термодинаміка
Згідно з молекулярно-кінетичною теорією (МКТ) всі тіла утворені з структурних мікроскладових (молекул, атомів, іонів тощо), які знаходяться у безперервному хаотичному русі. Таким чином, фізичні системи, які розглядаються у даному розділі, утворюються великою кількістю об’єктів. Для дослідження таких систем використовують молекулярно-кінетичний, статистичний і термодинамічний методи. Молекулярно-кінетичний метод розв’язування задач базується на рівняннях стану та його наслідках, статистичний метод грунтується на розподілі Максвелла-Больцмана. В основі термодинамічного методу лежать перший та другий початки термодинаміки. Розглянемо в загальних рисах методику розв’язування задач, фізичний зміст яких грунтується на молекулярно-кінетичній теорії та термодинамиці.
Методика розв’язування задач
2.1 Молекулярна фізика
Фізичний зміст задач цього розділу грунтується на застосуванні:
рівняння стану ідеального газу та газових законів;
основного рівняння МКТ та його наслідків;
розподілу Максвелла-Больцмана.
Якщо в умові задачі задано певний фіксований стан газу, то здебільшого розв’язування задачі полягає в простому обчисленні однієї з величин, що входять до складу рівняння стану ідеального газу:
![]() ,
(1)
,
(1)
або до складу формул, що описують ізопроцеси у газі:
![]() -
ізотермічний процес, (2)
-
ізотермічний процес, (2)
![]() -
ізобарний процес, (3)
-
ізобарний процес, (3)
![]() -
ізохорний процес (4)
-
ізохорний процес (4)
(слід пам’ятати, що формули ізопроцесів можна використовувати, якщо під час процесу маса газу залишається сталою).
Часто трапляються задачі, в яких число невідомих параметрів стану більше одного, і в умові задачі розглядається кілька фіксованих станів ідеального газу. Для розв’язання таких задач рівняння (1-4) треба застосовувати окремо для кожного стану газу, тобто скласти систему рівнянь, з якої потім обчислювати невідомі параметри.
Записуючи
рівняння стану або систему рівнянь і
визначаючи для цього з умови задачі
значення параметрів
![]() ,
,![]() ,
слід пам’ятати про закон парціальних
тисків. Можна розглядати поведінку
кожної компоненти неоднорідного газу
окремо і незалежно від інших, складаючи
для неї рівняння стану (або систему
рівнянь).
,
слід пам’ятати про закон парціальних
тисків. Можна розглядати поведінку
кожної компоненти неоднорідного газу
окремо і незалежно від інших, складаючи
для неї рівняння стану (або систему
рівнянь).
Для
визначення зв’язку між параметрами
макростану системи та характеристиками
об’єктів системи використовують основне
рівняння
![]() та його наслідки.
та його наслідки.
У кінетичній теорії газів важливу роль відіграє розподіл Максвелла-Больцмана. Проте в задачах загального курсу фізики він майже ніколи не застосовується в загальному вигляді. Як правило, виділяють окремо задачі, розв’язування яких грунтується на застосуванні тільки закону розподілу за швидкостями (розподілу Максвелла)
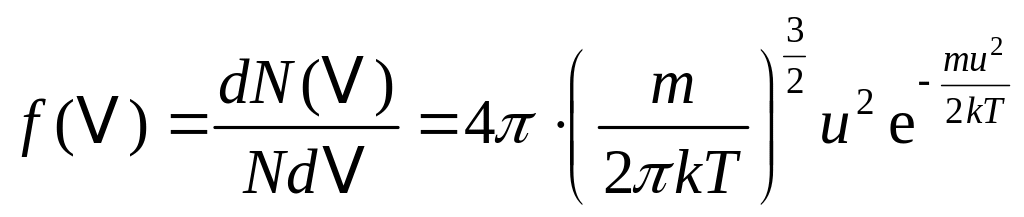 ,
(1)
,
(1)
і задачі, які розв’язуються за допомогою розподілу Больцмана
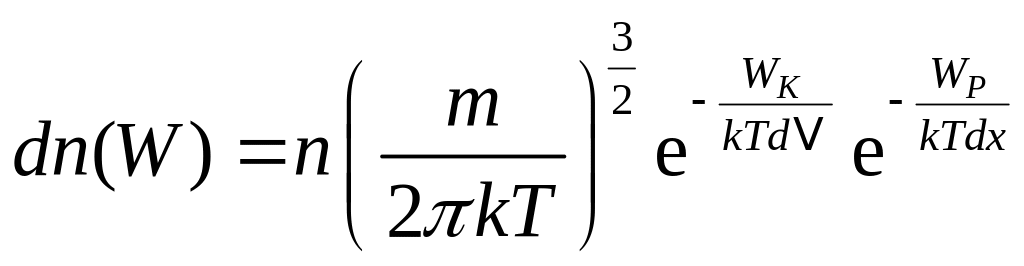 ,
,
де ![]() і
- кінетична і потенціальна енергії
однієї молекули.
і
- кінетична і потенціальна енергії
однієї молекули.
Для визначення ймовірності знаходження при заданих умовах молекули з певною швидкістю (або відносного числа молекул, які мають певну швидкість) слід користуватися рівняннями:
![]() .
.
Якщо газ перебуває у потенціальному силовому полі, для обчислення фізичних величин, які є функціями швидкості (наприклад, концентрації або тиску), застосовується розподіл Больцмана (розподіл молекул у силовому полі):
![]()
або барометрична формула:
![]() .
.
