
§ 3. Активность электролитов
Константа диссоциации электролита, распадающегося в растворе на два иона, равна отношению:
![]()

![]()
![]()
![]()
Из уравнения (IV, 42), получаем, что
![]()
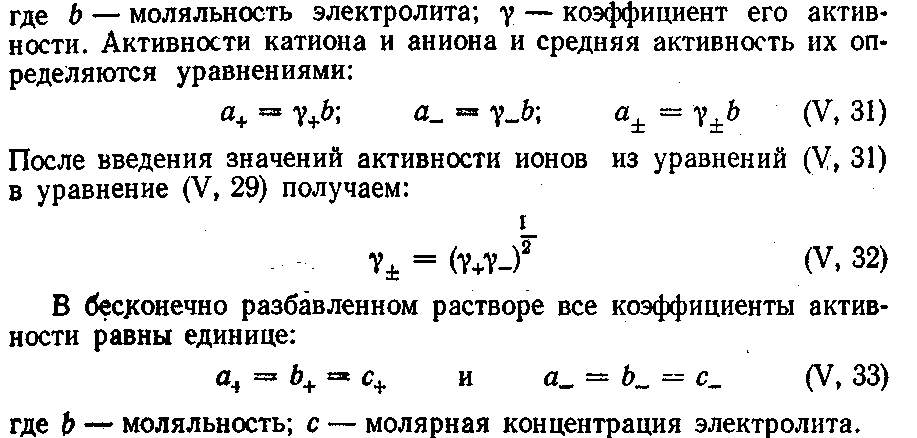
Для электролита, образующего р катионов и q анионов, приведенные выше уравнения имеют более сложный вид. При решении задач нужно учитывать, какова будет концентрация каждых ионов, если моляльность электролита равна b, и в какой степени входит концентрация иона в выражение константы диссоциации.
Коэффициент активности данного иона зависит от его концентрации и заряда, а также от концентрации и заряда других ионов, присутствующих в растворе. Для всякого иона он определяется величиной ионной силы раствора J, которая равна полусумме произведений моляльности bj ионов на квадрат их заряда zJ:
![]()
Так как коэффициент активности данного электролита зависит от общей концентрации ионов и их заряда, то его нужно определять опытным путём для различных смесей солей. Установлено, что коэффициенты активности ионов одинаковой валентности в разбавленных растворах приблизительно одинаковы.
Согластно теории сильных электролитов, зависимость между средним коэффициентом активности и ионной силой выражается следующим уравнением Дебая и Гюккеля:
![]()
где z+ и z_ — зaряды ионов; А — коэффициент, зависящий от температуры и природы растворителя. Для водных растворов при 25 °С он равен 0,5117. Это уравнение применимо лишь для сильно разбавленных растворов.
Примеры

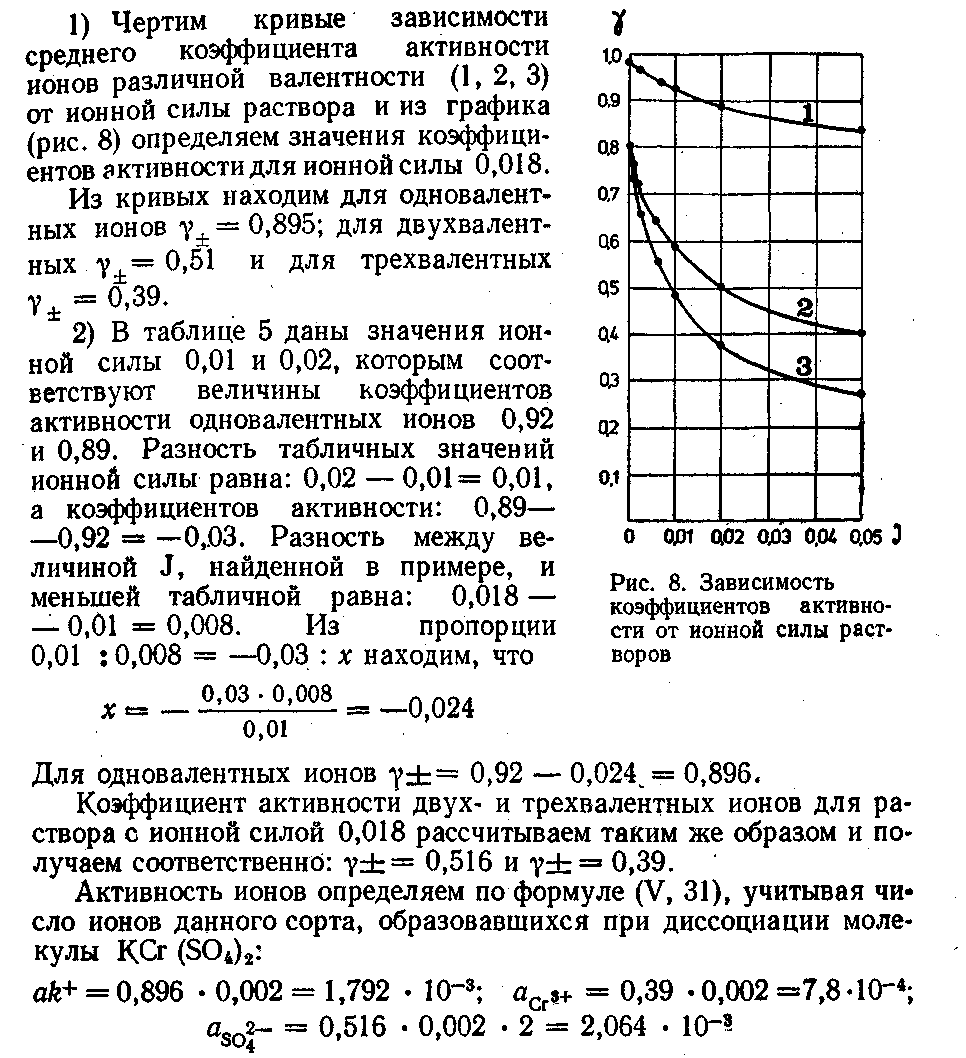
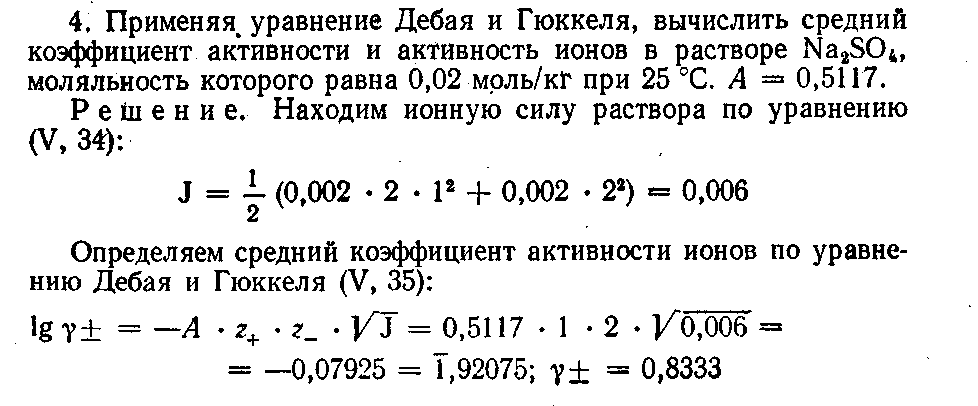

Следовательно, растворимость АgВr в растворе бромида натрия моляльностью в 0,01 моль/кг равна 9,679 • 10-11 (моль/кг воды), б) Определяем растворимость АgВr в растворе сульфата натрия моляльностью 0,01 моль/кг. Вычисляя ионную силу раствора, принимаем во внимание только Nа2SО4 (см. пункт а):

Вопросы
24. Что такое активность? Какое состояние электролита в растворе принято за стандартное?
25. Можно ли экспериментально определить активности отдельных ионов? Какой величиной активности для них обычно пользуются? Есть ли таблицы активности для отдельных ионов? Как они составлены?
26. Что такое коэффициент активности? Как его определяют?
27. Что такое ионная сила? Какое значение имеет эта величина для растворов электролитов?
Задачи
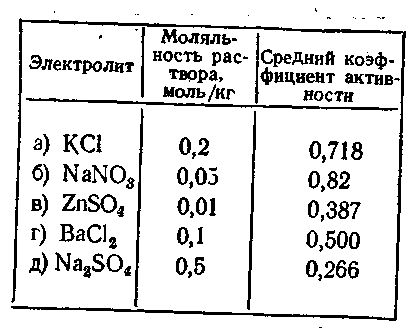
49. Определите активность соли и среднюю активность ее ионов в водных растворах указанного состава по величине среднего коэффициента активности (см. табл. на с. 109);
50.
Сравните ионные силы растворов: НВr,
СаО2,
Nа2SO4,
АlСl3
и Nа3РO4,
имеющих моляльность, равную 0,1 моль/кг.
51. Вычислите ионную силу раствора, содержащего следующие соли (в моль на 1 кг воды):
а) 0,01 моль NaСl; 0,2 моль ВаСl2 и 0,05 моль Аl (NO3)3;
б) 0,1 моль КNО3, 0,01 моль К2SО4 и 0,02 моль FеСl3
в; У,1)5 моль СиSО4, 0,01 моль АlСl3 и 0,2 моль Nа2SО4;
г) 0,002 моль Zn(N03)2, 0,05 моль NaNO3 и 0,001 моль Аl2(SО4)3.
52. Вычислите ионную силу раствора b (ВаСl2/Н2О) = 0,05 моль/кг. Какова должна быть моляльность раствора КСl, чтобы его ионная сила была такой же величины?
53. Определите коэффициент активности иона Мg2+ в растворе, содержащем 0,004 моль МgС12 и 0,002 моль АlСl8 в 1 кг воды1.
54*. Определите коэффициент активности и активности иона Na+ в растворе, содержащем 0,01 моль NаСl, 0,01 моль СиСl3 и 0,002 моль CuSО4 в 1 кг воды1.
55*. Вычислите активность ионов в растворах: а) b (ВаСl2/Н2О) = 0,002 моль/кг; б) b (Аl2 (SО4)3/НаО) = 0,001 моль/кг.
56*. Воспользовавшись уравнением Дебая и Гкжкеля, вычислите средний коэффициент активности ионов и их активность в растворе b (СuСl2/Н2O) = 0,001 моль/кг. А = 0,5117.
57*. Применяя уравнение Дебая и Гюккеля, вычислите средний коэффициент активности К2SО4 в растворе, содержащем 0,001 моль К2SО4 и 0,002 моль МgСl2 в 1 кг воды. А = 0,5117.
58*. Растворимость РЫ2 в воде равна 1,4 • 10-3 моль/л. Вычислите произведение растворимости этой соли с учетом коэффициентов активности1.
59*. Растворимость Са(ОН)2 в воде равна 0,165 г в 100 г воды. Вычислите произведение растворимости Са(ОН)2 с учетом коэффициента активности1.
60*. Как и во сколько раз изменится растворимость Аg3РО4 при растворении его в растворе b (Мg (NО3)2/Н2О) = 0,01 моль/кг по сравнению с чистой водой?
61*. Произведение растворимости ВаSО4 равно 1,1 • 10-10. Определите растворимость ВаSО4: а) в чистой воде; б) в растворе b (КСl/Н2О) = 0,01 моль/кг и в), в растворе b (ВаСl2/Н2О) = 0,01 моль/кг. Сравните и объясните полученные результаты.
62*. Растворимость Аg2СrО4 в воде равна 1,3 • 10-4 моль/л. Определите растворимость Аg2CrO4: а) в растворе b (АgCrO4/Н2О)= 0,02 моль/кг и б) в растворе b (КNО3/Н2О) = 0,05 моль/кг.
