
§ 2. Константа диссоциации слабых электролитов. Водородный показатель. Буферные растворы
К растворам слабых электролитов можно применить закон действующих масс. Для бинарного электролита, диссоциирующего по схеме: ВА ↔ В+ + А–, можно написать:
![]()
где К — константа диссоциации электролита.
Это соотношение применимо лишь для разбавленных растворов; в более концентрированных растворах или в присутствии других электролитов в значительных концентрациях нужно пользоваться активностями, а не концентрациями.
Выразив концентрации ионов и недиссоциированных молекул через степень электролитической диссоциации, получим:
![]()
где V — разбавление раствора, т. е. объем, в котором содержится 1 моль растворенного вещества; с — концентрация, моль/л.
Для очень слабых электролитов степень электрической диссоциации мала, и в знаменателе формулы (V, 17) ею можно пренебречь, тогда получаем:


Примеры
1. Константа диссоциации муравьиной кислоты при 25 °С равна 1,77 • 10–4, а константа диссоциации пропионовой кислоты при той же температуре 1,34 • 10–5. Определить отношение концентрации ионов водорода в эквимолекулярных соотношениях.
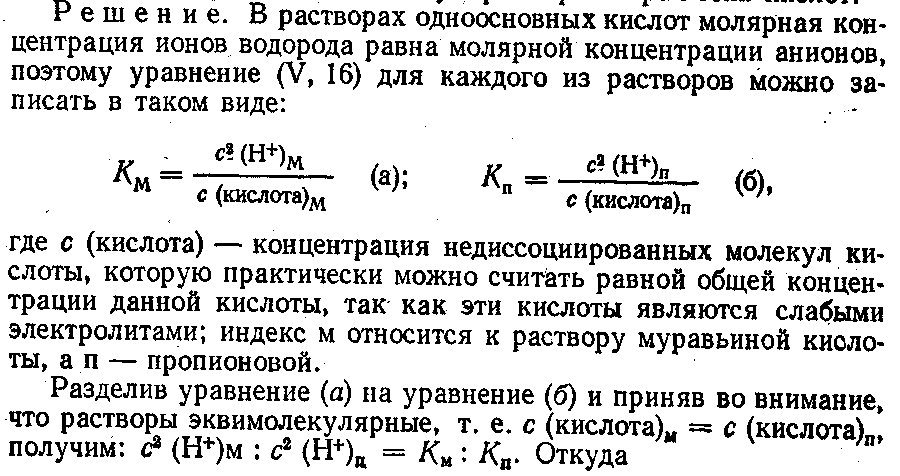

2. Вычислить рН раствора уксусной кислоты молярной концентрации 0,1 моль/л, если степень диссоциации СН3СООН в этом растворе равна 1,3%.

4. Вычислить концентрацию (в моль/л) раствора кислоты, если рН его равен 3,44, а степень диссоциации кислоты в этом растворе 3,66%.

5. Как изменяется степень диссоциации раствора уксусной кислоты молярной концентрации 0,1 моль/л, если к нему добавить такое количество сухого ацетата натрия, чтобы концентрация его в растворе также была 0,1 моль/л. Константа диссоциации уксусной кислоты равна 1,8 • 10–5, а степень диссоциации ацетата натрия 79%.
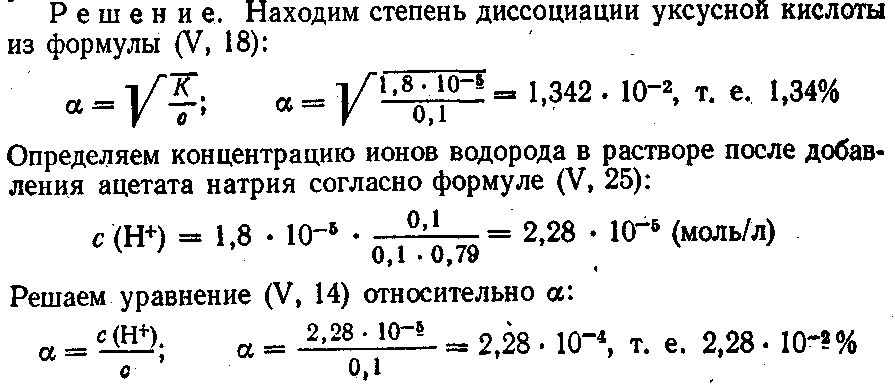

Вопросы и упражнения.
11. Применим ли закон действующих масс к сильным электролитам? Как это подтверждается экспериментально? Дайте объяснение.
12. Выведите математическое выражение закона действующих масс через степень электролитической диссоциации.
13. Что такое ионное произведение воды? Как оно определяется? Чему равна эта величина в воде и водных растворах?
14. Чему равна концентрация ионов водорода и гидроксида в нейтральной среде? Каковы значения концентрации иона водорода: а) в кислой среде; б) в щелочной среде?
15. Что такое рН? Какие значения он принимает в кислой, нейтральной и щелочной средах?
16. Почему для характеристики как кислотности, так и щелочности раствора применяется рН?
17. Как изменяется рН раствора, если к нему добавить раствор щелочи? Как нужно изменить концентрацию ионов водорода в растворе, чтобы рН его уменьшился?
18. Как изменяется степень диссоциации слабого электролита при добавлении к его раствору сильного электролита с одноименным ионом? Разберите на примерах.
19. Какие растворы (смеси) называются буферными? Приведите примеры.
20. Какими свойствами обладают буферные смеси? Докажите, что концентрация ионов водорода в буферной смеси почти не изменяется с разбавлением и мало изменяется при добавлении небольшого количества сильной кислоты или сильной щелочи.
21. Чему равна концентрация ионов водорода в ацетатной буферной смеси? Выведите соответствующую формулу.
22. Что такое буферная емкость? От чего она зависит? Как определяется на опыте?
23. Укажите, какое практическое значение имеют буферные смеси.
Задачи
23. Вычислите концентрацию ионов водорода в растворе бензойной кислоты молярной концентрации 0,02 моль/л, если константа диссоциации ее равна 6 • 10–5.
24. Сколько воды нужно прибавить к раствору уксусной кислоты молярной концентрации 0,1 моль/л и объемом 0,5 л, чтобы степень диссоциации ее увеличилась в два раза?
25. Вычислите рН растворов следующих электролитов, считая, что они полностью диссоциируют на ионы: с (НСl) = 0,001 моль/л; с (НNO3) = 0,005 моль/л; с (Н2SО4) = 0,00006 моль/л; с (КОН) = 0,025 моль/л; с (1/2 Са(ОН)2)= 0,0004 моль/л; с (1/2 Мg (ОН)2) = 0,000002 моль/л.
26. Определите рН раствора уксусной кислоты молярной концентрации 1 моль/л, если степень диссоциации СН3СООН равна 0,4%.
27. Определите рН раствора гидроксида аммония молярной концентрации 0,1 моль/л, степень диссоциации которого равна 1,3%.
28. Определите рН насыщенного раствора гидроксида кальция, растворимость которого равна 0,17 г в 100 г воды. Плотность раствора считать равной 1, диссоциацию — полной.
29. Вычислите концентрацию ионов водорода и гидроксида в растворах, рН которых равен 2,54 и 11,62.
30. Как изменится рН воды, если к 1 л ее прибавить: а) 0,01 моль едкого натра; б) 0,00126 г азотной кислоты? Диссоциацию электролитов считать полной.
31. Вычислите кажущуюся степень диссоциации раствора хлороводородной кислоты молярной концентрации 0,5 моль/л, если рН его равен 0,37.
32. Вычислите кажущуюся степень диссоциации раствора гидроксида бария молярной концентрации эквивалента 0,0156 моль/л, если рН его равен 12,16.
33. Определите молярную концентрацию в моль/л раствора хлоруксусной кислоты, если рН его равен 2,41, а степень диссоциации кислоты 39,4%.
34. Определите молярную концентрацию в моль/л раствора гидроксида аммония, если рН его равен 11,6, а степень диссоциации NH4OH 0,4%.
35. Вычислите рН раствора СвН6СООН молярной концентрации 0,1 моль/л, если K = 6,27 • 10-6.
36. Определите рН раствора уксусной кислоты, если K = 1,8 • 10-5, а степень диссоциации 2,5%.
37. Как изменится степень диссоциации раствора гидроксида аммония молярной концентрации 0,1 моль/л, если к раствору его добавить такое количество сухого хлорида аммония, чтобы молярная концентрация его в растворе была бы равной 0,1 моль/л? Константа диссоциации NH4ОН равна 1,8 • 10-5. Диссоциацию NН4Сl Считать полной.
38. Вычислите концентрацию ионов водорода и рН раствора синильной кислоты молярной концентрации 0,04 моль/л, если константа диссоциации НCN равна 7,2 • 10-10. Найти значения тех же величин для раствора, содержащего по 0,04 моль/л синильной кислоты и цианида калия. Диссоциацию последнего считать полной.
39. Определите рН буферной смеси, приготовленной сливанием 15 мл с (СН3СООН) = 0,5 моль/л с 25 мл с (СН3ОONа) = 0,2 моль/л. KCH3COOH = 1,8 • 10-5. Диссоциацию соли считать полной.
40. В каком соотношении нужно смешать раствор с (СН3СООН)= 0,4 моль/л с раствором с (СН3СООКа) = 0,1 моль/л, чтобы рН полученного раствора был равен 4,44? Kснсоон = 1,8 • 10-5. Соль диссоциирует полностью.
41. Сколько миллилитров раствора с (СН3СООН) = 0,2 моль/л нужно прибавить к 50 мл раствора с (СН3СООМа) = 0,25 моль/л, чтобы рН полученного раствора был равен 6?
KNH4OH = 18.• 10-5. Диссоциацию соли считать полной.
42. Сколько миллилитров раствора с (МН4Сl) = 0,5 моль/л

