
Глава III. Химическое равновесие
§ 1. Химическое равновесие. Смещение химического равновесия
Известно, что многие химические реакции не идут до конца, т. е. исходные вещества полностью не расходуются на образование продуктов реакции. Наступает, как говорят, динамическое химическое равновесие.
В основе учения о химическом равновесии реакций лежит закон действующих масс. Применяя его для химической реакции общего вида:
mА + пВ ↔ pС + qD
можно написать:
![]()
Величину Ксс называют константой химического равновесия, а уравнение — уравнением химического равновесия или математическим выражением закона действующих масс применительно к обратимым реакциям. В таком виде выражение константы равновесия применяется, как правило, к идеальным системам.
Если в реакции участвуют газообразные вещества, то действующие массы выражают через парциальные давления газов. Константу равновесия в этом случае обозначают Кр, а уравнение химического равновесия примет вид:
![]()
где р (А), р (В), р (С), р (D) — парциальные давления газов при равновесии.
Связь между Кс и Кр выражается уравнениями:
Кр~К.с(К.Т}(р^}-(т+п)\
Кс = Кр(КТ)<т+*-№ (III, 3)
Если же реакция идет без изменения числа молекул, то
Кр = Кc
На химическое равновесие можно воздействовать и смещать его в нужную сторону, т. е. изменять выход продуктов реакции.
Изучение явлений химического равновесия позволило сформулировать принцип смещения химического равновесия: если изменить одно из условий, при которых система находится в состоянии химического равновесия, то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению (принцип Ле Шателье).
Смещение химического равновесия в основном определяется:
1) концентрацией реагирующих веществ;
2) давлением, если реагирующие вещества находятся в газообразном или парообразном состоянии;
3) температурой, при которой происходит химический процесс.
Причиной смещения химического равновесия при изменении концентрации, давления или температуры реагирующих веществ является нарушение равенства скоростей прямой и обратной реакций. И это смещение химического равновесия продолжается до тех пор, пока скорости этих реакций снова не сравняются. Если изменение условий реакции приводит к одинаковому изменению прямой и обратной реакции, то никакого смещения химического равновесия происходить не будет.
Принцип Ле Шателье с некоторыми допущениями применим и к гетерогенным системам. Рассмотрим реакцию, идущую в домнах и газогенераторах:
С + СО2 ↔ 2СО; ΔH = 172,6 кДж
Эта система гетерогенна, так как уголь представляет собой твердую фазу, а СО2 и СО — газообразную. Константа равновесия будет определяться отношением концентраций или парциальных давлений только газообразных веществ. Количество же угля не влияет на константу равновесия, так как реакция идет только на поверхности угля:
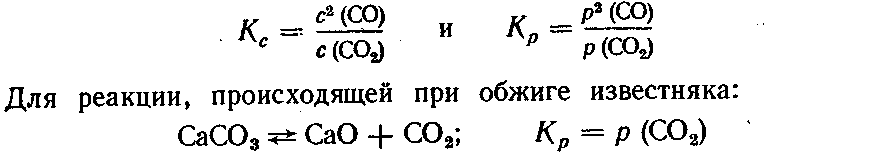
Это означает, что каждой температуре отвечает строго определенное равновесное давление СО2 над смесью СаСО3 и СаО, не зависящее от их концентраций. Это давление называют давлением диссоциации.
Для реакции
1
Примеры
1. Вычислить константы равновесия К.р и Кс реакции образования метана, протекающей по уравнению:
2СО + 2Н2 ↔ СН4 + СО2 при 1000 К и давлении 20,26 • 105 Па, если равновесная смесь газов
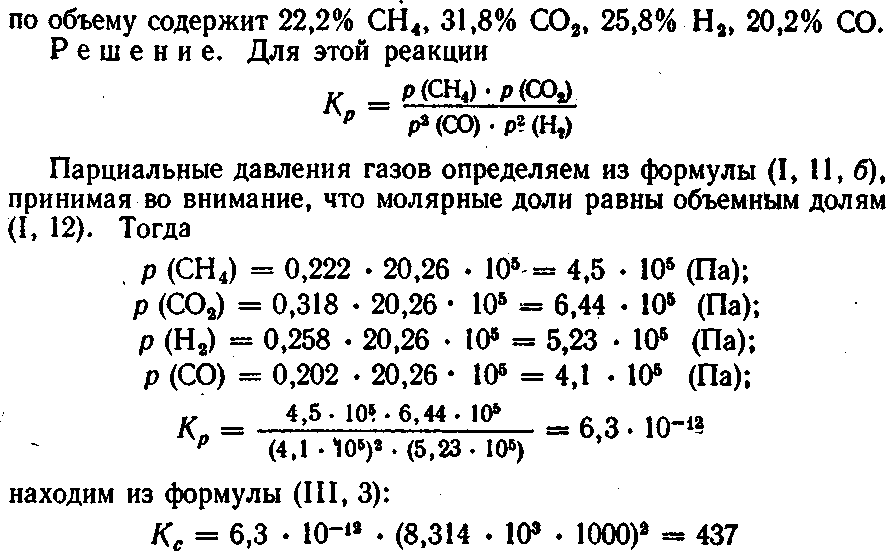
2. При нагревании смеси СО2 и Н8 до 850 °С установилось равновесие:
СO2 + Н2 ↔ СО + Н2O
Константа равновесия при данной температуре равна 1. В каких объемных соотношениях были смешаны СО2 и Н2, если к моменту равновесия 90% водорода превратилось в Н2О?
Решение.
![]()
Если количества реагирующих веществ не заданы, то расчет ведут на 1 моль какого-либо из реагирующих веществ. Исходную концентрацию СО2 примем за х, а водорода — за 1 моль. По условию задачи 90% водорода превратилось в воду, т. е. 0,9 моль. Из уравнения реакции следует, что 0,9 моль водорода взаимодействует с 0,9 моль СО2 и при этом образуется 0,9 моль СО и 0,9 моль Н2О. В момент равновесия концентрация Н2 будет равна 0,1 моль, а концентрация СО2 равна х — 0,9 моль.
Подставляя эти данные в уравнение константы равновесия, получаем:
![]()
Отсюда х = 9 моль.
В исходной смеси на 9 моль СО2 приходится 1 моль водорода. Для газообразных веществ отношение количества вещества равно отношению объемов. Следовательно, на 9 объемов СО2 приходится 1 объем Н2
3. Для реакции
СКОКС + СO2 ↔ 2СО
при температуре 800 °С и давлении 1,013 - 105 Па вычислить молярную долю СО в, равновесной смеси, если Кp при указанной температуре равна 6,44 • 10б.
Решение. Для этой реакции молярную долю СО в смеси примем за х. Найдем парциальные давления СО и СО2:
р (СО) = робx= 1,013 • 105 x
так как роб по условию задачи равно 1,013 • 105 Па, то:
р (СО2) = 1,013 • 105 — 1,013 • 105 х
Подставляем эти данные в уравнение константы равновесия и решаем его относительно х:
![]()
4. При 27 °С и нормальном давлении степень диссоциации N2О4 на NО2 равна 20%. Определить значение Kp
Решение. Для реакции
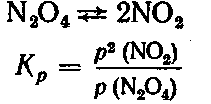
Парциальное давление каждого газа в смеси равно его молярной доле, умноженной на общее давление смеси (I, 116). Если количество вещества N2О4 до диссоциации принять за 1 моль, а степень диссоциации — за α, то количество продиссоциированного вещества будет 1 • α моль, которые дадут 1 • α • 2 = 2α моль NО2. Недиссоциированных молекул N2О4 будет 1 — α моль, а общее количество вещества в смеси:
1 - α + 2α = 1 + α моль
Молярная доля NО2 равна отношению количества вещества компонента к общему количеству вещества в смеси:
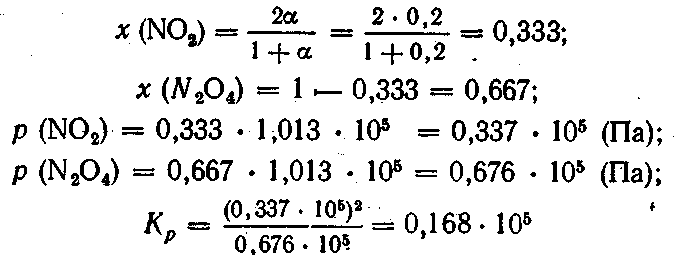
Вопросы и упражнения
1. Какие реакции называются обратимыми?
2. Что означает состояние химического равновесия? Как можно определить, что в системе наступило равновесие?
3. Что определяет константа химического равновесия? От каких факторов она зависит?
4. Напишите математическое выражение закона действующих масс применительно к обратимым идеальным однородным химическим системам и реальным.
5. В каких случаях обратимые реакции протекают до конца? Объясните это с точки зрения закона действующих масс.
6. Сформулируйте принцип смещения химического равновесия Ле Шателье.
7. Как смещается химическое равновесие при изменении температуры, концентрации, давления?
8. В каком направлении смещается равновесие
2СО + О2 ↔ 2СО2, ΔН = -566,4 кДж
при изменении давления и температуры?
9. В какую сторону сместится равновесие реакции
СО2 + С ↔ 2СО, ΔН = 172,6 кДж
при повышении температуры? Что произойдет в системе при увеличении давления?
10. Выразите математически Кр для следующих реакций, протекающих по уравнениям:
а) FеО+ Н2 ↔Fе+ Н2ОГ;
б) 2НgО ↔2Нg + O2;
в) 2Сu + О2 ↔2CuО
11. Как повлияет повышение давления при неизменной температуре на равновесие следующих систем:
а) 2НВr ↔ Н2 + Вг2 ΔH = 70,3 кДж;
б) 2СО + О2 ↔ 2СО2, ΔH = -566,4 кДж;
в) N2. + О2 ↔ 2NO, ΔH = 180,9 кДж?
12. Каким путем можно повысить выход NО2 при реакциях, идущих по уравнениям:
а) 2NО + О2 ↔ 2NO2, ΔH = -113 кДж;
б) N2О4 + 2NO2, ΔH = 58,2 кДж?
13. Как можно увеличить процентное содержание РСl3 в равновесной системе, выраженной уравнением:
РСl5 ↔ РСl3 + Сl2; ΔH = 92,5 кДж?
Задачи
1. Константа равновесия реакции образования НСl при некоторой температуре равна единице. Определите состав (в молярных долях) равновесной реакционной смеси, полученной из водорода объемом 2 л и хлора объемом Зл.
2. При некоторой температуре и давлении 1,013 • 10б Па степень диссоциации иодоводорода на водород и йод равна 22%. Определите значение Кр и Кc
3. При 50 °С и давлении 0,348 • 105 Па степень диссоциации N2О4 на NО2 равна 63%. Определите значение Кр и Кс.
4. Вычислите, под каким давлением степень диссоциации N2О4 при 50 °С будет равна 50%, если Кр = 92 000.
5. Для реакции
Сm+Н2O ↔ СО+Н2
при температуре 700 °С и давлении 1,013 • 105 Па молярная доля СО в равновесной системе составляет 0,418. Определите при этой температуре Кр.
6. Железно-паровой способ производства водорода основан на реакции:
Н2О + Fе ↔ FеО + Н2
При температуре 700 °С и давлении 1,013 • 105 Па в равновесной смеси содержится 63% Н2. Определите Kр.
7. Вычислите Кр реакции FеО + СО ↔ Fе + СО2 при 1000 К и давлении 1,013 • 105 Па, если равновесная смесь газов содержит СО2 массовой долей 39%.
8*. В закрытом сосуде при постоянной температуре смешано 2 моль азота и 6 моль водорода. В результате реакции к моменту наступления равновесия прореагировало 10% первоначального количества азота. Как изменится в этом случае давление по сравнению с первоначальным?
9*. Константа равновесия для реакции
Н2+I2 ↔ 2HI
при 445 °С равна 50. Какое количество вещества водорода надо взять на 1 моль йода, чтобы 90% последнего превратить в иодоводород?
10*. При нагревании смеси углекислого газа и водорода в закрытом сосуде устанавливается равновесие
СО2 + Н2 ↔ СО + Н2О
Константа равновесия при 850 °С равна единице. Какая массовая доля (%) углекислого газа подвергнется превращению в оксид углерода (II) при 850 °С, если смешать 1 моль СО2 и 5 моль Н2?
11*. При синтезе аммиака в определенных условиях в равновесии находятся 1 моль водорода, 2 моль азота и 8 моль аммиака. Рассчитайте константу равновесия Кc.. Во сколько раз исходные количества азота и водорода больше равновесных их количеств?
12*. Равновесие реакции
Н2+'Вr2 ↔ 2НВr
установилось при некоторой температуре при следующих равновесных концентрациях: с (Н2) = 0,5 моль/л; с (Вr2) = 0,1 моль/л; с (НВr) = 1,6 моль/л. Найдите Kc. Определите исходные концентрации водорода и брома.
