
Г лава V. Растворы электролитов
§ 1. Диссоциация электролитов в водных растворах
Водные растворы кислот, щелочей и солей обнаруживают отклонения от законов разбавленных растворов неэлектролитов (гл. IV, §2—5). Электролиты вызывают большее понижение давления насыщенного пара, а также большее понижение температуры замерзания и повышение температуры кипения и более высокое осмотическое давление, чем это наблюдается в растворах неэлектролитов такой же концентрации.
Различие, которое наблюдается у растворов электролитов и неэлектролитов в рассмотренных свойствах согласно теории электролитической диссоциации Аррениуса, объясняется увеличением числа частиц в результате диссоциации молекул и возрастания степени диссоциации последних с разбавлением раствора. Эта теория в основном применяется к слабым электролитам.
Чтобы математические выражения (IV, 10, 12 — 16, 18, 19, 21, 22) законов разбавленных растворов неэлектролитов могли быть применены к растворам электролитов, в них нужно ввести множитель i > 1, и тогда они принимают вид:


Примеры
1. Давление пара воды при 90 °С равно 701 гПа. При растворении в воде массой 100 г хлорида бария массой 3,4 г давление пара понизилось на 5,1 гПа. Вычислить кажущуюся степень диссоциации хлорида бария в этом растворе.

3. Раствор, содержащий сульфат калия массой 2,85 г в воде массой 100 г, кипит при температуре 100,191 °С. Вычислить кажущуюся относительную молекулярную массу и кажущуюся степень диссоциации, если эбуллиоскопическая постоянная воды равна 0,512 К*кг/моль.
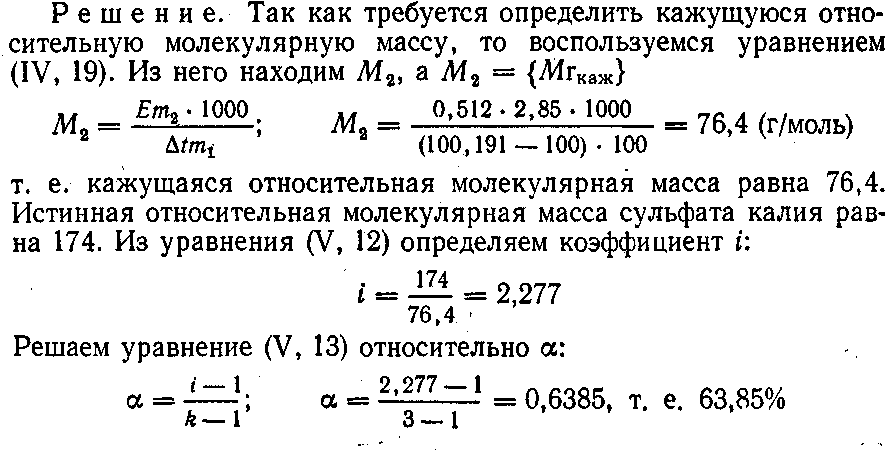

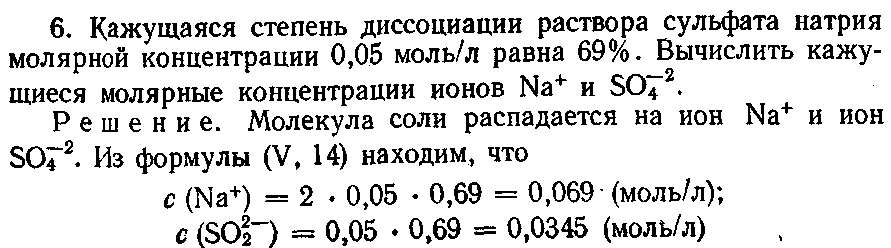
Вопросы и упражнения
1. В чем состоят отклонения растворов кислот, щелочей и солей от законов Рауля и Вант-Гоффа? Как объясняются эти отклонения? Кем дано это объяснение?
2. Что такое изотонический коэффициент? Каков его физический смысл? Как он может быть определен?
3. Какие наблюдения привели к созданию теории электролитической диссоциации?
4. Изложите сущность теории электролитической диссоциации Аррениуса. Какие дополнения были внесены в нее И. А. Каблуковым? К каким электролитам она применима?
5. Что такое степень электролитической диссоциации? Какими методами она определяется? Напишите соответствующие уравнения, применяемые для расчетов степени диссоциации, и поясните их. Как изменяется степень электролитической диссоциации с разбавлением электролита?
6. Изложите основные положения теории сильных электролитов. Укажите, какие факты привели к созданию этой теории.
7. Что такое кажущаяся степень электролитической диссоциации? Какие коэффициенты введены в теории сильных электролитов? Напишите и поясните математические выражения, применяемые для их расчетов.
8. При одинаковой ли температуре замерзнут раствори мочевины, уксусной кислоты, хлорида калия, хлорида кальция и хлорида алюминия, если их молярная концентрация равна 0,1 моль/л. Дайте объяснение.
9. Какая по величине получится относительная молекулярная масса для электролита, если ее рассчитывать по формуле М2 =Km2*100/Δtm1 Дайте объяснение и укажите, как может быть использована эта величина.
10. Когда образуются ионы — при растворении вещества или при пропускании через раствор электрического тока? Придите факты, подтверждающие ответ.
Задачи
1. При-75°С давление пара воды равно 385 гПа. Оно понизилось на 4,92 гПа при растворении в воде массой 100 г хлорида аммония массой 22 г. Вычислите кажущуюся степень диссоциации соли МН4С1 в этом растворе.
2. Вычислите давление пара раствора, содержащего в воде массой 9,472 г иодид кадмия массой 9,472 г при 80 °С. Степень диссоциации соли в этом растворе равна 32,6%. Давление пара водыпри этой температуре 473 гПа.
3. Давление пара воды при 55 °С равно 157 гПа. При растворении хлорида калия массой 7,45 г в воде массой 1000 г давление пара понизилось на 0,52 гПа. Вычислите кажущуюся степень диссоциации КС1 в этом растворе.
4. Постройте график зависимости давления насыщенного пара процентного раствора хлорида натрия от температуры. Кажущуюся степень диссоциации КаСl в указанном интервале температур считаем равной 68%. Значениями давления насыщенного пара воды воспользуйтесь из задачи 30 (гл. IV, § 2). С помощью полулунной кривой определите, при какой температуре закипит раствор, если атмосферное давление равно 100 кПа. Чему равно давление пара при температуре 93 °С?,
5. Раствор, содержащий бромид натрия массой 0,933 в воде массой 33,5 г, замерзает при температуре —0,944 °С. Вычислите кажущуюся степень диссоциации NаВr в этом растворе. Криоскопическая постоянная воды 1,86 К • кг/моль.
6. Температура замерзания раствора хлорида кальция массовой долей 2,5% равна —1,2°С. Определите кажущуюся степень диссоциации соли в этом растворе. Криоскопическая постоянная воды 1,86.
7. Определите, при какой температуре замерзнет раствор хлорида цинка моляльностью 0,01 моль/кг. Кажущаяся степень диссоциации соли равна 87%. Криоскопическая постоянная воды 1,86• кг/моль.
8*. Раствор, содержащий в воде массой 100 г хлорид магния массой 2,6 г, замерзает при —1,4°С. Вычислите изотонический и осмотический коэффициенты К(Н2)О) = 1,86 К • кг/моль.
9. Сколько граммов свекловичного сахара содержится в воде массой 100 г, если этот раствор замерзает при той же температуре, что и раствор хлорида калия молярной концентрации 0,1 моль/л? (кажущаяся степень диссоциации соли равна 83%).
10*. При какой температуре замерзает раствор, содержащий в воде массой 50 г нитрат кальция массой 3,35 г? Кажущаяся степень диссоциации Са(NО3)2 равна 69,5%. Удельная теплота плавления льда 333,7 Дж/г.
11*. Определите давление пара хлорида натрия, который замерзает при температуре —1 °С. Давление пара воды при этой температуре 28 гПа; К (Н2О) = 1,86 К • г/моль.
12. Определите температуру кипения раствора, содержащего в 1 кг воды 0,01 моль хлорида бария, если кажущаяся степень диссоциации его равна 87%. Эбуллиоскопическая постоянная воды 3,512.
13. Раствор, содержащий хлорид аммония массой 0,75 г в воде массой 100 г, кипит при температуре 100, 128 °С. Вычислите кажущуюся относительную молекулярную массу и кажущуюся степень диссоциации хлорида аммония в этом растворе. Эбуллиоскопическая постоянная воды 0,512 К • кг/моль.
14. Раствор, содержащий в воде массой 25 г бензойную кислоту массой 0,608 г, кипит при 100,104 °С. Эбуллиоскопическая постоянная воды 0,512. К слабым или сильным электролитам относится бензойная кислота?
15. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли, если раствор, содержащий в воде массой
100 г сульфат натрия массой 2,25 г, Кипит при температуре 100,186 °С. Эбуллиоскопическая постоянная воды 0,512 К*кг/моль.
16*. Определите осмотическое давление при 25 °С раствора хлорида калия молярной концентрации 0,1 моль/л. Кажущаяся степень диссоциации КСl в этом растворе 83%.
17*. Вычислите осмотическое давление при 17 °С раствора хлорида магния массовой долей 3,7%. Плотность раствора равна 1,03 г/см3, а кажущаяся степень диссоциации соли 70,5%.
18. При 18 °С осмотическое давление раствора хлорида натрия молярной концентрации 0,5 моль/л равно 2,1 • 106 Па. Вычислите кажущуюся степень диссоциации NаСl в этом растворе.
19*. Найдите молярную концентрацию раствора мочевины, который изотоничен с раствором хлорида бария молярной концентрации 0,01 моль/л при 20 °С. Кажущаяся степень диссоциации ВаСl2 равна 87%.
20*. При 17 °С осмотическое давление раствора сульфата калия молярной концентрации эквивалента 0,1 моль/л равно 300,8 кПа. Вычислите изотонический и осмотический коэффициенты.
21*. Определите молярную концентрацию ионов Аl3+ и Сl- в растворе хлорида алюминия молярной концентрации эквивалента 0,1 моль/л, если кажущаяся степень диссоциации соли равна 65%.
22*. Вычислите молярную концентрацию эквивалента сульфата калия, если кажущаяся степень диссоциации соли в этом растворе 63%, а молярная концентрация иона K+ 0,315 моль/л.
