
§ 3. Максимальная работа и химическое сродство
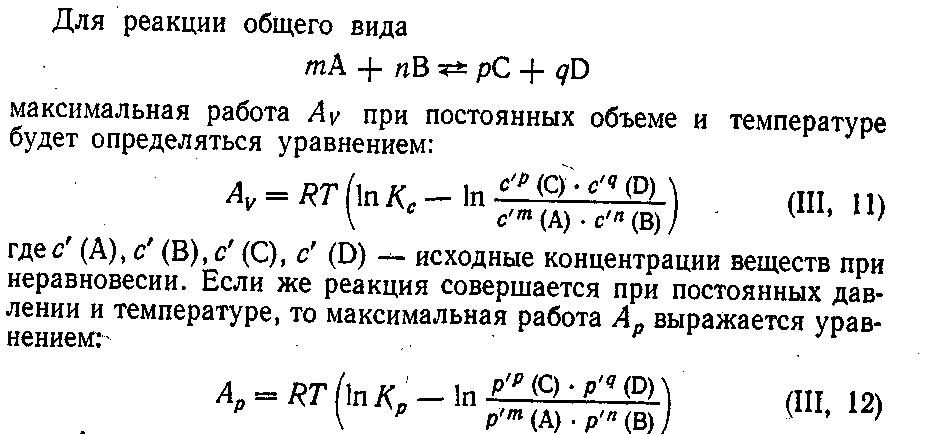
где р' —- исходные неравновесные парциальные давления участвующих в реакции веществ.
Эти уравнения называются уравнениями изотермы химических реакций Вант-Гоффа.
Если максимальная работа реакции получается положительной, то реакция может идти самопроизвольно в прямом направлении; если же отрицательной, то она будет самопроизвольно идти в обратном направлении. Реакция не идет, если А = 0.
Свойство веществ вступать между собой в химическое взаимодействие называется химическим сродством.
Если концентрации исходных веществ и продуктов реакции при неравновесных условиях равны 1 моль/л, а температура 298 К (стандартные условия), то изотерма реакции имеет вид:
![]()
Изотерма реакции, выраженная через парциальные давления в стандартных условиях (давление 1,013 • 105 Па, температура —298 К), имеет вид:
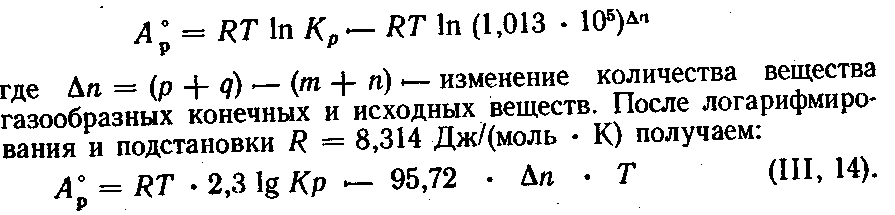
Максимальную работу называют нормальным химическим сродством и обозначают А0v (A°p).
Таким образом, мерой нормального химического сродства является максимальная работа реакции при стандартных условиях. Выражают химическое сродство в джоулях на моль. Для конденсированных систем различием между АV и Ар можно пренебречь.
Мерой химического сродства, или мерой способности веществ к химическому взаимодействию, может служить также и убыль свободной энергии. Свободной энергией системы называется та часть внутренней энергии, которая может быть изотермически (без изменения температуры) превращена в работу:
U = F + TS
где U — внутренняя энергия; F — свободная энергия; Т — связанная энергия. Согласно второму закону термодинамики все самопроизвольно протекающие процессы стремятся к состоянию равновесия. Чем дальше система находится от равновесия, Тем большим запасом свободной энергии она располагает и, следовательно, тем большую работу она может выполнить. Другими словами, химическая реакция по мере приближения к состоянию равновесия уменьшает свою способность совершать работу, т. е, свободная энергия ее убывает и, очевидно, при равновесии уменьшение свободной энергии системы будет равно 0.
Убыль свободной энергии равна максимальной работе реакции, взятой с обратным знаком:
-ΔF = АV
Если изменение свободной энергии происходит в стандартных условиях, то оно будет называться стандартным. Стандартное изменение свободной энергии при постоянном объеме будет равно:
-ΔF0298 = A0V = RT lnKc = 2.3 lgKc (III, 15)
Величину ΔF0298 также называют стандартным изохорным потенциалом системы или термодинамическим потенциалом при постоянном объеме.
Максимальная работа при постоянном давлении в стандартных условиях (А °) есть стандартное изменение изобарного термодинамического потенциала системы (ΔG0298):
![]()
Зависимость константы равновесия от температуры определяется уравнениями изохоры и изобары реакций Вант-Гоффа:
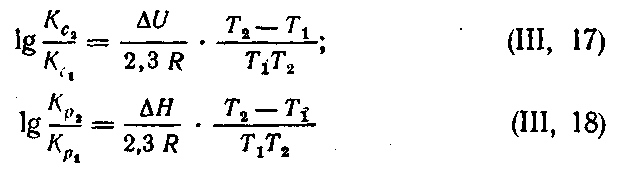
где ΔU иΔH — значения тепловых эффектов реакции соответственно при постоянном объеме и при постоянном давлении. Их можно считать постоянными, если разность температур невелика. Эти уравнения дают возможность рассчитать константы равновесия при любой температуре, если известен тепловой эффект реакции, и наоборот.
Примеры
1. Константа равновесия реакции Н2+I2 ↔ 2Н1 при 300 °С равна 80. Определить при этой температуре химическое сродство газообразных водорода и йода и направление реакции.
Решение. Химическое сродство определяем по уравнению (III, 14): Δn = 0. Подставляем данные задачи в уравнение и решаем его:
![]()
Реакция идет в сторону образования йодоводорода.
2. Определить давление диссоциации СаСО3 при температуре 837 °С, если сродство оксида кальция к углекислому газу, взятому под давлением 1,013 • 105 Па, равно 8583 Дж.
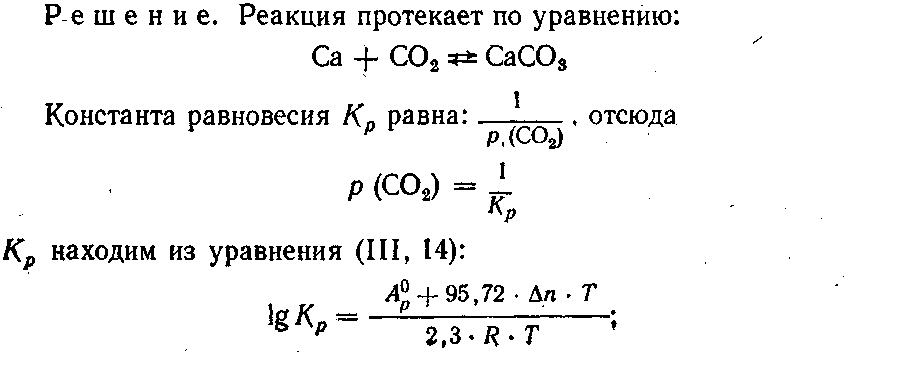
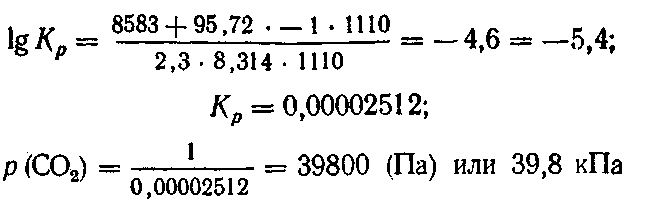

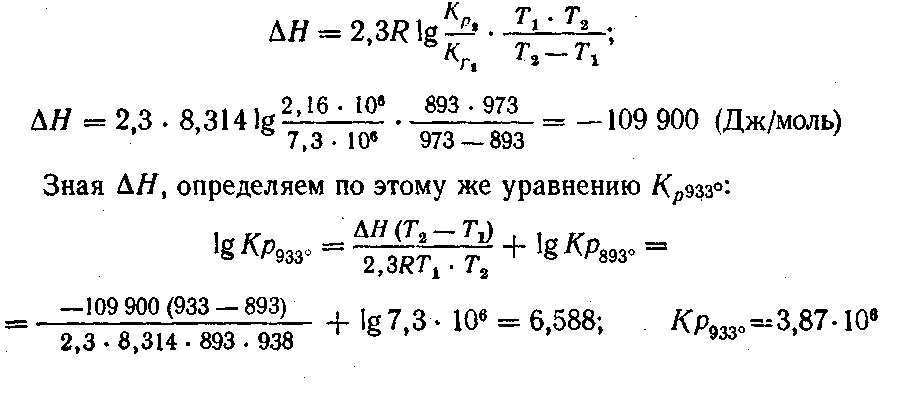
Вопросы и упражнения
24. Напишите уравнения изотермы химической реакции общего вида:
aK + bL ↔ cM + dN.
Зависимость между какими величинами они устанавливают? Каково практическое значение этих уравнений?
25. Что такое химическое сродство? Что является мерой нормального химического сродства?
26. Что такое свободная энергия? Какая существует математическая связь между стандартной свободной энергией и максимальной работой химической реакции при постоянном объеме? Что такое стандартный изобарный изотермический потенциал системы?
27. Для реакции 2NО2 ↔ N2О4 изобарный термодинамический потенциал ΔG при 0°С равен --9,8 кДж, а при 100 °С 7,9 кДж. Укажите, в каком направлении будет смещаться равновесие при повышении температуры смеси и при охлаждении ее?
28. Амфотерные свойства оксида алюминия характеризуют следующие реакции:
![]()
Какая функция оксида алюминия (кислотная или основная) проявляется ярче?
29. Для реакции Fе2О3 + 2Н2 ↔ 2Fе + ЗН2О изобарный потенциал до температуры 405 °С имеет положительные значения, а при температуре выше 405 °С — отрицательные. Какова вероятность реакций восстановления и окисления железа в зависимости от температуры?
30. Как изменяется максимальная работа химической реакции по мере приближения ее к состоянию равновесия?
31. Напишите уравнения изохоры и изобары химической реакции. Какие величины они связывают? Каково их практическое значение?
Задачи
32. Вычислите максимальную работу (химическое сродство) реакции
СО+Н2О ↔ СО2 +Н3
при температуре 960 К и при 1160 К, если константы равновесия при данных температурах соответственно равны: Кp960 — 1,78.и Кp1160 — 0,83. Определите направление реакции.
33. Определите химическое сродство меди к кислороду при температуре 500 °С, если константа равновесия реакции при этой температуре равна 1,013 • 1010 Па-1.
34. Определите температуру, при которой давление диссоциации СаСО3 на СаО и СО2 равно 0,56- 105 Па, а химическое сродство СаО к СО2 равно 5568 Дж/моль.
35. Вычислите константу равновесия реакции
С12 + Н2 ↔ 2НС1
при температуре 227 °С, если максимальная работа ее при этой температуре равна 19,29 кДж.
36. Определите химическое сродство оксида кальция к углекислому газу, находящемуся под давлением 101,3 кПа при температуре 857 °С, если давление диссоциации СаСО3 при этой температуре равно 56 кПа.
37. Константа равновесия реакции
Н2+ I2 ↔ 2НI
при температуре 420 °С равна 50. Будет ли происходить образование иодоводорода в газовой смеси, состоящей из водорода, иода и иодоводорода, если концентрации этих веществ имеют следующие значения:
а) с (Н2) = 2 моль/л; с I2= 5 моль/л; с (НI) = 10 моль/л;
б) с (Н2) = 1,5 моль/л; с (I2) = 0,25 моль/л; с (НI) = 5 моль/л;
в) с (Н2) = 1 моль/л; с (I2,) — 2 моль/л; с (НI) = 10 моль/л?
