
- •Змістовий модуль 6. Рівновага фаз та фазові переходи
- •Іі розділ фазовий перехід
- •Ііі розділ Види фазових переходів
- •Іv розділ Співіснування фаз
- •Тиск насиченої пари однозначно визначається температурою.
- •Унаслідок зміни кількості частинок у системі.
- •Речовина перетікає до тієї фази, хімічний потенціал якої менший. Більш стійка та фаза, яка має найменший хімічний потенціал.
- •Vрозділ Фазові діаграми
- •1 . Потрійна точка
- •2. Крива сублімації
- •Крива випаровування
- •4. Крива плавлення
- •6. Кристали й аморфні тверді тіла
- •VI розділ Рівняння Клапейрона—Клаузіуса
- •VII розділ Метастабільні стани
VII розділ Метастабільні стани
Точки на кривій фазової рівноваги відповідають рівноважним станам двофазної системи.
Ці стани найбільш імовірні. Але спостерігаються і менш імовірні МЕТАСТАБІЛЬНІ СТАНИ.
Наприклад, рідина, нагріта до температури кипіння, не обов'язково відразу починає перетворюватись на пару. Можливі стани ПЕРЕГРІТОЇ РІДИНИ. Можна також одержати ПЕРЕНАСИЧЕНУ або ПЕРЕОХОЛОДЖЕНУ ПАРУ.
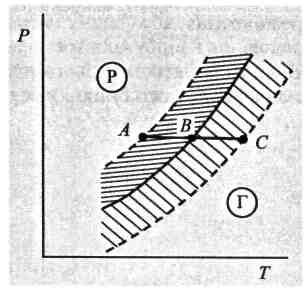
І взагалі, біля кривої фазової рівноваги по обидва її боки існують області метастабільних станів (рис. 9). Іноді користуються виразом: «вторгнення фази в суміжну область». Якщо вторгнення відбувається не дуже далеко на чужу територію, то метастабільний стан може існувати достатньо довго. У разі глибших вторгнень стійкість метастабільного стану різко зменшується, мізерні зовнішні впливи руйнують метастабільний стан і система стрибком переходить до стабільного рівноважного стану.
Можна ретельно очищену воду в чистій посудині нагріти за атмосферного тиску до 120 -5-130 °С. Але достатньо легкого поштовху посудини, і вода миттєво перетвориться на пару.
І снування
метастабільних станів пов'язане з
кінетикою фазових переходів.
Фазовий перехід починається з виникнення
ЗАРОДКІВ
НОВОЇ
ФАЗИ. При кипінні — це мікробульбашки
пари, при твердненні — це мікрокристалики.
снування
метастабільних станів пов'язане з
кінетикою фазових переходів.
Фазовий перехід починається з виникнення
ЗАРОДКІВ
НОВОЇ
ФАЗИ. При кипінні — це мікробульбашки
пари, при твердненні — це мікрокристалики.
Для створення зародка потрібно витратити енергію, яка витрачається на створення поверхні поділу між фазами. Тобто йдеться про поверхневу енергію. Тиск усередині бульбашки пари більший, ніж зовні, через стискувальну дію поверхневого натягу:
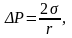
де
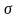 —
коефіцієнт поверхневого натягу;
—
коефіцієнт поверхневого натягу;
r — радіус бульбашки.
Р зростає зі зменшенням радіуса бульбашки, тобто маленькі зародки — аз них усе і починається — нежиттєздатні. У чистій рідині бульбашки взагалі не можуть з'явитися, оскільки потрібні величезні перегріви рідини.
Вони з'являються або на виступах шорсткості стінок посудини, або на порошинках та інших мікрочастинках. Але в будь-якому разі потрібне перегрівання.
Причиною, яка затримує створення кристалічної фази при затвердінні, може бути велика в'язкість рідини. Так виникають аморфні тіла — ці, по суті, переохолоджені рідини.
Поняття метастабільний стан набагато ширше, ніж затримка появи нової фази. У квантових системах правилом є збуджений стан. Явище люмінесценції складних молекул, або післясвітіння розріджених газів, пов'язане саме з метастабільними станами.
РІДКІ РОЗЧИНИ
Порівняно рідко доводиться мати справу з чистими рідинами, тобто такими, які містять у собі частинки одного якогось виду. В більшості випадків зустрічаються рідини, які являють собою суміш різних речовин. Якщо одна з них є в такій суміші в кількості набагато більшій, ніж інші, то суміш називається розчином, а речовина, яка переважає, є розчинником. В цьому параграфі ми ознайомимось з деякими властивостями рідких розчинів, причому ми обмежимось лише випадком бінарних розчинів, які складаються тільки з двох речовин – розчинника і розчиненої речовини.
Концентрація. Кількісно розчини характеризуються концентрацією, яка визначає вміст тієї чи іншої частини розчину. «Є багато способів виражати концентрацію. Ми подаємо тут тільки найважливіші.
Вагова частка – відношення ваги даної складової частини до ваги всього розчину. Якщо виразити її в процентах, то ми дістанемо вагову концентрацію
Полярна частка – відношення числа молів розчиненої речовини до загального числа молів у розчині. Виражена в процентах, вона називається молярною концентрацією. Такий спосіб задавати концентрацію особливо зручний бо він в той самий час визначає співвідношення кількості молекул, з яких складається розчин речовин. Для речовин, які складаються не з молекул, а з атомів, так само визначається атомна концентрація.
Якщо в розчині є n1 молів однієї речовини і n2 молів другої, то молекулярні концентрації виражаються так: молярна концентрація речовини 1
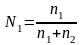
молярна концентрація речовини 2
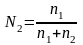
3. Молальність – число молів розчиненої речовини в 1000 грамах розчинника.
Ясно, що різні значення здобутих таким чином концентрацій можна легко перевести з одного в інше.
У деяких особливих випадках концентрацію розчину характеризують величиною його густини і виражають в особливих умовних одиницях – в поділках приладу для вимірювання густини – ареометра.
При вивченні властивостей розчинів концентрація, нарівні з тиском і температурою, є основним параметром стану.
У деяких випадках речовини можуть розчинятися одна в одній необмежено, тобто концентрація розчину може бути будь-яка. Прикладом може бути розчин спирту у воді або води у спирті. Є й такі речовини, які в даному розчиннику можуть розчинятися тільки до певної найвищої концентрації. Дальше розчинення при даних тиску і температурі неможливе. Ця максимальна рівноважна концентрація називається розчинністю. Розчин з максимальною концентрацією (тобто з концентрацією, яка дорівнює розчинності), називається насиченим розчином.
Розчинність звичайно залежить від температури і тиску, взагалі кажучи, зростаючи з підвищенням температури і зменшуючись з підвищенням тиску.
Механізм розчинення. Багато властивостей розчинів, навіть при малих концентраціях розчиненої речовини, помітно відрізняються від властивостей чистих рідин, зокрема і від властивостей чистого розчинника. Це зв'язано з тим, що в розчинах ми маємо справу з складнішими взаємодіями частинок. Якщо властивості звичайних рідин визначаються взаємодіями частинок між собою, то це вірно і для розчинів.
Але в чистих рідинах всі частинки однакові, а в розчинах є частинки різних речовин. Якщо, наприклад, в рідині А розчинена речовина В, то в такому розчині відіграють роль взаємодія частинок А між собою (взаємодія А–А), частинок В між собою (В – В) і частинок А з частинками В (А – В). Всі ці взаємодії різні, величина і відносна роль кожної з них залежить від концентрації і тому зрозуміло, що рідкий розчин є значно складнішою системою, ніж звичайна рідина, хоч розчинена речовина рівномірно розподілена у розчиннику, так що розчин являє собою однофазну систему.
Саме розчинення є наслідком взаємодії частинок розчиненої речовини з пластинками розчинника. Саме вони ослаблюють сили притягання, які удержують разом частинки речовини, яка розчиняється, так що завдяки тепловим рухам вони розходяться і поступово (механізм дифузії) розподіляються по всьому об'єму розчинника. В багатьох випадках розчинення супроводиться зміною самої природи частинок розчиненої речовини. Так буває, наприклад, при розчиненні у воді солей, кислот і лугів. Молекули таких речовин в розчині розпадаються на окремі частини – іони, які несуть позитивний і негативний електричні заряди, так що в розчині уже немає тих молекул, з яких складалась речовина до її розчинення.
Теплота розчинення. Розділення частинок розчиненої речовини переведення їх у розчин потребують затрати енергії. Адже ці частинки до розчинення зв'язані між собою силами притягання. Проти цих сил і повинна бути виконана робота. Ця робота виконується силами взаємодії між частинками розчиненої речовини і розчинника. Енергію розчинення називають теплотою розчинення. її відносять до одного моля розчиненої речовини і вимірюється вона в кал/моль.
Через те що теплота, яка витрачається на розчинення (роз ділення частинок розчиненої речовини), береться з запасів внутрішньої енергії розчинника, то розчинення повинно приводити до охолодження розчинника, а отже, і всього розчину. Саме так і буває в багатьох випадках, наприклад, при розчиненні солей у воді. Однак розчинення часто приводить не до охолодження, а, навпаки, до нагрівання розчину. Всім відоме, наприклад, сильне нагрівання рідини, яке супроводить розчинення сірчаної кислоти у воді. Пояснюється це тим, що між частинками розчинника і розчиненої речовини можуть діяти особливо великі сили притягання, завдяки яким вони з великими швидкостями мчаться одна до одної з'єднуються в особливі комплекси. Тепло, яке виділяється від цього, не тільки компенсує, а й значно перевищує ефект охолодження при розчиненні.
Можливі і такі розчини, при утворенні яких теплота не виділяється і не вбирається. Для цього потрібно, щоб сили взаємодії будь-яких частинок у розчині були однакові. Це означає, що всі три види взаємодії – А – А, В – В і А – В повинні бути однакові. Такі розчини називаються ідеальними розчинами. До. них близькі деякі реальні розчини, наприклад, метиловий спирт (СНзОН) в етиловому спирті (С2Н5ОН), бензол в толуолі і т. д. За деякими ознаками ідеальними можна вважати і будь-які реальні розчини, якщо концентрація речовини, яка в них розчинена, досить мала.
Пружність насиченої пари над ідеальним розчином. Завдяки присутності розчиненої речовини кількість молекул розчинника на її поверхні (так само як і в об'ємі) менша, ніж їх було б у чистому розчиннику. Відповідно до цього кількість молекул розчинника, що випаровується з такої поверхні, а отже, і тиск його насиченої пари над розчином, буде менший, ніж над поверхнею чистої речовини (якщо розчинена речовина теж може випаровуватись, то йдеться тут про парціальний тиск пари розчинника).
Легко
зрозуміти, що ця пружність пари повинна
бути пропорціональною концентрації
розчинника в розчині. Якщо в розчиннику
А
розчинена
речовина В,
причому
концентрація А
дорівнює
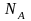 то
тиск пари рА
визначається
очевидною рівністю
то
тиск пари рА
визначається
очевидною рівністю
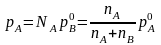 (7.50)
(7.50)
де
 i
–
число молів речовин А
і
В
відповідно
і
i
–
число молів речовин А
і
В
відповідно
і
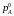 –
тиск насиченої пари чистої речовини А
при
тій самій температурі. Ті самі міркування
стосуються, звичайно, і розчиненої
речовини, для якої справедлива
аналогічна рівність
–
тиск насиченої пари чистої речовини А
при
тій самій температурі. Ті самі міркування
стосуються, звичайно, і розчиненої
речовини, для якої справедлива
аналогічна рівність
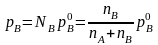 (7.50,
а)
(7.50,
а)
де
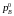 -тиск
насиченої пари над чистою речовиною В.
-тиск
насиченої пари над чистою речовиною В.
Проста закономірність, виражена рівностями (7.50) і (7.50, а), називається законом Рауля (1884 р.). Як уже зазначалося, цей закон справедливий для ідеальних розчинів. Але він добре виконується і для будь-яких слабких розчинів. Тільки в останньому випадку йдеться здебільшого про пружність пари розчинника (саме для цього випадку і був відкритий закон Рауля). В тому випадку, коли в рідкому розчиннику розчинено нелетку речовину, пара над розчином складається тільки з частинок розчинника.
Зауважимо, що, як легко переконатися, рівності (7.50) і (7. 50, а) можна записати і в такому вигляді:
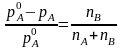
(7.51)
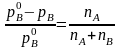
У лівій частині цих рівностей стоїть відносна зміна тиску пари однієї з компонент в результаті того, що вона входить до складу розчину. З формул видно, що відносна зміна рівноважного тиску пари однієї з компонент дорівнює концентрації другої компоненти. Зокрема, коли розчинена речовина нелетка, формула (7.51) означає, що відносна зміна пружності насиченої пари розчинника дорівнює концентрації розчиненої речовини.
У реальних розчинах тиск пари компонент порівняно з відповідними чистими речовинами змінюється не тільки внаслідок зміни відносного числа частинок, що випаровуються. Тут, крім того, відіграє роль те, що сили притягання між різними частинками (А – В) відрізняються від сил взаємодії однакових частинок (А – А і В – В). Ясно, що коли наприклад, сили А – В перевищують сили А – А і В – В, то вони перешкоджатимуть випаровуванню частинок з розчину, і пружність насиченої пари буде менша, ніж це випливає з закону Рауля. З другого боку, може трапитися і так, що присутність частинок В зменшує сили А – А, а частинки А ослаблюють сили притягання В – В. Тоді частинки обох компонент випаровуватимуться з розчину набагато легше, ніж з чистих речовин, і тиск пари над розчином буде більший, ніж потрібно за законом Рауля. Таким чином, в реальних розчинах завжди спостерігаються відхилення від закону Рауля і на підставі цих відхилень можна судити про характер сил взаємодії між частинками розчину.
Закон Генрі. Як ми бачили, закон Рауля в ідеальних розчинах в однаковій мірі відноситься і до розчинника і до розчиненої речовини. Відповідно до цього закону пружність насиченої
пари розчиненої речовини ррв над розчином пропорціональна концентрації цієї речовини в розчині:
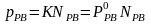 (7.
52)
(7.
52)
де К – стала, яка дорівнює (для ідеальних розчинів) тиску насиченої пари над чистою речовиною при тій самій температурі. Тут ідеться про насичену пару. Це означає, що кількість частинок, які переходять з розчину в пару, дорівнює кількості частинок, які повертаються з пари назад у розчин. Тому з однаковим правом можна говорити про випаровування розчиненої речовини з розчину і про розчинення її пари у розчиннику. Якщо розглядати саме цей останній процес, тобто процес розчинення пари (або взагалі, будь-якого газу) в рідині, то рівність (7. 52) слід переписати у вигляді:
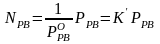
Це означає, що концентрація газу, розчиненого в рідині, пропорціональна його тиску над розчином.
Це твердження називається законом Генрі (1803 р). Закон цей строго справедливий тільки для ідеальних розчинів, тобто таких, для яких виконується закон Рауля. В реальних розчинах завжди спостерігаються відхилення від закону Генрі.
Температура кипіння розчинів. В тому випадку, коли розчинена речовина нелетка і вона з розчину не випаровується, пара над розчином складається тільки з частинок розчинника. З того, про що говорилося раніше, ясно, що пружність такої насиченої пари над розчином менша, ніж пружність тієї самої пари над чистим розчинником при тій самій температурі і це зниження тиску пари визначається законом Рауля.
Наслідком такої зміни пружності насиченої пари є зміна температури кипіння розчину порівняно з температурою кипіння чистого розчинника. Нам уже відомо, що точка кипіння – це та температура, при якій тиск насиченої пари рідини дорівнює зовнішньому тиску (наприклад, атмосферному). А через те, що тиск насиченої пари над розчином менший, ніж над чистою речовиною, то розчин треба нагріти до значно вищої температури для того, щоб цей тиск дорівнював зовнішньому. Це означає, що температура кипіння розчину вища, ніж чистого розчинника.
Користуючись законом Рауля, який визначає зниження пружності пари над розчином, і рівнянням Клаузіуса – Клапейрона, що зв'язує температуру кипіння рідини з зовнішнім тиском, можна вивести таку рівність для зниження точки кипіння розчину:
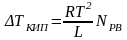 (7.
53)
(7.
53)
Тут
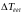 –
різниця між точками кипіння розчину і
чистого розчинника, L
–
молярна захована теплота випаровування
чистого розчинника і
–
різниця між точками кипіння розчину і
чистого розчинника, L
–
молярна захована теплота випаровування
чистого розчинника і
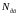 –
концентрація розчину (молярна частина
розчиненої речовини).
–
концентрація розчину (молярна частина
розчиненої речовини).
Якщо замість молярної концентрації скористатися молальністю, то рівність (7. 53), в чому легко переконатися, матиме (для слабких розчинів) вигляд
 (7.54)
(7.54)
де
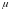 –
молекулярна вага розчиненої речовини,
і m
–
молальність розчину. Цю рівність можна
використати для визначення' молекулярної
ваги ц розчиненої речовини за вимірюванням
зміни точки кипіння розчину, в якому
вона міститься (ебуліоскопія). Рівняння
(7.53) і (7.54) особливо добре здійснюються
для слабких розчинів.
–
молекулярна вага розчиненої речовини,
і m
–
молальність розчину. Цю рівність можна
використати для визначення' молекулярної
ваги ц розчиненої речовини за вимірюванням
зміни точки кипіння розчину, в якому
вона міститься (ебуліоскопія). Рівняння
(7.53) і (7.54) особливо добре здійснюються
для слабких розчинів.
Осмотичний тиск. Уявімо собі, що в одній посудині стикаються один з одним розчин і чистий розчинник. Очевидно, що частинки розчиненої речовини переходитимуть з розчину в розчинник і цей процес дифузії закінчиться лише тоді, коли буде досягнуто рівноваги, тобто коли розчинена речовина рівномірно розподілиться по всьому об'єму розчинника. Так само, якщо будуть поруч не розчин і розчинник, а два розчини різних концентрацій, то й тут відбуватиметься дифузія частинок розчиненої речовини з більш концентрованого у слабший розчин, поки концентрація не буде однакова в усьому об'ємі. Розчинена речовина наче розширюється, прагнучи зайняти увесь доступний їй об'єм розчинника, зовсім так само, як розширюється газ, щоб зайняти весь наданий йому об'єм.
Подібно до того, як газ тисне на стінки посудини, а при розширенні може виконати роботу переміщення стінки, якщо вона рухома (поршень), розчинена речовина теж повинна тиснути на ту межу, яка розділяє розчин і чистий розчинник або два розчини з різними концентраціями (різниця концентрацій тут відіграє таку саму роль, яку в газах відіграє різниця тисків). Цей тиск можна спостерігати, якщо помістити між розчином і чистим розчинником напівпроникну перегородку, тобто перегородку, через яку легко проходить розчинник, але не проходить розчинена речовина (рис. 7.36). Тоді розчинник переходитиме в розчин і рівень рідини в тій частині посудини, де є розчин, підвищуватиметься. Частинки розчиненої речовини наче намагаються просунути перегородку крізь розчинник, але фактично переміщається не жорстко закріплена перегородка, а рівень рідини (якби можна було зробити напівпроникний рухомий поршень, то переміщався б саме він). Тиск, який розчинена речовина робить на напівпроникну перегородку, називається осмотичним тиском, а викликане цим проникнення розчинника в розчин називається осмосом. Рівень рідини розчину підніматиметься доти, поки виниклий гідростатичний тиск не дорівнюватиме осмотичному тиску. Можна не допускати піднімання рівня, якщо прикласти до розчину зовнішній тиск. Те значення цього тиску, яке потрібне буде для збереження рівності рівнів по обидва боки перегородки, очевидно, і дорівнює осмотичному тиску.
Осмотичний
тиск, як показує дослід, пропорціональний
концентрації розчину і обернено
пропорціональний його об'єму.] Він
залежить також від температури. Вант-Гофф
показав (1887 р.), що зв'язок між цими
величинами має вигляд:
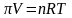
Тут
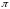 –
осмотичний тиск, V
–
об'єм розчину, n
–
число молів розчиненої речовини, R
– універсальна газова стала і Т
–
температура.
–
осмотичний тиск, V
–
об'єм розчину, n
–
число молів розчиненої речовини, R
– універсальна газова стала і Т
–
температура.
Закон, що виражається цим рівнянням, називається законом Вант-Гоффа.
Цілковита схожість рівняння закону Вант-Гоффа з рівнянням стану ідеальних газів показує, що частинки розчиненої речовини у слабкому розчині поводяться так само, як молекули ідеального газу, так що закон Вант-Гоффа можна сформулювати: так осмотичний тиск розчиненої речовини дорівнює тискові тієї самої речовини в газоподібному стані в тому самому об'ємі і при тій самій температурі. Осмотичний тиск, звичайно, не залежить від виду напівпроникної перегородки або від роду розчинника. Ясно, що будь-які розчини з однаковою молярною концентрацією роблять однаковий осмотичний тиск.
Схожість у поведінці розчиненої речовини і ідеального газу зумовлена, звичайно, тим, що в дуже розбавленому розчині частинки розчиненої речовини не взаємодіють між собою, так само, як не взаємодіють і частинки ідеального газу.
Слід відзначити, що закон Вант-Гоффа стає несправедливим у тих випадках, коли розчинена речовина при розчиненні розпадається на іони (дисоціює). Отже, це стосується всіх розчинів кислот, солей і лугів (електролітів).
Осмотичний тиск відіграє велику роль у житті тварин і рослин. Ним у значній мірі визначається розподіл води і розчинених у ній речовин в тканинах. Це зв'язане з тим, що оболонки багатьох органів являють собою напівпроникні перегородки.
