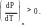- •Змістовий модуль 6. Рівновага фаз та фазові переходи
- •Іі розділ фазовий перехід
- •Ііі розділ Види фазових переходів
- •Іv розділ Співіснування фаз
- •Тиск насиченої пари однозначно визначається температурою.
- •Унаслідок зміни кількості частинок у системі.
- •Речовина перетікає до тієї фази, хімічний потенціал якої менший. Більш стійка та фаза, яка має найменший хімічний потенціал.
- •Vрозділ Фазові діаграми
- •1 . Потрійна точка
- •2. Крива сублімації
- •Крива випаровування
- •4. Крива плавлення
- •6. Кристали й аморфні тверді тіла
- •VI розділ Рівняння Клапейрона—Клаузіуса
- •VII розділ Метастабільні стани
Vрозділ Фазові діаграми
Коли рідина і пара перебувають у рівновазі, кожній температурі відповідає цілком визначений тиск. Іншими словами, стан рівноваги двох фаз повністю визначається заданням ЛИШЕ ОДНОГО термодинамічного параметра. Існує однозначний зв'язок температури і тиску. На рис. 3 зображено цю залежність для рівноваги рідини і пари. Лінія називається КРИВОЮ ВИПАРОВУВАННЯ. Вона поділяє всю площину ФАЗОВОЇ ДІАГРАМИ на дві області.
П раворуч
міститься область газу або пари, ліворуч
— область рідини. Точкам на кривій
відповідають стани рівноважного
співіснування рідини і пари. Тому цю
криву часто називають ЛІНІЄЮ
ФАЗОВОЇ РІВНОВАГИ.
раворуч
міститься область газу або пари, ліворуч
— область рідини. Точкам на кривій
відповідають стани рівноважного
співіснування рідини і пари. Тому цю
криву часто називають ЛІНІЄЮ
ФАЗОВОЇ РІВНОВАГИ.
З вичайно,
лінії фазової рівноваги можна провести
для будь-яких фаз, що співіснують. Лінія
фазової рівноваги між кристалом і
рідиною називається КРИВОЮ
ПЛАВЛЕННЯ,
між кристалом і газом — КРИВОЮ
СУБЛІМАЦІЇ.
Лінії фазової рівноваги між двома
твердими фазами не мають власної назви.
вичайно,
лінії фазової рівноваги можна провести
для будь-яких фаз, що співіснують. Лінія
фазової рівноваги між кристалом і
рідиною називається КРИВОЮ
ПЛАВЛЕННЯ,
між кристалом і газом — КРИВОЮ
СУБЛІМАЦІЇ.
Лінії фазової рівноваги між двома
твердими фазами не мають власної назви.
На рис. 4 зображено типову фазову діаграму для речовини, яка має тільки три фази: кристалічну, рідку і газоподібну. На ній є криві сублімації, плавлення і випаровування. Вони чітко поділяють усю площу фазової діаграми на однофазні області, де існують тільки кристал, тільки рідина і тільки газ. Точки, що лежать безпосередньо на кривих фазових рівноваг, відповідають двофазним станам. Обговоримо особливості кожної кривої.
1 . Потрійна точка
Усі три криві сходяться в одній точці, яка називається ПОТРІЙНОЮ ТОЧКОЮ. У цьому стані одночасно співіснують всі три фази: кристал, рідина і газ. Така точка тільки одна, тобто існує тільки один стан, в якому співіснують три фази. Цей стан визначається ПАРАМЕТРАМИ ПОТРІЙНОЇ ТОЧКИ Рп і Тn. Для води Рn = 609Па, Тп = 273,16 К;
для вуглекислоти Рn = 5,16 • 105 Па, Тп = 215,6 К.
Індивідуальна хімічна речовина (однокомпонентна система) не може в стані рівноваги мати більше трьох фаз. Це випливає з ПРАВИЛА ФАЗ ГІББСА. Формула правила фаз має такий вигляд:
V=N + K-F,
де К— кількість компонентів у системі;
N— кількість параметрів, які однакові в усіх фазах (N= 2); F— кількість фаз, що співіснують; V— кількість параметрів, які можна змінювати.
Так, для однокомпонентної однофазної системи К=1, F=1, N=2 і кількість вільних параметрів V= 2 + 1 - 1 = 2 (Р і Т або Р і V).
Для однокомпонентної системи з двох фаз K=1,F=2,N=2, а. кількість вільних параметрів К=2+1-2=1 (Р або Т).
Для однокомпонентної системи з трьох фаз К=1,F=3, N=2, а кількість вільних параметрів V=0 (потрійна точка).
А чотири фази співіснувати взагалі не можуть, бо V< 0.
2. Крива сублімації
Крива сублімації закінчується в потрійній точці, а починається в абсолютному нулі температур. За такої температури тиск також прямує до нуля, оскільки зі зменшенням температури зменшується кінетична енергія молекул і унеможливлюється перехід до газової фази.
Тиск на кривій сублімації зростає швидше, ніж температура, і похідна від тиску за температурою для; всіх речовин більша від нуля:
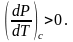
Крива випаровування
Крива випаровування починається в потрійній точці і закінчується в критичній точці, де зникає різниця між рідиною і газом. Можливий безперервний перехід із стану 1 у газі до стану 2 в рідині (пунктир) в обхід критичної точки. На всьому шляху система перебуває в однофазному стані і не можна вказати; точку, в якій густий газ перетворився б у рідину.
Можна, звичайно, перейти зі стану 1 до стану 2 і вздовж ізобари (суцільна лінія). Тоді при перетинанні кривої випаровування з'явиться друга фаза.
Крива випаровування також має додатну похідну: