
- •Змістовий модуль 6. Рівновага фаз та фазові переходи
- •Іі розділ фазовий перехід
- •Ііі розділ Види фазових переходів
- •Іv розділ Співіснування фаз
- •Тиск насиченої пари однозначно визначається температурою.
- •Унаслідок зміни кількості частинок у системі.
- •Речовина перетікає до тієї фази, хімічний потенціал якої менший. Більш стійка та фаза, яка має найменший хімічний потенціал.
- •Vрозділ Фазові діаграми
- •1 . Потрійна точка
- •2. Крива сублімації
- •Крива випаровування
- •4. Крива плавлення
- •6. Кристали й аморфні тверді тіла
- •VI розділ Рівняння Клапейрона—Клаузіуса
- •VII розділ Метастабільні стани
Ііі розділ Види фазових переходів
Розрізняють фазові переходи 1-го і 2-го роду.
Перехід рідини в газ — випаровування — це фазовий перехід 1-го роду. Густина рідини більша, ніж густина газу, тобто відстань між молекулами газу більша, ніж відстань між молекулами рідини. Згадаємо, що між молекулами існують сили притягання. Отже, потрібна енергія для виконання роботи проти цих сил для того, щоб розсунути молекули. Ця енергія називається ТЕПЛОТОЮ ВИПАРОВУВАННЯ, або ТЕПЛОТОЮ ФАЗОВОГО ПЕРЕХОДУ.
Уразі фазового переходу 1-го роду густина фаз різна і потрібна теплота фазового переходу.
У процесі зворотного переходу відстань між молекулами зменшується, і для цього потрібно відвести від речовини теплоту фазового переходу. Тому ТЕПЛОТА ВИПАРОВУВАННЯ точно дорівнює ТЕПЛОТІ КОНДЕНСАЦІІ:
L =L .
в к
Таким чином, теплота фазового переходу зумовлена різницею об'ємів фаз, що співіснують. Так, теплота сублімації більша, ніж теплота випаровування, і ще більша, ніж теплота плавлення:
L >L>L .
c в п
Більше того, щоб випарувати кристал, потрібно витратити стільки ж енергії, скільки потрібно, щоб кристал спочатку розплавити, а потім випарувати рідину. Тобто
L =L+L .
c в п
З наближенням до критичної точки різниця між об'ємом рідини і об'ємом газу зменшується. Одночасно зменшується і теплота випаровування. У критичній точці
Vn = Vp і LB = 0.
Перехід від однієї кристалічної фази до іншої з іншим типом кристалічної решітки — це фазовий перехід 2-го роду.
Фазовий перехід другого роду відбувається без зміни густини, і тому не потрібна теплота фазового переходу. Тобто
∆V =0
і L
= 0.
=0
і L
= 0.
Однак фази, що співіснують, різні, і в точці фазового переходу можуть змінюватися властивості речовини. Можуть змінюватися магнітні або сегнетоелектричні властивості, метал може перейти в напів-провідний стан, може стрибком змінюватися теплоємність, коефіцієнт лінійного розширення тощо.
Перехід гелію в надплинний стан — це теж фазовий перехід 2-го роду.
Іv розділ Співіснування фаз
Якщо помістити рідину в закриту посудину, то над рідиною з'явиться її насичена пара. За сталої температури T тиск пари Р теж залишається сталим. Отже, залишається сталою концентрація молекул у парі и, оскільки
Р = пкТ.
За іншої, вищої, але також сталої температури встановиться інший, вищий сталий тиск. При цьому зростання тиску буде більшим, ніж зростання температури. Це означає, що додатково зросла й концентрація молекул у парі.
Причина цього в тому, що зі збільшенням температури збільшується середня кінетична енергія молекул і збільшується кількість молекул, які набувають енергії, достатньої для виконання роботи проти сил притягання сусідніх молекул. Ці молекули тепер мають можливість вилетіти з рідини.
Н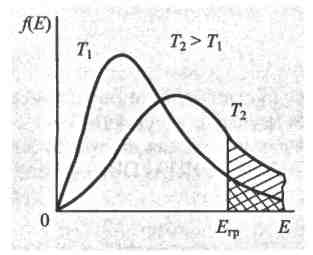 а
рис 1 зображено функцію розподілу молекул
за енергією для двох температур T1
і
T2,
причому Т2
> T1.
Бачимо,
що частка молекул, які мають однакову
енергію Ek,
потрібну для вильоту в пару, більша
для більшої температури.
а
рис 1 зображено функцію розподілу молекул
за енергією для двох температур T1
і
T2,
причому Т2
> T1.
Бачимо,
що частка молекул, які мають однакову
енергію Ek,
потрібну для вильоту в пару, більша
для більшої температури.
Отже, причина збільшення концентрації молекул у парі в наявності стаціонарного розподілу молекул за енергією.
Звичайно, молекула з пари може повернутися в рідину, тому рівновага має динамічний характер. Кількість молекул, які залишають рідину за одиницю часу, дорівнює кількості молекул, які повертаються в рідину за той самий час. І не можна сказати, яка конкретна молекула перебуває в даний час у рідині, а яка в парі. Рис. 1
Рис. 1 Умови рівноваги фаз
Як уже зазначалося, зі зміною температури змінюється і тиск насиченої пари, але нічого не було сказано про те, як змінюється тиск насиченої пари зі зміною об'єму.
Виявилось — ніяк не залежить!
Можна збільшувати об'єм посудини або зменшувати його, а тиск залишається сталим, якщо температура стала. Це означає, що залишається сталою концентрація молекул у парі, а не їх загальна кількість.
