
- •Змістовий модуль 6. Рівновага фаз та фазові переходи
- •Іі розділ фазовий перехід
- •Ііі розділ Види фазових переходів
- •Іv розділ Співіснування фаз
- •Тиск насиченої пари однозначно визначається температурою.
- •Унаслідок зміни кількості частинок у системі.
- •Речовина перетікає до тієї фази, хімічний потенціал якої менший. Більш стійка та фаза, яка має найменший хімічний потенціал.
- •Vрозділ Фазові діаграми
- •1 . Потрійна точка
- •2. Крива сублімації
- •Крива випаровування
- •4. Крива плавлення
- •6. Кристали й аморфні тверді тіла
- •VI розділ Рівняння Клапейрона—Клаузіуса
- •VII розділ Метастабільні стани
Змістовий модуль 6. Рівновага фаз та фазові переходи
Фазові переходи. Рівновага рідини та пари. Вологість повітря. Рівняння Клапейрона-Клаузіуса. Розчини. Осмотичний тиск.
І розділ Основні поняття і визначення
Речовина може перебувати в різних фазах.
ФАЗА — однорідна система з однаковими фізичними властивостями в усіх її частинах. Газ, рідина, кристал і його алотропні модифікації — усе це різні фази однієї і тієї самої речовини.
Основні особливості фаз:
Фази завжди мають фізичні межі стикання з іншими фазами цієї самої або іншої речовини.
Кожна фаза має обмежену термодинамічну область існування. Справді, за кімнатної температури й атмосферного тиску вода може існувати у вигляді рідини або газу і не може існувати у вигляді льоду.
ФАЗОВА РІВНОВАГА — стійке співіснування двох або кількох фаз. ФАЗОВИЙ ПЕРЕХІД — пряме і зворотне перетворення однієї фази в іншу. ТОЧКА ФАЗОВОГО ПЕРЕХОДУ — стан, за якого здійснюється перехід.
Приклади фазових перетворень:
ВИПАРОВУВАННЯ і КОНДЕНСАЦІЯ — перехід рідини в газ і навпаки. ПЛАВЛЕННЯ і ТВЕРДІННЯ — перехід кристала в рідину і навпаки. СУБЛІМАЦІЯ і ДЕСУБЛІМАЦІЯ — перехід кристала в газ і навпаки.
Іі розділ фазовий перехід
На прикладі явища конденсації газів можна побачити, що можуть бути два різних стани однієї і тієї ж речовини, при одних і тих же температурі і тиску. Стани ці різняться своїми властивостями.
Взагалі, якщо система поділяється на однорідні частини, що межують одна з одною і перебувають у різних фізичних станах, то ці частини називають фазами системи.
Я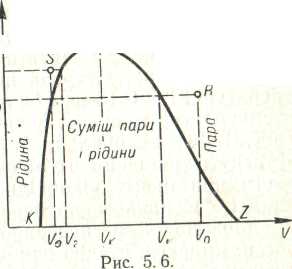 кщо
дві або більше різних фаз речовини при
даних температурі
і тиску існують одночасно, стикаючись
одна з одною, і якщо при цьому маса
однієї з фаз не зростає за рахунок іншої,
то говорять
про фазову
рівновагу. Перехід
речовини з одного етапу
(фази) в іншу називається фазовим
переходом, або
фазовим
перетворенням. Кількість
фаз, які можуть перебувати в рівновазі,
може
бути різна і залежить від складу речовини.
кщо
дві або більше різних фаз речовини при
даних температурі
і тиску існують одночасно, стикаючись
одна з одною, і якщо при цьому маса
однієї з фаз не зростає за рахунок іншої,
то говорять
про фазову
рівновагу. Перехід
речовини з одного етапу
(фази) в іншу називається фазовим
переходом, або
фазовим
перетворенням. Кількість
фаз, які можуть перебувати в рівновазі,
може
бути різна і залежить від складу речовини.
Конденсація газу, як і зворотний процес — перехід рідини в пару (випаровування), є приклади фазових переходів. Як відомо, речовина може перебувати ще її у третьому стані — твердому. Перехід газу або рідини в твердий стан — теж фазовий перехід. Але відміна твердого стану від рідкого або газоподібного значно глибша, ніж різниця між рідким і газоподібним станом.
Перевести речовину з газоподібного в рідкий стан можна, підвищуючи її тиск при даній температурі, якщо ця температура нижча за критичну. Якщо температура перевищує Тк, то потрібне попереднє охолодження. При такому перетворенні речовина повинна пройти через проміжну область двофазного стану, коли пара і рідина існують і межують одна з одною.
П

 роте
можна здійснити цей перехід і минаючи
цю область двофазних
станів. Інакше кажучи, можна перетворити
газ у рів ну
(або навпаки) без того, щоб у якийсь
момент існували обидві фази.
Наприклад, щоб газ, який характеризується
об'ємом V
тиском
р0
і
температурою То
(див.
рис. 5. 6), перетворити в рідину
при тій самій температурі і тиску, але
звичайно, з іншим об'ємом
Vо,
можна
зробити так. Треба нагріти газ до
температурі вищої
від критичної, після чого стиснути так,
щоб його об'єм дорівнював Vо'.
Нарешті, зберігаючи сталий об'єм, треба
охолодити газ до температури То.
Тиск
його при цьому дорівнюватиме
роте
можна здійснити цей перехід і минаючи
цю область двофазних
станів. Інакше кажучи, можна перетворити
газ у рів ну
(або навпаки) без того, щоб у якийсь
момент існували обидві фази.
Наприклад, щоб газ, який характеризується
об'ємом V
тиском
р0
і
температурою То
(див.
рис. 5. 6), перетворити в рідину
при тій самій температурі і тиску, але
звичайно, з іншим об'ємом
Vо,
можна
зробити так. Треба нагріти газ до
температурі вищої
від критичної, після чого стиснути так,
щоб його об'єм дорівнював Vо'.
Нарешті, зберігаючи сталий об'єм, треба
охолодити газ до температури То.
Тиск
його при цьому дорівнюватиме
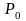 .Таким
чином, ми можемо перетворити газ у рідину
«в обхід»
області
двофазних станів, так що не буде такого
проміжного стану,
при якому з'явиться межа між рідиною і
парою (меніск). Якщо,
наприклад, треба перетворити вуглекислий
газ при температурі
21,5° С і тиску 50 атм
в
рідку вуглекислоту при тій самі
температурі,
то спочатку треба нагріти газ до
температури вищої від
31,4° С, наприклад, до 32° С. При цій
температурі газ треба стиснути
так, щоб його об'єм (питомий) дорівнював
1,5 м3/г.
Тиск
його
при цьому відповідно зросте. Після цього
охолодження до
21,5° С приведе до перетворення всього
газу в рідкий стан.
.Таким
чином, ми можемо перетворити газ у рідину
«в обхід»
області
двофазних станів, так що не буде такого
проміжного стану,
при якому з'явиться межа між рідиною і
парою (меніск). Якщо,
наприклад, треба перетворити вуглекислий
газ при температурі
21,5° С і тиску 50 атм
в
рідку вуглекислоту при тій самі
температурі,
то спочатку треба нагріти газ до
температури вищої від
31,4° С, наприклад, до 32° С. При цій
температурі газ треба стиснути
так, щоб його об'єм (питомий) дорівнював
1,5 м3/г.
Тиск
його
при цьому відповідно зросте. Після цього
охолодження до
21,5° С приведе до перетворення всього
газу в рідкий стан.
Можливість безперервного переходу з газоподібного в рідкий стан, минаючи стадію одночасного існування обох фаз, показує що між ними немає принципової якісної різниці. Самий факт існування критичного стану свідчить про те, що в певних умовам рідкий і газоподібний стани не можна відрізнити. Тому часто і говорять про безперервний перехід між ними. Перехід з твердого в рідкий або газоподібний стан не можна здійснити аналогічно, тобто так, щоб при певній температурі і тиску не існували одночасно дві фази речовини.
