- •Змістовий модуль 6. Рівновага фаз та фазові переходи
- •Іі розділ фазовий перехід
- •Ііі розділ Види фазових переходів
- •Іv розділ Співіснування фаз
- •Тиск насиченої пари однозначно визначається температурою.
- •Унаслідок зміни кількості частинок у системі.
- •Речовина перетікає до тієї фази, хімічний потенціал якої менший. Більш стійка та фаза, яка має найменший хімічний потенціал.
- •Vрозділ Фазові діаграми
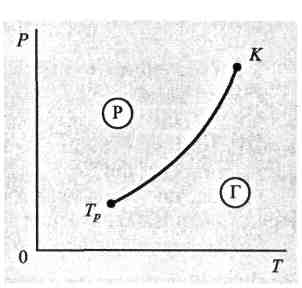
- •1 . Потрійна точка
- •2. Крива сублімації
- •Крива випаровування
- •4. Крива плавлення
- •6. Кристали й аморфні тверді тіла
- •VI розділ Рівняння Клапейрона—Клаузіуса
- •VII розділ Метастабільні стани
Тиск насиченої пари однозначно визначається температурою.
Перейдемо до формулювання умов рівноваги фаз, що співіснують. Механічна умова рівноваги: тиск в обох фазах однаковий, тобто
Р1=Р2 Умова очевидна. Інакше поверхня поділу фаз мала б зміщуватися. Теплова умова рівноваги: температура обох фаз однакова, тобто
Т1 = Т2.
Теж очевидна умова. Інакше буде напрямлений потік тепла.
Ці дві умови, безперечно, необхідні, але не достатні. Справді, зі зміною об'єму змінюється кількість молекул у фазах. Отже, потрібна ще умова, яка має характеризувати стійкість кожної фази.
Це можна зробити за допомогою так званого ХІМІЧНОГО ПОТЕНЦІАЛУ Ф, який теж є функцією стану. Він пов'язаний з ентальпією I температурою Т та ентропією S такою формулою:
Ф = I-TS.
Стверджується, що хімічний потенціал системи має залишатися незмінним. Справді, зміна хімічного потенціалу
dФ = dI-TdS-SdT,
dl = 0, оскільки в ізольованій системі dQ =dl=0;
SdT= 0, оскільки температура стала (Т= const) і dT=0;
TdS = 0, оскільки в рівноважному стані ентропія набуває максимального значення, і тому dS = 0. Отже, dФ = 0 і Ф = const.
Хімічний потенціал спеціально придумано для опису систем зі змінною кількістю частинок. Потрібно лише в усі термодинамічні потенціали ввести додатковий член із хімічним потенціалом. Якщо кількість частинок у системі стала, то зміна внутрішньої енергії
dU=TdS-PdV.
Для системи зі змінною кількістю частинок маємо:
dU=TdS-PdV+ФdN.
Звідси випливає, що хімічний потенціал дорівнює частинній похідній від внутрішньої енергії за кількістю частинок, якщо об'єм і значення ентропії сталі:
Ф=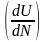
V=const
S=const
Для обчислення хімічного потенціалу можна скористатися й іншими термодинамічними потенціалами.
Хімічний потенціал визначає зміну будь-яких термодинамічних потенціалів
Унаслідок зміни кількості частинок у системі.
Хімічний потенціал — величина адитивна. Для системи, яка складається з двох фаз, сумарний хімічний потенціал
Ф = Ф1G1+Ф2G2,
де Ф1 і Ф2 — хімічні потенціали відповідно першої і другої фази; G1 і G2 — кількість речовини в першій і в другій фазі. Зміна сумарного хімічного потенціалу така:
dФ=Ф 1dG1+Ф2 dG2.
Повна кількість речовини в обох фазах стала, і тому
dG1 = - dG2
Далі
маємо: (Ф1
- Ф2)
dG1
=
0. Оскільки dG1
 0,
то Ф1
= Ф2.
0,
то Ф1
= Ф2.
В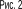 умовах рівноваги хімічні потенціали
фаз,
що співіснують, однакові.
умовах рівноваги хімічні потенціали
фаз,
що співіснують, однакові.
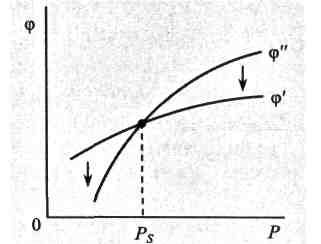
На Рис.2 наведено залежності хімічних потенціалів рідини Ф' і пари Ф" від тиску Р за сталої температури Т. При P = Ps відповідні графіки перетинаються. Тобто при тиску, який дорівнює тиску насиченої пари, хімічні потенціали рідини і пари однакові. За інших тисків рівноваги не буде і речовина перерозподілятиметься між фазами. Напрям перетікання речовини визначається нерівністю:
(Ф'-Ф") dG<0.
Якщо Ф' > Ф", то dG' > 0 — речовина перетікає від пари до рідини. Якщо Ф' < Ф", то dG' < 0 — речовина перетікає від рідини до пари.
Речовина перетікає до тієї фази, хімічний потенціал якої менший. Більш стійка та фаза, яка має найменший хімічний потенціал.