
- •Основные понятия и законы химии
- •1.1 Вещества и их свойства. Предмет химии
- •1. Атомно-молекулярное учение
- •2. Стехиометрические законы
- •2.1 Закон сохранения массы веществ
- •2.2 Закон постоянства состава.
- •2.3 Закон Авогадро
- •2.4 Закон объемных отношений газов
- •2.5 Закон эквивалентов
- •40 Г/моль Са - 2 г/моль н
- •65 Г/моль Zn — 2 г/моль н
- •1.2. Основные термины и положения термодинамики
- •1.3. Общие сведения о равновесной термодинамике
- •1.3.1. Первое начало термодинамики . Энтальпия.
- •1.3.2. Второе начало термодинамики
- •1.3.3. Третье начало термодинамики
- •1.4. Общие сведения о неравновесной термодинамике
- •1.5. «Всеобщий закон биологии» Бауэра
- •1 Периодический закон и периодическая система элементов д. И. Менделеева
- •2 Строение атома
- •3 Изотопы
- •4 Строение электронной оболочки атома
- •5 Зависимость химических свойств элементов от строения их атомов
- •6. Химическая связь.
- •1.Общая характеристика. Концентрация растворов
- •2. Растворимость
- •3. Коллигативные свойства растворов
- •Электрическая проводимость водных растворов. Электролиты
- •Сильные электролиты.
- •Металлов
- •1. Переходные металлы в живых организмах; аминокислотные остатки как лиганды
- •2. Имидазол: его строение, координационные и кислотно-основные свойства
- •3. Строение гема
- •4.Гем в белковой молекуле. Строение миоглобина
- •5. Комплекс гема с кислородом. Лиганды π -акцепторного типа.
- •6. Строение дистального кармана: дополнительная причина прочности связи железа
- •Iiiа - группа
- •Iva группа
- •Viia - группа
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
2.4 Закон объемных отношений газов
В 1808 г. Гей – Люссак сформулировал закон объемных отношений:
Объемы газов, которые при одинаковых условиях вступают в реакцию и которые получаются в результате реакции, относятся друг к другу как небольшие целые числа.
Согласно закону Авогадро равное число молекул различных газов при одинаковых условиях занимает одинаковый объем. Значит, 1 моль молекул любого газа при одинаковых условиях занимает одинаковый объем. Поэтому в реакции H2 + Cl2 = 2HCI один объем водорода соединяется с одним объемом хлора, и образуются два объема хлороводорода, т. е. объемные отношения газов 1:1:2. Эти отношения можно определить по коэффициентам, которые стоят перед газообразными соединениями в химическом уравнении. Закон объемных отношений помогает рассчитать объемы газов, которые вступают в реакцию или получаются в результате реакции.
2.5 Закон эквивалентов
Согласно закону постоянства состава различные элементы соединяются друг с другом в определенных (эквивалентных) отношениях масс.
Понятие эквивалент означает равноценный, равнозначный. Чтобы правильно понять определение химического эквивалента, рассмотрим, например, какие количества кальция и цинка понадобятся для получения 1 моль атомов Н при их взаимодействии с кислотой:
Ca + 2HCl = CaCl2 + H2↑ ,
Исходя из уравнения реакции, запишем:
40 Г/моль Са - 2 г/моль н
х » Ca – 1 » H
x = 20 г/моль Са
Для реакции Zn + 2HCl = ZnCl2 + H2↑ имеем
65 Г/моль Zn — 2 г/моль н
х » Zn - 1 » H
х=32,5 г/моль Zn
Сопоставляя данные из первой и второй пропорций, можно утверждать, что для получения 1 моль атомов Н требуется 20 г/моль Са или 32,5 г/моль Zn. Таким образом, в рассмотренных реакциях 20 г/моль Са в химическом понимании равноценны, эквивалентны 32,5 г/моль Zn, так как они вытесняют одно и то же количество водорода.
Понятие эквивалентности реагирующих веществ в химических реакциях было и остается одним из основных понятий в химии. По рекомендации ИЮПАК эквивалентом соединения называется реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. При использовании понятия «эквивалент» всегда необходимо указать, к какой конкретной реакции он относится.
В кислотно-основной реакции
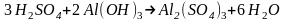
шести атомам водорода (в трех молекулах H2SO4) соответствуют две молекулы Al(OH)3. Следовательно, одному атому водорода эквивалентна 1/3 (одна треть) молекулы Al(OH)3. Число 1/3 в этом примере называется фактором эквивалентности. Его обозначают fэкв.
Единицей количества эквивалента (как любой другой структурной единицы вещества) является моль. Масса одного эквивалента вещества – эквивалентная масса (МЭ). Как и молярная масса, эквивалентная масса выражается в г/моль.
МЭ = fэкв·М
В конце XVIII в. немецкий ученый Рихтер открыл закон эквивалентов, который в настоящее время формулируется так:
Массы веществ, которые вступают в реакцию и образуются в результате реакции, пропорциональны их эквивалентным массам.
 - это математическая
запись закона эквивалентов, где т1
и m2 - массы
веществ; М(Э1) и М(Э2) –
эквивалентные массы этих веществ.
Эквивалент является важной количественной
характеристикой элемента или вещества.
- это математическая
запись закона эквивалентов, где т1
и m2 - массы
веществ; М(Э1) и М(Э2) –
эквивалентные массы этих веществ.
Эквивалент является важной количественной
характеристикой элемента или вещества.
Лекция 2
ОСНОВЫ ТЕРМОДИНАМИКИ И БИОЭНЕРГЕТИКИ
Термодинамика - наука о наиболее общих свойствах макроскопических материальных систем, находящихся в различных состояниях относительно термодинамического равновесия, и о процессах переходов между этими состояниями.
К настоящему времени термодинамика содержит два основных раздела:
1.Равновесная термодинамика (термодинамика изолированных систем)
В основном разработана в середине 19-го – начале 20-го века и содержит три закона – три «Начала»:
-в середине 19-го века Ю. Р. Майером, Дж. Джоулем и Г. Гельмгольцем был сформулирован первые закон термодинамики - «Первое начало термодинамики».
- в 1850 году Р. Клаузиусом, и независимо от него в 1851 году У. Томсоном было сформулировано «Второе начало термодинамики».
-в 1906 году В. Нернст сформулировал «Третье начало термодинамики».
2.Неравновесная термодинамика (термодинамика открытых систем)
Разработана в 20-м веке. Содержит два основных подраздела:
-слабо неравновесную термодинамику, основы которой разработаны в 1931 Л. Онсагером;
-сильно неравновесную термодинамику, в основном разработанную Г. Хакеном, И. Пригожиным и Р. Томом в середине 20-го века.
Первой работой в области неравновесной термодинамики в биологии является опубликованная в 1935 году книга Э.Бауэра «Теоретическая биология», в которой был сформулирован «Всеобщий закон биологии».
