
- •Основные понятия и законы химии
- •1.1 Вещества и их свойства. Предмет химии
- •1. Атомно-молекулярное учение
- •2. Стехиометрические законы
- •2.1 Закон сохранения массы веществ
- •2.2 Закон постоянства состава.
- •2.3 Закон Авогадро
- •2.4 Закон объемных отношений газов
- •2.5 Закон эквивалентов
- •40 Г/моль Са - 2 г/моль н
- •65 Г/моль Zn — 2 г/моль н
- •1.2. Основные термины и положения термодинамики
- •1.3. Общие сведения о равновесной термодинамике
- •1.3.1. Первое начало термодинамики . Энтальпия.
- •1.3.2. Второе начало термодинамики
- •1.3.3. Третье начало термодинамики
- •1.4. Общие сведения о неравновесной термодинамике
- •1.5. «Всеобщий закон биологии» Бауэра
- •1 Периодический закон и периодическая система элементов д. И. Менделеева
- •2 Строение атома
- •3 Изотопы
- •4 Строение электронной оболочки атома
- •5 Зависимость химических свойств элементов от строения их атомов
- •6. Химическая связь.
- •1.Общая характеристика. Концентрация растворов
- •2. Растворимость
- •3. Коллигативные свойства растворов
- •Электрическая проводимость водных растворов. Электролиты
- •Сильные электролиты.
- •Металлов
- •1. Переходные металлы в живых организмах; аминокислотные остатки как лиганды
- •2. Имидазол: его строение, координационные и кислотно-основные свойства
- •3. Строение гема
- •4.Гем в белковой молекуле. Строение миоглобина
- •5. Комплекс гема с кислородом. Лиганды π -акцепторного типа.
- •6. Строение дистального кармана: дополнительная причина прочности связи железа
- •Iiiа - группа
- •Iva группа
- •Viia - группа
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
2.3 Закон Авогадро
Объем определенного числа молекул газа – величина не постоянная. Он зависит от условий, т. е. от температуры Т и давления р.
В 1811 г. итальянский ученый Авогадро формулировал гипотезу, которая впоследствии стала законом:
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Газы подчиняются закону Авогадро, а твердые и жидкие вещества не подчиняются. Почему? В газах при малых давлениях расстояние между молекулами в тысячу раз больше, чем размеры самих молекул. Поэтому объем газа определяется главным образом числом молекул и величиной промежутков (расстоянием) между молекулами. Размеры самих молекул роли не играют. При одинаковом давлении и одинаковой температуре расстояния между молекулами для различных газов приблизительно одинаковы. Таким образом, одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объем.
В жидких и твердых веществах расстояния между молекулами малы, поэтому их объемы определяются не только числом, но и размерами молекул.
При низких температурах или высоких давлениях газы не подчиняются закону Авогадро, так как расстояние между молекулами уменьшается и становится близким к размерам самих молекул. Газы при низких температурах или высоких давлениях сходны с жидкостями.
Из закона Авогадро вытекают два следствия.
Первое следствие из закона Авогадро.
Один моль любого газа при одинаковых условиях занимает один и тот же объем.
Объем, который занимает 6,021023 молекул любого газа при нормальных условиях, приблизительно равен 22,4л. Этот объем называется молярным объемом газа Vm.
Молярный объем газа выражают в единицах: м3/моль (метр кубический на моль) и в л/моль (литр на моль).
Второе следствие
из закона Авогадро. Из закона
Авогадро следует, что плотность
 любого газа можно рассчитать о формуле
= M/Vm,
где М - молярная масса газа; Vm
- молярный объем газа.
любого газа можно рассчитать о формуле
= M/Vm,
где М - молярная масса газа; Vm
- молярный объем газа.
Отношение плотностей двух газов при одинаковых условиях называется относительной плотностью одного газа по другому (D).
Найдем относительную плотность первого газа по второму
 .
.
Относительная плотность одного газа по другому равна отношению их молярных или относительных молекулярных масс:


Часто определяют относительную плотность газов по водороду или по воздуху.
Расчет
относительной плотности газов по
водороду.
Относительная молекулярная масса
водорода
 ,
поэтому относительную плотность газа
по водороду рассчитывают по формуле
,
поэтому относительную плотность газа
по водороду рассчитывают по формуле
 .
.
Например, относительная плотность кислорода по водороду

Расчет
относительной плотности газа по воздуху.
Относительная молекулярная масса
воздуха
 = 29, поэтому относительную плотность
газа по воздуху рассчитывают по формуле
= 29, поэтому относительную плотность
газа по воздуху рассчитывают по формуле

Относительная плотность показывает, во сколько раз один газ тяжелей другого. Закон Авогадро открывает путь для экспериментального определения относительных молекулярных масс газов.
Расчет относительной молекулярной массы газа по плотности ( ). Если мы знаем плотность газа при нормальных условиях, можно определить молярную массу по формуле
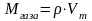 .
.
Молярная масса численно равна относительной молекулярной массе.
Расчет относительной молекулярной массы газа по массе определенного объема газа. Если мы знаем массу m определенного объема V газа, то молярную массу можно определить из пропорции:
V л газа имеют массу m г
22,4 л/моль « « « M г/моль

Расчет относительной молекулярной массы по относительной плотности газа. Если мы знаем плотность одного газа по другому и относительную молекулярную массу одного газа, можно определить относительную молекулярную массу другого газа.
Формулу для определения относительной молекулярной массы любого газа по его относительной плотности по водороду или по воздуху впервые предложил в 1856 году Д. И. Менделеев.
