
- •1.Провести досліди згідно інструкції.
- •2.Дати відповідь на запитання до дослідів.
- •3.Записати рівняння реакції та спостереження.
- •Лабораторна робота № 2
- •Теоретичні відомості
- •Окиснення амоніаку. Амоніак маючи низький ступінь окиснення Нітрогену -3, поводить себе як відновник.
- •Взаємодія з водою. Амоніак добре розчиняється у воді, утворюючи амоніачну воду.
- •Солі амонію
- •Хід роботи:
- •Техніка безпеки
- •Теоретичні відомості
- •Хід роботи:
- •Теоретичні відомості
- •Хімічні властивості альдегідів
- •Лабораторна робота № 8
- •Лабораторна робота № 10
- •Теоретичні відомості
- •1.Фізіологічні дії реактивів, що використовуються:
- •2. Міри безпеки:
- •3.Правила першої допомоги:
- •Роль озону в збереженні життя на Землі
- •Харчові добавки
- •Розділ II
- •Пам'ятка:
- •Хімічна пауза «Най-най...»
- •«Нам відходи не страшні»
- •Екологічні сторінки
- •Корисні поради
- •Література
- •Додаткова література
Хід роботи:
Дослід 1. В пробірку насипаємо приблизно 0,5 г амоній хлориду. В цю ж пробірку добавимо приблизно 1мл розчину лугу. Нагріваємо пробірку. В пари, які виділяються з пробірки вносимо лакмусовий папірець, змочений водою.
Завдання та запитання: Запишіть свої спостереження, рівняння реакцій.
Дослід 2. Наливаємо 1/4 пробірки водного розчину амоніаку, добавимо каплю фенолфталеїну і по каплям добавляємо сульфатної кислоти до одержання прозорого розчину.
Завдання та запитання: Поясніть зміни, що спостерігаються, за допомогою рівнянь реакцій.
Дослід 3. В суху пробірку опускаємо декілька кристалів амоній хлориду. Нагріваємо пробірку з кристалами над полум’ям спиртівки.
Завдання та запитання: запишіть рівняння реакцій.
Запитання до захисту лабораторної роботи:
1.Які сполуки нітрогену ви знаєте?
2. Солі амонію,їх характеристика,властивості.
3. Амоніак.Фізичні та хімічні властивості.
Техніка безпеки
1. Фізіологічні дії реактивів, що використовуються:
Амоніак сильно подразнює очі і органи дихання.
Амоніак – отрута, отруєння можливе при наявності 0,5 об’ємних відсотків у повітрі.
Гідроксид натрію викликає опіки шкіри і її руйнування.
2. Міри безпеки:
Амоніак, що виділяється, нюхати обережно, приближаючи рукою до носа.
Не допускати попаданню кислоти і лугу на відкриті частини тіла.
Працювати в халатах.
3. Правила першої допомоги:
Уражені місця промити великою кількістю води.
При опіках кислотами – уражені місця промити 2-х відсотковим розчином соди.
При опіках лугами – уражені місця промити 1-о відсотковим розчином оцтової кислоти.
Лабораторна робота №3
Тема: Добування карбон (IV) оксиду і вивчення його властивостей. Взаємоперетворення карбонатів і гідрокарбонатів.
Мета:
Добути
![]() та провести перетворення карбонатів в
гідрокарбонати.
та провести перетворення карбонатів в
гідрокарбонати.
Теоретичні відомості
Карбон виявляє невисоку хімічну активність: більшість реакцій за його участю відбувається лише за високої температури. Карбон - один із найкращих відновників.
Взаємодія з оксидами металів. Під час нагрівання карбон відновлює метали з їхніх оксидів:
2![]()
![]()
За наявності вільного доступу
повітря при цьому утворюється оксид
карбону (IV)
![]() :
:
![]()
Взаємодія з киснем. Карбон легко горить на повітрі. При цьому виділяється велика кількість теплоти, що свідчить про велику міцність зв’язків у молекулі оксиду карбону (IV), який утворюється:
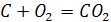
Продукт реакції горіння
карбону залежить від температури. За
порівняно невисоких температур горіння
утворюється діоксин карбону
,
а за високих (понад
1000 ![]() )
– поряд з
утворюється значна
кількість оксиду карбону (ІІ)
)
– поряд з
утворюється значна
кількість оксиду карбону (ІІ) ![]()
![]()
![]()
Взаємодія з водою. Якщо на розжарений карбон подавати водяну пару, то внаслідок реакції утвориться так званий водяний газ – суміш оксиду карбону (ІІ) і водню:
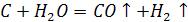
Взаємодія з металами. Під час нагрівання карбон може взаємодіяти з деякими металами, утворюючи карбіди:
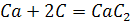
Карбіди – тверді і тугоплавкі речовини. У цих реакціях карбон виступає як окисник, що для нього не характерно.
Взаємодія з воднем. Вуглець може взаємодіяти з воднем. Реакція відбувається під час нагрівання до 500 за наявності порошку нікелю як каталізатора:
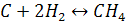 Утворюється органічна
сполука – метан
Утворюється органічна
сполука – метан 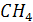 (головна складова
частина природного газу).
(головна складова
частина природного газу).
Добування. У лабораторних умовах добувають дією хлоридної кислоти на мармур:
![]()
Застосування: Вуглекислий газ застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
Оксиди карбону (IV),
або вуглекислий газ, ![]() за стандартних умов
– безбарвний газ, без запаху, важкий за
повітря в 1,5 раза, доволі добре розчиняється
у воді, особливо під тиском, легко
перетворюється на рідину навіть за
кімнатної температури і невеликого
тиску (5 МПа). Зріджений
зберігають у стальних
балонах. Якщо його швидко вилити з
балона, вуглекислий газ випаровується,
внаслідок чого частина газу перетворюється
на снігоподібну масу. Твердий вуглекислий
газ називають сухим
льодом.
за стандартних умов
– безбарвний газ, без запаху, важкий за
повітря в 1,5 раза, доволі добре розчиняється
у воді, особливо під тиском, легко
перетворюється на рідину навіть за
кімнатної температури і невеликого
тиску (5 МПа). Зріджений
зберігають у стальних
балонах. Якщо його швидко вилити з
балона, вуглекислий газ випаровується,
внаслідок чого частина газу перетворюється
на снігоподібну масу. Твердий вуглекислий
газ називають сухим
льодом.
Оксид карбону СО, або чадний газ, - безбарвний газ, без запаху, отруйний, погано розчиняється у воді, трохи легший за повітря. Вуглекислий газ у великих кількостях шкідливий для людини і тварин, спричиняє запаморочення, може викликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати.
Чадний газ СО – дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організм, і настає кисневе голодування.
Реактиви і обладнання:
Хлоридна кислота (![]() ),
крейда (
),
крейда (![]() ),
вапняна вода (
),
вапняна вода (![]() ),
кальцинована сода (
),
кальцинована сода (![]() ),
газовідвідна трубка, пробіркодержач,
штатив з пробірками.
),
газовідвідна трубка, пробіркодержач,
штатив з пробірками.
Хід роботи:
Дослід 1. В пробірку помістіть 1 г та долийте 1 мл .
Запитання та завдання: Запишіть свої спостереження, рівняння реакцій.
Дослід 2. Якісна
реакція на карбонат-іон (![]() ).
).
В пробірку всипаємо карбонат
натрію
![]() та додаємо 1 мл розбавленої хлоридної
кислоти (
та додаємо 1 мл розбавленої хлоридної
кислоти (![]() ),
закриваємо пробірку пробкою з газовідвідною
трубкою, кінець якої опускаємо в вапняну
воду (
),
закриваємо пробірку пробкою з газовідвідною
трубкою, кінець якої опускаємо в вапняну
воду (![]() ).
).
Запитання та завдання: Запишіть свої спостереження, рівняння реакцій.
Запитання до захисту лабораторної роботи:
Що відбувається при дії хлоридної кислоти на карбонати?
Як пояснити появу каламуті в пробірці з вапняною водою, крізь яку пропускали оксид карбону(IV), і розчинення каламуті?
Як карбон взаємодіє з оксидами металів?
Техніка безпеки
1. Фізіологічні дії реактивів, що використовуються:
Кислоти та луги викликають опіки шкіри, подразнюють органи дихання, руйнують тканину одежі.
Хімічні реактиви при попаданні в шлунок викликають отруєння.
2. Міри безпеки:
Не допускати попадання кислоти , лугів, солей на руки і одежу.
Працювати в халатах.
Не пробувати реактиви на смак.
Спиртівку гасити тільки ковпачком.
3. Правила першої допомоги:
Уражені місця промити великою кількістю води.
При опіках кислотами – уражені місця промити 2% розчином питної соди.
При опіках лугами – уражені місця промити 1% розчином оцтової кислоти.
Лабораторна робота №4
Тема: Розпізнавання сполук неметалічних елементів. Розв’язування експериментальних задач.
Мета: Закріпити набуті знання про хімічні властивості неметалів та їх сполук. Навчитися розв’язувати практичні задачі з одержання основних сполук неметалів у лабораторних умовах. Закріпити та перевірити на практиці вміння розпізнавати неорганічні сполуки, планувати та проводити досліди відповідно до поданої схеми.
Реактиви і обладнання: Амоній хлорид, Барій хлорид, Арґентум нітрат, сульфатна кислота, нітратна кислота, Натрій гідроксид, штатив з пробірками, спиртівка.
