
- •Неорганічна хімія. Лабораторний практикум
- •Неорганічна хімія. Практикум. Навчальний посібник – Дніпропетровськ, 2011. – 80 с.
- •Неорганічна хімія. Практикум
- •Xiмiчнi властивості
- •Xiмiчнi властивості
- •Xiмiчнi властивості
- •Xiмiчнi властивості
- •Амфотерні гідроксиди
- •Кислоти
- •Хімічні властивості
- •Xiмiчнi властивості
- •1.3. Контрольні запитання
- •Лабораторна робота № 2 основні закони хімічних перетворень
- •2.1. Теоретична частина
- •Фактори, що впливають на швидкість реакції
- •Енергія активації
- •Поняття про каталіз I каталізатори
- •Необоротні та оборотні реакції
- •Хімічна рівновага. Принцип Ле Шательє
- •2.2. Експериментальна частина Дослід 2.2.1. Взаємодія розчину калію йодиду з гідроген пероксидом у кислому середовищі
- •2.3. Контрольні запитання
- •Лабораторна робота № 3 розчини
- •3.1. Теоретична частина
- •3.2. Експериментальна частина Приготування розчинів заданої концентрації Дослід 3.2.1. Приготування приблизно 0,1 н розчину хлоридної кислоти
- •3.3. Контрольні запитання
- •Лабораторна робота № 4 гідроліз солей. Водневий показник
- •4.1. Теоретична частина
- •Дослід 4.2.4. Визначення реакції середовища за допомогою індикаторів
- •4.3. Контрольні запитання
- •Лабораторна робота № 5 окисно-відновні реакції
- •5.1. Теоретична частина
- •2. Реакції диспропорціонування (самоокиснення-самовідновлення).
- •5.2. Експериментальна частина Дослід 5.2.1. Окисні властивості калій дихромату
- •5.3. Контрольні запитання
- •Дисоціація комплексних сполук
- •6.2. Експериментальна частина Дослід 6.2.1. Дисоціація подвійної солі
- •6.3. Контрольні запитання
- •Лабораторна робота № 7 хімія s-елементів
- •7.1. Теоретична частина
- •7.2.5.1. Якісна реакція на іон калію
- •7.3. Контрольні запитання
- •У лабораторних умовах со добувають із форміатної кислоти дією на неї концентрованою сульфатною кислотою при нагріванні до 373 к:
- •А в лабораторних умовах – при дії на мармур хлоридної кислоти:
- •8.2. Експериментальна частина Дослід 8.2.1. Одержання і властивості солей карбонатної кислоти
- •8.2.1.1. Властивості карбонатів лужноземельних металів
- •8.2.1.2. Гідроліз натрій карбонату та гідрокарбонату
- •Дослід 8.2.2. Гідроліз солей амонію
- •Дослід 8.2.3. Властивості нітратної кислоти та її солей
- •8.2.4. Гідроліз солей ортофосфатної кислоти
- •8.3. Контрольні запитання
- •9.2. Експериментальна частина Дослід 9.2..1. Якісна реакція на іон хлору
- •Дослід 9.2.2. Взаємодія хлоридної кислоти з металами
- •Дослід 9.2.3. Окисні властивості пероксиду водню
- •Дослід 9.2.4. Обвуглювання паперу сульфатною кислотою
- •9.3. Контрольні запитання
- •10.2. Експериментальна частина Дослід. 10.2.1. Реакції катіона Мангану з лугами
- •Дослід 10.2.2. Реакції на катіон Цинку
- •Дослід 10.2.3. Реакції катіонів Купруму
- •10.3. Контрольні запитання
- •Додатки
- •Густина водних розчинів кислот, основ та солей різної концентрації (при t 18c), г/см3
- •Константи нестійкості деяких комплексних іонів у водних розчинах при 25с
- •Ступінь гідролізу солей в 0,1 м розчинах при 25 с
- •Електрохімічний ряд напруг металів
- •Ряд електронегативності елементів
- •Список рекомендованої літератури
Хімічні властивості
Кислоти взаємодіють:
– з металами згідно з рядом електрохімічних потенціалів металів
Zn + Н2SО4 (розв.) → ZnSО4 + Н2↑
Сu + Н2SО4 (pозв.) ≠
Сu + 2Н2SО4(конц.) → СuSО4 + SО2↑+ 2Н2О
– з основними та амфотерними оксидами
СuО + Н2SО4 → СuSО4 + Н2О
SnО + 2НСl → SnСl2 + Н2O
– з основами (реакція нейтралізації)
Сu(ОН)2 + 2НСl → СuС12 + 2Н2О
2КОН + Н2SО4 → К2SО4 + 2Н2О
– із солями, якщо в результаті виділяється газ або випадає осад
Na2СО3 + 2НСl → 2NaСl + СО2↑ + Н2О
ВаСl2 + Н2SО4 → ВаSO4↓ + 2НСl
Солі
Солями називають продукт заміщення атомів Гідрогену у кислоті на атоми металу або гідроксильних груп у гідроксидах металів на кислотні залишки.
Солі бувають середні, кислі та основні.
Середні coлi є продуктом повного заміщення атомів Гідрогену кислоти на атоми металу NaCl, ZnSO4, Cu(NO3)2.
Назви середніх солей походять від назв кислот i металів, з яких утворені солі: магній сульфат MgSO4, натрій фосфат Na3PO4.
Кислі солі можна розглядати як продукт неповного заміщення атомів Гідрогену кислоти на атоми металу. Кислі солі, як правило, утворюються в разі надлишку кислоти i можуть бути перетворені на середні солі дією основи:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 + 2Н2О
Назви кислих солей походять від назв середніх солей з додаванням слова гiдpoген- або дигiдpoген-: кальцій гідрогенкарбонат, натрій дигідрогенфосфат Са(НСО3)2, NaH2PO4
Подвійними солями називають coлi, утворені різними катіонами i одним і тим самим аніоном.
Прикладом може бути кристалогідрат калій-алюміній сульфат – алюмокалієвий галун, розгорнута формула якого K2SO4 ∙ A12(SO4)3 ∙ 24H2O i скорочена KA1(SO4)2 ∙ 12Н2О. Утворення подвійних сульфатів (галунів) є характерним для низки тривалентних металів (Al, Cr, Fe, V тощо).
3мішаними називаються coлi, yтвopeнi одним і тим самим катіон-іном, але різними аніонами.
Наприклад, Ba(Cl)NO3 – барій хлорид-нітрат, CaCl(OC1) – кальцій хлорид-гіпохлорит.
Xiмiчнi властивості
Cолі взаємодіють:
– з металами, згідно з рядом електрохімічних потенціалів металів
Zn + CuSO4 → ZnSO4 + Cu
Cu + ZnCl2 ≠
– з основами, якщо внаслідок реакції випадає осад або виділяється газ
FeCl3 + ЗКОН → Fe(OH)3↓ + 3KCl
2NH4Cl + Са(ОН)2 → СаСl2 + 2NH3↑ +2H2O
– з кислотами, якщо внаслідок реакції випадає осад або виділяється газ
FeS + H2SO4 → FeSO4 + H2S↑
ВаСl2 + H2SO4 → BaSO4↓ + 2HCl
– з солями, якщо внаслідок реакції випадає осад
NaCl + AgNO3 → NaNO3 + AgCl↓
ВаС12 + CuSO4 → CuCl2 + BaSO4↓
Генетичний зв'язок між класами неорганічних сполук можна зобразити схемою:
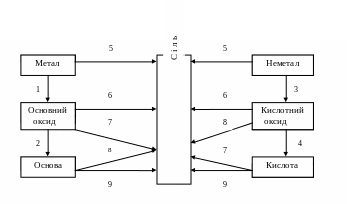
1) Ca + O2 → 2CaO
2) CaO + H2O → Ca(OH)2
3) S + O2 → SO2
4) SO2 + H2O → H2SO3
5) Ca + S → CaS
6) CaO + SO2 → CaSO3
7) CaO + H2SO3 → CaSO3 + H2O
8) Ca(OH)2 + SO2 → CaSO3 + H2O
9) Ca(OH)2 + H2SO3 → CaSO3 + 2H2O
1.2. Експериментальна частина
Дослід 1.2.1. Взаємодія оксидів з водою
Внести у пробірку небагато СаО, СuО, ZnО. Долити у кожну пробірку 3-4 краплі дистильованої води і збовтати. Які оксиди взаємодіють з водою ? Написати рівняння реакцій.
Дослід 1.2.2. Одержання малорозчинних у воді гідроксидів
Помістити у пробірки номер 1, 2, 3, 4 по 4-5 крапель розчинів FеСl3, СuSО4, МnСl2 та NiSО4 і додати в кожну пробірку по 2-3 краплі будь-якого лугу. Що при цьому відбувається ? Звернути увагу на колір осадів. Написати рівняння реакцій. До осадів у пробірках № 3 і № 4 додати розчин Н2SО4. Що відбувається ? Написати рівняння реакцій.
Дослід 1.2.3. Одержання амфотерних гідроксидів
У пробірки помістити по 6-8 крапель розчинів солей алюмінію, цинку і хрому (Ш). У кожну пробірку додати 2-4 краплі розчину лугу. Що при цьому утворюється ? Написати рівняння реакцій. Кожний із одержаних осадів розділити на дві частини. До однієї частини додати розчин НNО3, до другої – надлишок розчину лугу. Що при цьому відбувається ? Написати рівняння реакцій.
Дослід 1.2.4. Взаємодія основних оксидів з кислотами
У пробірку помістити небагато СuО, додати 3-4 краплі розчину НСl і підігріти. Що відбувається? Написати рівняння реакцій.
Дослід 1.2.5. Взаємодія солі з сіллю
У пробірку до 3-5 крапель розчину ВаСl2 додати 2-3 краплі розчину Nа2SО4. Що відбувається? У пробірку з 2-3 краплями розчину АgNО3 додати 1-2 краплі КСl. Що відбувається ? Написати рівняння реакцій. Аналогічним способом одержати СаСО3.
