
11.4. Молекулярні механізми м'язового скорочення
Нині з міофібрил поперечносмугастих м'язів виділено десятки різних скоротливих білків, які становлять близько 12 % сухої ваги м'язового волокна. Основна частина білків припадає на два м'язові білки, а саме: міозин – 55 % й актин – 20 %. Інші білки представлені в м'язі у значно меншій кількості, %: тропоміозин – 7, тропонін – 2, α-актинін –10, β-актинін – 2, С-білок – 2, М-білок – 2.
Міозин й АТФазна реакція. Міозин - один з головних білків м'язових волокон (рис. 11.11), який складається із шести поліпептидних ланцюгів – двох важких і чотирьох легких. Протеолітичні ферменти (трипсин і папаїн) розщеплюють міозин на фрагменти: легкий мероміозин (ЛММ), важкий мероміозин (ВММ), субфрагмент 2 (С2) і два субфрагменти 1 (С1). Заслуговують на увагу такі фізико-хімічні характеристики міозину та його фрагментів: міозин – молекулярна маса М = 480 кДа, довжина 160 нм; ВММ – М = 340 кДа, довжина 60 нм; ЛММ – М = 140 кДа, довжина 80 нм; С2 – М = 62 кДа, довжина 47,5 нм; С1 (голівка міозину) – М = 120 кДа, довжина 19 нм, товщина 6 нм.
Окремі фрагменти міозину виконують певні фізіологічні функції. Так, ЛММ має важливе значення для утворення протофібрил. У субфрагменті С1 (голівці міозину) локалізовані АТФазні центри й центри зв'язування з актином. Голівки міозину виконують роль поперечних містків і створюють активну тягнучу силу в саркомері під час скорочення м'яза.
Молекула міозину при обробці сечовиною або хлоридом гуанідину дисоціює на два важкі ланцюги з М = 200 кДа і чотири легкі ланцюги g1, 2g2 і g3. Два однакові g2-ланцюги (М = 18,5 кДа) відщеплюються при обробці міозину 5,5-дитіобіс-2-нітробензойною кислотою (ДТНБ). Тому їх називають ще ДТНБ-легкими ланцюгами (рис. 11.11). Два інші легкі ланцюги g1 (М = 20,7 кДа) і g3 (М = 16,5 кДа) дисоціюють у лужному середовищі (рН 11), і тому їх називають лужними легкими ланцюгами. ДТНБ-легкі ланцюги локалізовані поблизу "шарнірного" сполучення С1-С2 (рис. 11.11).
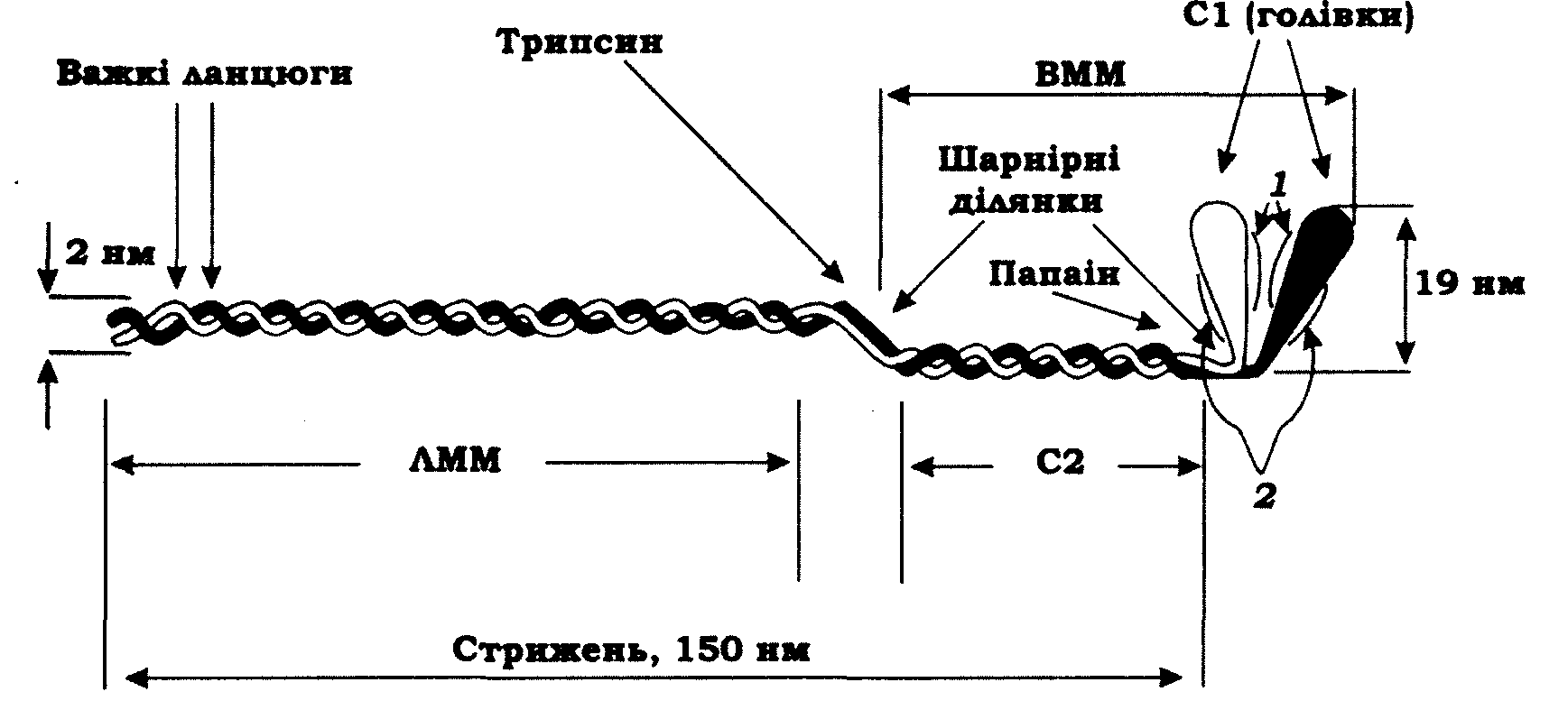
Рис. 11.11. Молекула міозину поперечносмугастого м'яза:
ВММ - важкий мероміозин; ЛММ - легкий мероміозин;
С1 - голівка міозину (субфрагмент С1); С2 - субфрагмент С2;
1 - лужні легкі ланцюги; 2 - ДТНБ-легкі ланцюги
Для виконання механічної роботи м'язом використовується енергія, що звільняється при гідролітичному розщепленні АТФ в активних центрах міозину. Тому АТФазна активність міозину є головною його функціональною характеристикою. Міозинова АТФазна реакція не підпорядковується простій кінетиці Міхаеліса-Ментен, а проходить через низку стадій, під час яких утворюються проміжні (інтермедіатні) конформації міозину М* і М**, збагачені енергією (рис. 11.12). Початкові стадії – приєднання АТФ до міозину (k2 = 400 с-1) і розщеплення АТФ з утворенням найбільш збагаченого енергією інтермедіата М**ФАДФ (k3 = 160 с-1) – є досить швидкими. За відсутності актину стадія, повязана з переходом М**ФАДФ в низькоенергетичну форму М*ФАДФ, є найбільш повільною (k4 = 0,04 с-1), а отже, і лімітуючою швидкість стадію АТФазної реакції міозину.
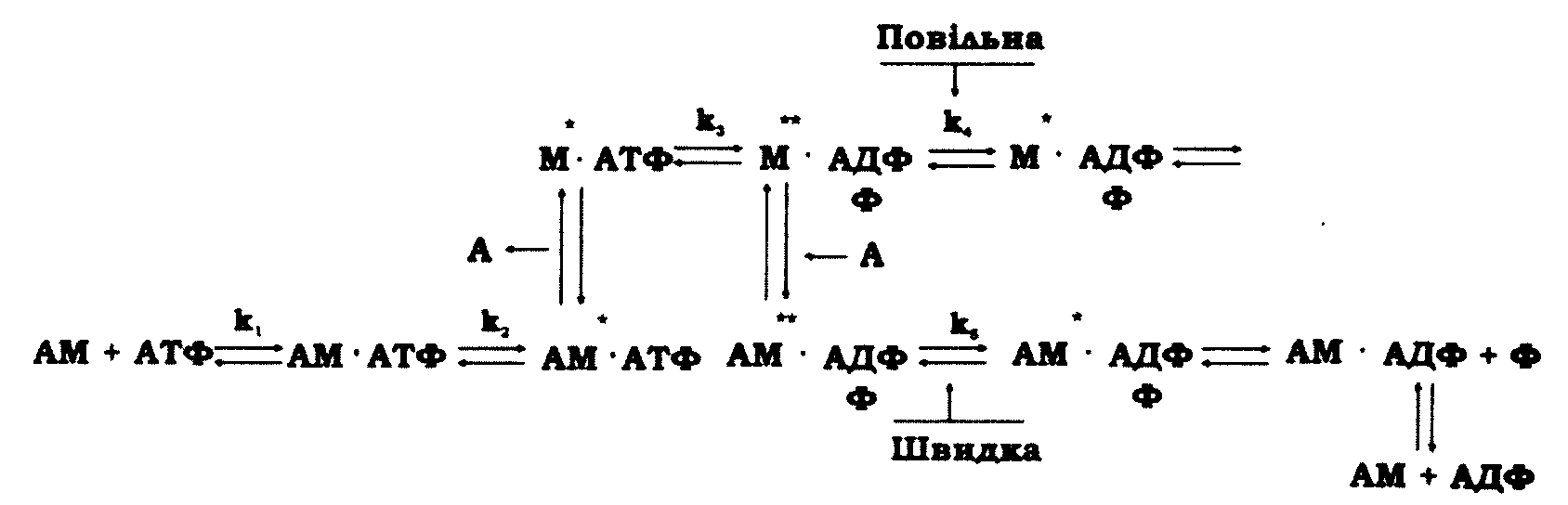
Рис. 11.12. Гідроліз АТФ актоміозиновою системою: АМ - актоміозин, М - міозин,
А - актин, М*, М** - інтермедіатні конформації міозину, збагачені енергією
При взаємодії актоміозину (АМ) з АТФ утворюється інтермедіат АМ* • АТФ, після чого актин дуже швидко дисоціює. За відсутності актину відбувається перетворення М*АТФ<=>М**ФАДФ. Потім актин швидко асоціюється з М**ФАДФ і значно прискорює розпад цього комплексу. У присутності актину стадія АМ**ФАДФ<=>АМ*ФАДФ прискорюється на кілька порядків (k5 = 20 с-1) порівняно з перетворенням М**АТФ<=>М*ФАДФ. Отже, характерною особливістю розглянутого механізму є дисоціація й рекомбінація актоміозинового комплексу для кожного оберту АТФазного циклу. Поведінка простої актоміозинової моделі збігається з кінетичною моделлю скорочення м'яза, в якій передбачається утворення й зникнення поперечних містків між актиновими й міозиновими протофібрилами під час механохімічного циклу.
Чутливі біофізичні методи – диференційна спектрофотометрія й УФ-флуоресценція – дозволяють зафіксувати конформаційні зміни міозину під час гідролізу АТФ. При взаємодії АТФ з міозином реєструється зміна власної флуоресценції міозину (ΔI/I0)·100% (рис. 11.13), де ΔI=I–I0 – зміна інтенсивності флуоресценції після додавання АТФ; I0 – стаціонарний рівень флуоресценції міозину до додавання АТФ.
Кінетична крива – (ΔI/I0)·100% складається зі швидкого збільшення й повільного спаду флуоресценції зі швидкістю, яка дорівнює швидкості гідролізу АТФ в лімітуючій стадії АТФазної реакції. Такий характер зміни флуоресценції відображає утворення й зникнення інтермедіатної конформації міозину М**ФАДФ.
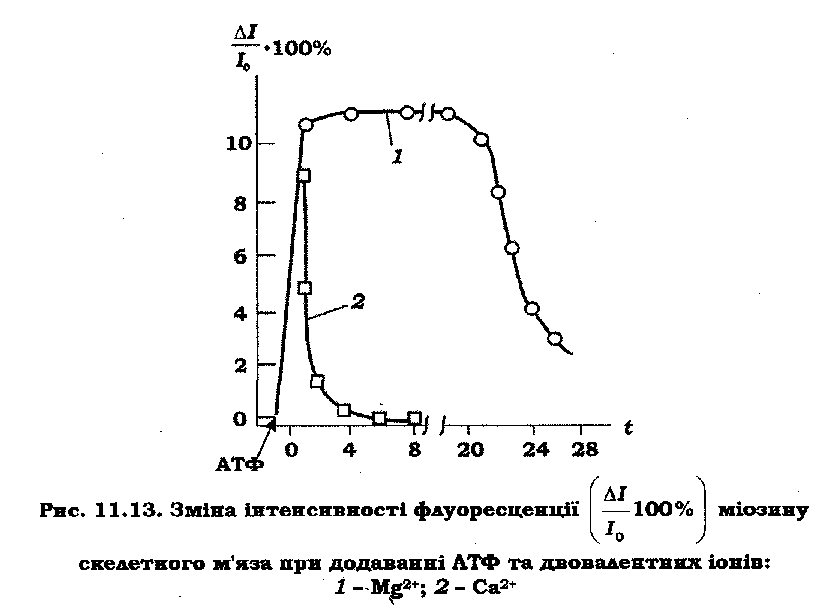
Енергія, що виділяється при гідролізі АТФ, запасається в інтермедіаті М**ФАДФ у формі конформаційної перебудови голівки міозину. Актин діє як акцептор цієї енергії, завдяки чому прискорюється АТФазна реакція й збільшується швидкість дисоціації продуктів реакції. Як видно з кінетичної схеми (рис. 11.12), продукти реакції надходять у такій послідовності: спочатку неорганічний фосфат (Ф), а потім АДФ. Швидкість зміни флуоресценції міозину залежить від природи двовалентного іона, що бере участь в АТФазній реакції. Іони Са2+ значно прискорюють розпад інтермедіату М**ФАДФ (рис. 11.13), що сприяє збільшенню АТФазної активності міозину. Іони Мg2+ виконують роль релаксаційного фактора, що уповільнює розпад інтермедіатів міозину.
Актинові (тонкі) й міозинові (товсті) філаментн. Дані електронної мікроскопії й дифракції рентгенівських променів стали визначальними для створення уявлення про міофібрили як про високовпорядковані скоротливі ультраструктури з точним розміщенням двох типів філаментів або протофібрил. У м'язовому волокні філаменти зберігають активний стан і виконують скоротливу функцію за фізіологічних значень іонної сили (0,1-0,15). Зниження або підвищення іонної сили розчину порушує структурну організацію філаментів. Це явище використовується для вибіркового виділення скоротливих білків з міофібрил. Розчини з низькою іонною силою (менше 0,05) спричинюють розпад тонких філаментів на окремі білки (актин, тропоміозин, тропонін, актинін). При екстракції розчинами високої іонної сили (більше 0,25) відбувається дисоціація товстого філамента, й виділяється міозин і низка мінорних білків товстого філамента.
Кожен саркомер складається з товстих міозинових (довжиною 1,6 мкм і діаметром приблизно 18 нм) і тонких актинових (довжиною 1 мкм і діаметром приблизно 10 нм) філаментів, що частково перекриваються (рис. 11.1). У ділянках перекриття в поперечному розрізі філаменти утворюють гексагональну структуру (рис. 11.1, в). Взаємодія між товстими й тонкими філаментами здійснюється за допомогою голівок молекул міозину або так званих поперечних містків, які виступають з міозинових філаментів. Товсті філаменти містяться в А-смужці саркомера, тонкі – в І-смужці і частково в А-смужці. Вільна від тонких протофібрил центральна частина саркомера позначається як Н-смужка. У центрі А-смужки розташована М-смужка. Поблизу Z-диска є дві N-смужки на відстані 0,1 мкм (N1-смужка) і 0,3 мкм (N2-смужка) від нього. За допомогою електронної мікроскопії встановлено, що скорочення м'яза супроводжується зменшенням довжини І- та Н-смужки без зміни довжини А-смужки. Зміну довжини І- та Н-смужки зумовлено відносним зміщенням товстих і тонких філаментів при м'язовому скороченні.
Основним білком тонкої протофібрили є фібрилярний актин, або F-актин. Дифракційна картина тонкої протофібрили дає характерний рефлекс 5,5 нм, пов'язаний з розсіянням рентгенівських променів на окремих глобулах G-актину. Мономерні глобули G-актину вивчають у розчинах з низькою іонною силою (меншою 0,1). Діаметр таких глобул становить 5,5-6,0 нм. У даний час повністю встановлено первинну структуру G-актину, який складається з 374 амінокислотних залишків. Молекулярна маса G-актину дорівнює 42 кДа.
Довгий час вважалося, що актин є найбільш консервативною структурою, сталою для різноманітних в еволюційному плані рухомих систем. Детальний порівняльний аналіз актинових молекул м'язових і нем'язових клітин виявив невелику різницю в амінокислотному складі в N-кінцевій частині молекули. З нем'язових клітин й ембріональної м'язової тканини виділяються бета і гамма-актин. У гладеньких м'язах представлений гамма-актин.
Властивість мономерного глобулярного актину полімеризуватися з утворенням спіральних філаментів (F-актину} має важливе біологічне значення у всіх еукаріотних клітинах. Тривимірну структуру актинового мономера встановлено за допомогою електронної мікроскопії та рентгеноструктурного аналізу. Актин складається з двох доменів, які, незважаючи на близькі розміри, мають назву великі та малі. У щілині між ними міститься нуклеотид (АТФ або AДФ) та іон кальцію або магнію, N- і С-кінці розташовані в малому домені. Кожен домен складається з двох субдоменів. При підвищенні концентрації солі мономерний актин полімеризується з утворенням F-актину. Мономерний актин зв'язує одну молекулу АТФ, яка гідролізується до АДФ при полімеризації.
![]()
Утворення актинового філамента відбувається в обох напрямках (з обох кінців), але з різною швидкістю.
F-актин – це спіраль, на шість обертів якої (36 нм) припадає 13 глобул актину. Оскільки оберт на одну глобулу актину становить 166°, то актиновий філамент можна описати як ліву одноланцюгову генетичну спіраль, крок якої становить 5,9 нм, або як дволанцюгову праву спіраль, крок якої – 72 нм. У структурі філаменту глобули актину можуть обертатися на кут до 10°.
Крім актину, тонка протофібрила містить фібрилярний білок тропоміозин (ТМ) з М = 68 кДа і глобулярний білок тропонін (ТН) з М = 70 кДа. Три білки в тонкій протофібрилі перебувають у певному співвідношенні: на сім глобул актину припадає по одній молекулі тропоміозину й тропоніну. З кожною молекулою тропоміозину зв'язується молекула тропоніну, що складається з трьох субодиниць: тропоміозинзв'язувальної субодиниці – ТН-Т (М = 30,5 кДа), інгібіторної субодиниці – ТН-І (М = 20,7 кДа) і Са2+-зв'язувальної субодиниці – ТН-С (М = 17850). ТН С має чотири Са2+-зв'язувальні центри: два центри з високим спорідненням, які, крім Са2+, можуть зв'язувати також і іони Мg2+, і два центри з низьким спорідненням, які зв'язують лише іони Са2+. Ділянка зв'язування тропоніну на тропоміозині розташована на відстані 13 нм від С-кінця молекули ТМ.
Особливість будови актинового філамента полягає в тому, що подвійну спіраль глобул актину обвивають ще дві нитки, утворені з тропоміозину, надвторинна структура якого являє собою подвійну а-спіраль (суперспіраль). Молекули ТМ сполучені між собою за принципом "хвіст до голівки". З тропоміозином зв'язаний тропоніновий комплекс через найбільш витягнуту субодиницю тропоніну – тропонін Т. Цей комплекс повторюється з двох боків уздовж актинового філамента з інтервалом 40 нм. Зараз існує думка, що актин може мати далекодійну кооператівність, що поширюється через субодиничні зв'язки по всьому філаменту й що це може мати фізіологічне значення, тобто актиновий філамент, можливо, відіграє більш динамічну, більш активну роль у м'язових клітинах, ніж вважалося.
Крім названих, до складу тонкої протофібрили входять також інші білки. На вільних кінцях актинового філамента в центрі саркомера розміщується (бета-актинін, який впливає на полімеризацію актину. Із Z-диска виділено а-актинін (М = 180 кДа), філамін (М = 240 кДа), десмін (М = 50 кДа). Філамін та а-актинін виявлено всередині Z-дисків. Ці білки утворюють поперечні містки між актиновими нитками, збираючи їх у пучки й прикріпляючи їх до Z-диска. Десмін локалізований на периферії Z-дисків й у місцях, де Z-диски з'єднуються із сарколемою.
Міозин присутній у всіх еукаріотних клітинах, особливо у скелетних м'язах, де він формує впорядковані структури. Це білковий мотор, який перетворює хімічну енергію гідролізу АТФ на механічну роботу при м'язовому скороченні, русі органел й інших внутрішньоклітинних процесах, пов'язаних з переміщенням певних структур. Крім того, міозин здатен до само асоціації з утворенням філаментних агрегатів, які називаються міозиновими, або товстими філаментами. На початку агрегація міозину відбувається за принципом "хвіст до хвоста" і далі "хвіст до голівки".
Характерною особливістю хвостової частини молекули міозину є чергування позитивних і негативних зарядів, кратне 28 амінокислотним залишкам. Ця періодичність розподілу зарядів забезпечує правильну упаковку міозинового філамента за рахунок електростатичного притягання між паралельно розміщеними міозиновими молекулами.
Товсті філаменти, які складаються, головним чином, з молекул міозину, мають витягнуту циліндричну структуру довжиною 1,6 мкм і діаметром 18 нм. У центральній частині філамента (довжиною 160-180 нм) відсутні поперечні містки, в результаті чого утворюється "гола зона" філамента (рис. 11.1), в якій міозинові молекули з'єднані "хвостом до хвоста". Далі в обидва кінці від центру філамента молекули міозину агрегують полярно за типом "хвіст до голівки". Голівки міозину виступають назовні у вигляді поперечних містків з кроком спіралі 42,9 нм і субодиничним періодом 14,3 нм. Встановлено, що голівки молекул міозину в товстому філаменті утворюють тривиткову спіраль.
У товстій протофібрилі виявлено також мінорні білки, С-, Х-, Н- і I-білки з молекулярною масою 140, 133, 64 і 50 кДа, відповідно.
На сьогодні існують кілька моделей міозинового філамента. Спільним для більшості з них є те, що в них субфрагмент С2 молекули міозину не входить до стовбура міозинового філамента. Це пов'язано з тим, що в перших моделях м'язового скорочення С2 виконував активну роль (переміщення від і до міозинового філамента як важеля навантаження при м'язовому скороченні). Але за такого принципу упаковки значна частина об'єму філамента не буде заповнена молекулами міозину, тобто лише ЛММ не здатен утворити міозиновий філамент відповідних розмірів.
На рис. 11.14 наведено модель міозинового філамента, розроблену на кафедрі біофізики Київського національного університету імені Тараса Шевченка.
Відповідно до цієї моделі на поверхні міозинового філамента розміщена лише ЛММ. Ця частина молекули забезпечує самозбирання, агрегацію й відповідно міцність міжмолекулярної електростатичної взаємодії між молекулами міозину завдяки чергуванню позитивних і негативних зарядів у структурі ЛММ зі зміщенням, кратним 28 амінокислотним залишкам. При цьому спостерігається притягання в тому випадку, коли зміщення між молекулами дорівнює 98 або 294 амінокислотним залишкам (відповідно 14,3 і 42,9 нм). Аналогічні зміщення є характерними і для даної моделі. За такого принципу упаковки в будь-якій ділянці поперечного перерізу товстої нитки на її поверхні перебуватиме ЛММ 18 молекул міозину, а субфрагменти С2 дев'ятьох його молекул міститимуться усередині трубочки, утвореної ЛММ (рис. 11.14, а, б). Як наслідок цього – молекули міозину виявляться "вплетеними" у структуру товстої нитки, що додатково її стабілізує.
Відомо, що у скелетному м'язі товсті нитки складаються з молекул міозину, голівки яких утворюють тривиткову спіраль. Розрахуємо кількість молекул міозину, що припадає на крок спіралі, рівний 43 нм, знаючи, що товста нитка має довжину 1600 нм і складається приблизно з 300 молекул міозину. Довжина голої зони дорівнює приблизно одній довжині молекули, тобто 150 нм. Розділивши різницю 1600 – 150 = 1450 нм на крок спіралі, одержимо 34 витки. Це означає, що один крок спіралі містить дев'ять спарених голівок молекул міозину або три спарені голівки на період 14,3 нм.
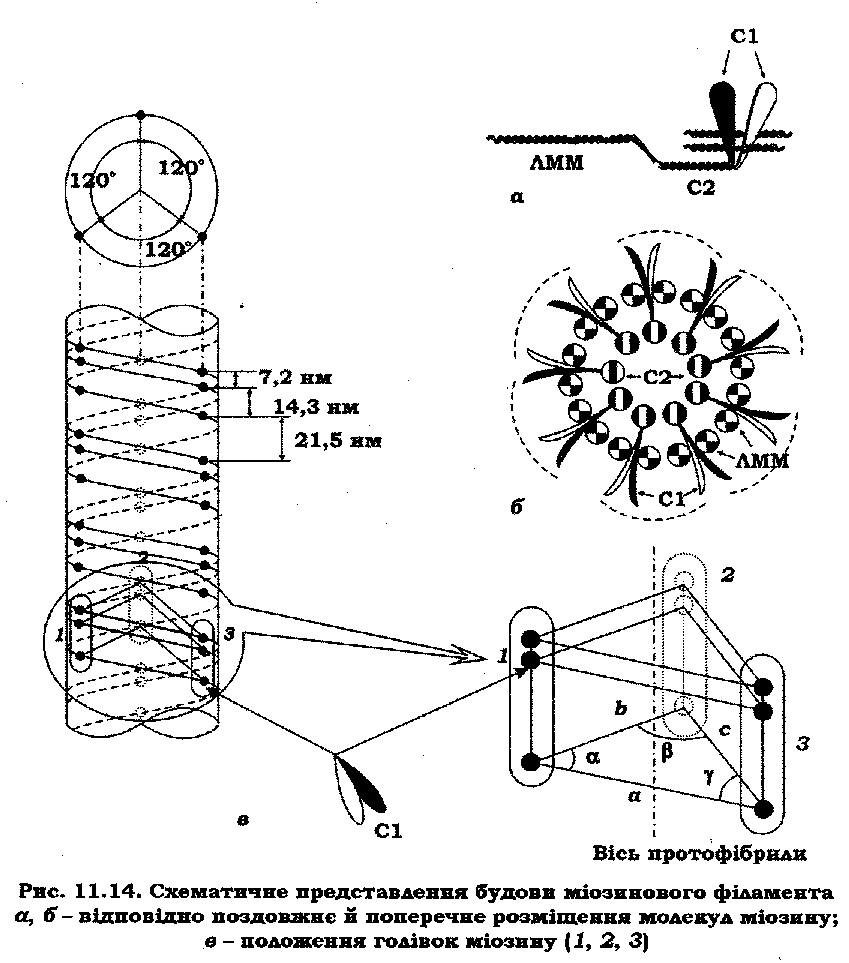
Положення голівок молекул міозину показано на рис. 11.14, в. На циліндричній поверхні товстої протофібрили голівки міозину розташовані у три ряди паралельно осі товстої нитки з утворенням тривиткової сціралі. Порядок розташування голівок у кожному ряду є однаковим. На ярус (рівень) 14,3 нм припадають три молекули міозину. Дві з них розташовані під кутом 120° одна до одної на одному рівні, а третя зміщена вздовж осі товстої нитки на 7,2 нм. За такого розташуванні спостерігається ще одна особливість: чергування голівок однієї та двох молекул міозину на кожному рівні з інтервалом 7,2 нм, що вказує на певну регулярність й однорідність упаковки товстої нитки. Розрахунки показують, що дана модель відповідає даним рентгеноструктурного аналізу й дає характерні для міозинового філамента рефлекси – 7,2, 14,3 і 21,5 нм.
Важливу роль у функціонуванні товстої протофібрили відіграє М-смужка шириною 0,08-0,1 мкм. Вона складається із чотирьох або п'яти вузьких ліній, розташованих на відстані 20-22 нм одна від одної. На мікрофотографіях поперечних зрізів М-смужки видно гексагональну сітку з поперечних містків (М-містки діаметром 4 нм), що з'єднують міозинові філаменти (рис. 11.1). М-містки перетинаються поздовжніми М-нитками діаметром 5 нм, що йдуть паралельно товстим філаментам саркомера. М-смужці відводиться визначальна роль щодо підтримання структури саркомера й фіксованого просторового розміщення товстих філаментів. У М-смужці знайдено три білка: креатинінкіназа (М = 80 кДа), М-білок (М = 165 кДа) і міомезин (М = 185 кДа). М-білок і міомезин локалізовані в М-нитках; креатинінкіназа – в М-містках.
Регуляція взаємодії товстих і тонких фідаментів. Скорочення скелетного м'яза є складним клітинним процесом, в регуляції якого задіяно цілу низку компонентів. Генерація сили, а відповідно й скорочення у скелетних м'язах запускаються при зв'язуванні іонів кальцію з регуляторними кальційспецифічними центрами тропоніну С (ТН-С), які розташовані в N-домені молекули. Уперше припущення про те, що скорочення скелетних м'язів регулюється білковим комплексом, було висловлено в 60-ті рр. XX ст. Запускається скорочення нервовим імпульсом, під дією якого іони кальцію звільняються із цистерн саркоплазматичного ретикулума. При зв'язуванні кальцію з ТН-С відбувається запуск м'язового скорочення.
Незважаючи на значний період, що минув після відкриття ТН-С, й інтенсивні дослідження білків тропонін-тропоміозинового комплексу, на сьогодні відсутня адекватна модель регуляції м'язового скорочення.
Стерична модель регуляції скорочення-розслаблення скелетного м'яза, що ґрунтується на блокуванні тропоміозином взаємодії голівок міозину з актином, створено на основі даних дифракції рентгенівських променів м'язом (інтерпретація змін інтенсивностей меридіональних рефлексів актинових шарових ліній 2-го порядку при активації м'язів). Збільшення інтенсивності цього рефлексу було інтерпретовано як переміщення ниток тропоміозину у спіральних канавках актинового філамента. Суть гіпотези стеричного блокування тропоміозином взаємодії субфрагмента С1 міозину з актином полягає в тому, що у "виключеному" стані закручені нитки ТМ, що обвивають актиновий філамент, блокують взаємодію С1 з глобулами актину. Зв'язування кальцію з ТН-С викликає зміщення ТМ в інше положення, яке стерично вже не блокує взаємодію С1 з актином. Проте до цього часу немає прямих і однозначних доказів такого зміщення ТМ під впливом кальцію.
Незважаючи на значне поширення стеричної моделі, є низка фактів (наприклад, наявність певної кількості замкнутих містків у релаксованому м'язі), які вона не може повністю пояснити. Більш імовірною є наведена нижче модель регуляції скорочення - розслаблення скелетного м'яза, розроблена співробітниками кафедри біофізики Київського національного університету імені Тараса Шевченка (М. Мірошниченко, М. Шуба, 1987).
У даній моделі враховано також концентраційне співвідношення між Са2+ і ТН-С. При цьому за максимального скорочення рівноважна концентрація іонів кальцію береться рівною 10-5 моль/л, а константа зв'язування (Кзв), яку визначено для двох центрів сильного зв'язування іонів кальцію тропоніном, Кзв = 5 • 108, тоді:
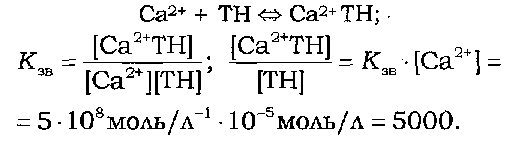
Розрахунок показує, що за цих умов комплекс Са2+-ТН можна вважати не дисоційованим. Оскільки в молекулі тропоніну два центри мають однакову константу зв'язування іонів Са2+ (5 • 108), то в даних умовах вони постійно зайняті іонами кальцію, тобто не братимуть участі в регуляції процесу скорочення-розслаблення.
Аналогічний розрахунок для двох інших центрів зв'язування кальцію тропоніном (Кзв=105) дає відношення 1 : 1. Ця величина зменшиться на порядок, якщо взяти до уваги, що м'язове скорочення близьке до максимального вже за концентрації іонів кальцію 10-6 моль/л.
Наведені розрахунки свідчать, що із чотирьох центрів зв'язування кальцію тропоніном за рівноважної концентрації іонів кальцію 10-5 -10-6 моль/л два є постійно зв'язаними з кальцієм, а два інші – ні, й стосовно них можна говорити лише про високоспецифічну взаємодію, яка, очевидно, носить електростатичний характер.
Таким чином, можна стверджувати, що концентрація іонів кальцію в саркоплазмі становить приблизно 10-5 моль/л при максимальному розвитку напруження м'яза. Розрахуємо для цього випадку кількість іонів Са2+, що припадає на один тропонін, якщо на 1 см2 поперечного перерізу м'яза розміщені 12 • 1010 актинових філаментів довжиною 1 мкм, причому кожен містить 50 молекул трононіну. В об'ємі цієї структури, що дорівнює 10-7 л, налічується 6•1012 молекул тропоніну й 6,02•1011 іонів кальцію, тобто один іон кальцію на 10 молекул тропоніну.
Виявлені кількісні закономірності (дефіцит іонів кальцію відносно ТН-С) вказують на те, що не всі кальційспецифічні центри ТН-С беруть участь у регуляції процесів скорочення-розслаблення. Крім того, дослідження тривимірної структури саркомера дало змогу зробити висновок, що зміщення тропоміозину на актиновому філаменті (якщо таке й відбувалося б) не може регулювати специфічну взаємодію С1 з глобулами актину. Це випливає з того, що взаємодіючі структури мають різну симетрію: актиновий філамент – 2-го порядку, а голівки, які підходять до актинового філамента, – 3-го порядку, що добре видно на рис. 11.15. Інший фактор, який вказує на неадекватність моделі "стеричного блокування", полягає в тому, що зміщення ТМ з канавок актинового філамента приводить до збільшення діаметра спіралі, яку він утворює, обвиваючи актиновий філамент, на величину α. Це вимагає подовження ТМ на 2πα на кожен оберт тропоміозину, що неможливо, якщо врахувати суперспіральну будову цієї молекули.
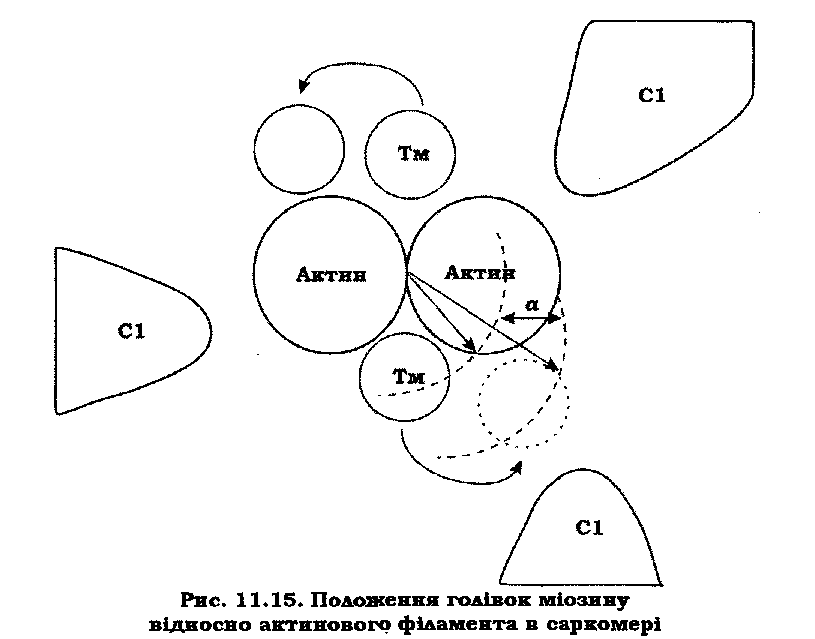
Таким чином, вищенаведене послужило стимулом для перегляду існуючої моделі регуляції скорочення скелетного м'яза й розробки такої концепції, яка б більш повно відповідала експериментальним даним.
Сучасні дані в комплексі свідчать про те, що іони кальцію при взаємодії з ТН-С викликають незначні структурні зміни в N-домені молекули. Суттєвим моментом цих змін є те, що збільшується гідрофобна поверхня N-домена за рахунок переорієнтації його спіралей під впливом вільного кальцію. Слід підкреслити, що ці зміни у ТН-С спостерігаються за концентрації кальцію близько 10-6 моль/л. Таким чином, можна припустити, що актиновий філамент являє собою макромолекулярний комплекс, де ТН-С слугує "спусковим гачком". Дія іонів кальцію на ТН-С, яка викликає невеликі структурні зміни в N-домені останнього, ініціює перебудову всього макромолекулярного комплексу актинового філамента. Тому спрацювання "спускового гачка" – ТН-С – під впливом іонів кальцію веде до поздовжнього зміщення ТМ та зміни орієнтації субодиниць актину (рис. 11.16).
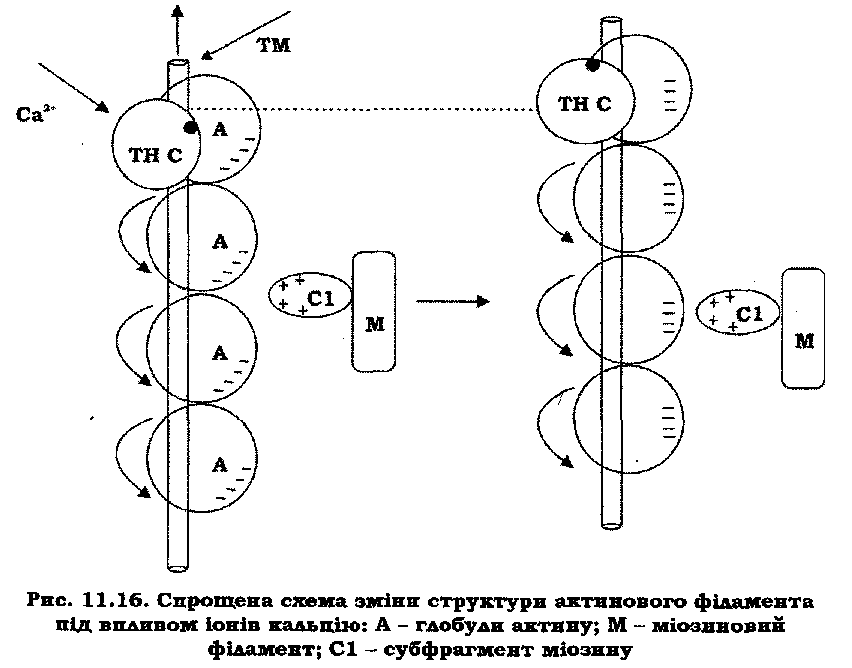
Така переорієнтація глобул актину супроводжується більш сприятливим розташування міозинзв'язувальних ділянок. Разом з тим, перебудова актинового філамента може полегшуватись під впливом голівок молекул міозину при їх переході від стану слабкого зв'язування з актином до стану сильного зв'язування, характер якого має електростатичну природу. Без спрацювання цього "спускового гачка", тобто ТН-С, який фіксує структуру актинового філамента у стані слабкої взаємодії голівок міозину з актином (у стані розслаблення), такий перехід заблоковано. Цей перехід викличе незначну зміну топографії актинового філамента, який складно однозначно зафіксувати за допомогою існуючих методів дослідження. Ще одним аргументом на користь даного механізму є суто геометричний. Очевидно, що зміщення ТМ уздовж актинового філамента з одночасною зміною орієнтації глобул актину є більш вигідним, ніж зміщення у напрямку, перпендикулярному до осі актинового філамента, який він обвиває.
Роль ТМ полягає ще й у стабілізації актинового філамента, який без нього є досить динамічною структурою. Без тропоміозину можливою є деполімеризація актинового філамента під дією АТФ, яка енергетичне забезпечує скорочення м'яза.
У запропонованому механізмі регуляції м'язового скорочення-розслаблення актиновий філамент у цілому функціонує як єдине ціле, як динамічна кооперативна надмолекулярна білкова структура.
Гіпотези м'язового скорочення. Сучасну модель механізму скорочення скелетних м'язів було запропоновано у двох роботах А. і X. Хакслі (1954). Фактично це модель взаємного ковзання двох типів протофібрил. В її основу покладено важливі факти, одержані на основі електронномікроскопічних і рентгенографічних досліджень. Допускається, що товсті й тонкі протофібрили здатні зміщуватись відносно одна одної. Загалом, під час скорочення довжина філаментів не змінюється, відбувається лише зміна напрямку руху (орієнтації) поперечних містків. Сила, яку розвиває саркомер в ізометричному режимі, за сталої його довжині є пропорційною кількості містків у зоні перекриття товстих і тонких протофібрил. Значні зусилля, спрямовані на отримання незаперечних доказів на користь даного механізму скорочення, не дали очікуваних результатів. Тому сьогодні існують кілька моделей і концепцій механізму скорочення скелетних м'язів (М. Мірошниченко, М. Шуба, 1990). Деякі результати цих досліджень наведено нижче.
Кожен міозиновий філамент у структурі саркомера оточений шістьма тонкими нитками. Ці трубкоподібні структури названо мінімальним скоротливим елементом (МСЕ). Якщо побудувати МСЕ за товщини міозинових й актинових ниток 16 і 10 нм, відповідно, відстані між їхніми центрами 26-27 нм, довжини голівки 19 нм та її товщини 6 нм, то перпендикулярне розташування голівок міозину відносно тонких ниток виявиться не можливим, тому що їхня довжина значно перевищує відстань (приблизно 13 нм) між поверхнями актинових і міозинових філаментів.
Певні особливості існують також й у структурі актинових філаментів у зв'язку з наявністю тропонін-тропоміозинового комплексу, який виходить з регістра тонкої нитки. Таке взаємне розташування структур у МСЕ робить ковзання актинових і міозинових філаментів відносно один одного практично не можливим.
Проте взаємне переміщення товстих і тонких ниток може відбуватися за рахунок укручування міозинових філаментів, які у зв'язку зі спіральним розташуванням голівок молекул міозину нагадують своєрідний гвинт (рис. 11.14, 11.17), у трубкоподібні структури, утворені актиновими філаментами. Оскільки молекули міозину однієї половини товстої нитки орієнтовані в один бік, а другої – в інший, то лінія М у саркомері служить межею, відносно якої міозиновий філамент закручується в різні боки. Аналогічне явище можна спостерігати, якщо кінці гумової трубки обертати у протилежні боки.
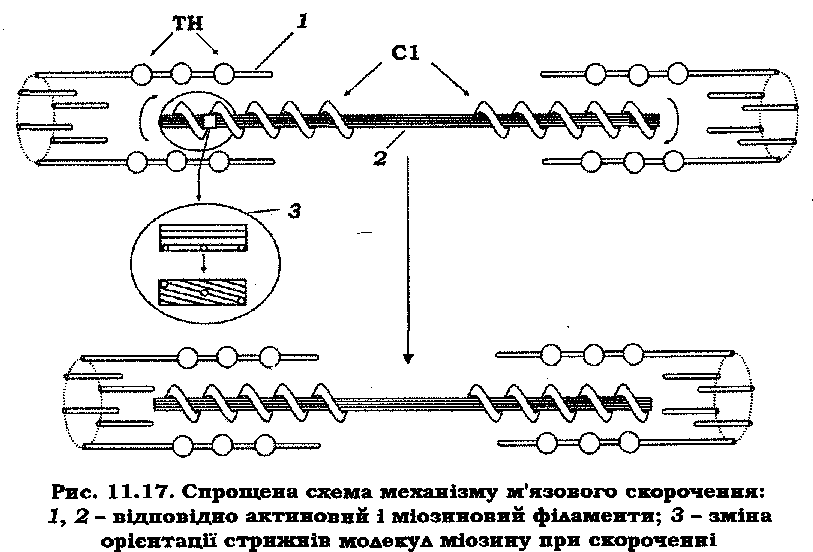
Розрахуємо, яку кількість обертів має зробити міозиновий філамент за вкорочення саркомера, наприклад, на 40 %. Для саркомера довжиною 2,5 мкм у стані спокою це становитиме 500 нм на половину його довжини. Розділивши цю відстань на крок спіралі 42,9 нм, одержимо, що за зазначеного вкорочення саркомера кінці міозинового філамента мають зробити 12 обертів. Це реально, тому що за рівномірного розподілу закручування вздовж філамента на період у 42,9 нм, тобто на один виток, з огляду на вищенаведені розрахунки припадає всього 12/17 оберту.
Є підстави вважати, що закручування товстого філамента буде рівномірно розподіленим уздовж філамента.
Аналіз структури МСЕ показує, що існують, принаймні, два структурні чинники, що визначають як ступінь, так і рівномірність закручування філаментів, починаючи з дистальних кінців. Перший чинник – це "внутрішня різьба" МСЕ, зумовлена чіткою періодичністю (400 нм) розташування тропонінів на актиновому філаменті. Тому крок спіралі, утвореної голівками молекул міозину на поверхні остова товстої нитки, менше 400 нм при закручуванні виявиться стерично невигідним на дистальних кінцях товстих філаментів, де голівки молекул міозину в першу чергу включаються в роботу, що усуне "перекручування" товстої нитки на дистальних кінцях і викличе рівномірний розподіл закручування вздовж: товстої нитки. Рівномірному розподілу закручування міозинового філамента сприятиме й наявність еластичності. Закручування кінців філамента зробить їх більш жорсткими, тобто закручування відбуватиметься вздовж нього. Другий фактор – це структура міозинового філамента, точніше, розміри голівок молекул міозину. Оскільки при скороченні м'яза спостерігається зменшення одного з меридіональних рефлексів від 14,3 до 13 нм, то й відстань між голівками відповідно до моделі міозинового філамента зменшується до 6,5 нм. А цей розмір, як показують дані електронної мікроскопії, відповідає товщині голівки міозину, тобто голівки молекул міозину будуть стикатися. Тому подальше закручування міозинового філамента на дистальних кінцях обмежуватиметься також і розмірами голівок міозину.
Закручування міозинового філамента при м'язовому скороченні потребує механізму, який не дозволяв би йому розкручуватися. Очевидно, таким механізмом можуть бути дві голівки молекули міозину, які працюють по черзі, не заважаючи одна одній, і завершення робочого циклу однієї голівки зумовлює вмикання в роботу іншої. Функціонування голівок молекул міозину в такому режимі виглядає доцільним і має експериментальне підтвердження, адже в будь-який момент часу при скороченні м'яза половина голівок працюючих молекул міозину виявляться зв'язаними з тонкими філаментами. Тому зв'язок між актиновими й міозиновими нитками постійно буде міцним, що необхідно при розвитку напруження у м'язі.
Скорочення м'яза відбувається за рахунок внутрішніх переміщень у структурі самої голівки, що веде до зменшення відстані між місцем зв'язування голівки з актиновим філаментом і місцем її прикріплення до остова товстої нитки. При цьому міозиновий філамент обертається при одночасному переміщенні товстих і тонких ниток щодо одна одної. Очевидна енергетична перевага такого механізму полягає в тому, що "мотор" – центр зв'язування і розщеплення АТФ – розташований практично по середині прямої лінії, що з'єднує місце кріплення голівки міозину до товстого філамента та місце її приєднання до актинового філамента.
Дані рентгенівської дифракції свідчать про те, що основна частина голівки, що утворює місток, не змінює орієнтації під час скорочення, але можливою є зміна положення лише частини голівки. Міозинова голівка складається з трьох доменів (23, 50 і 27 кД), які можуть змішуватися при гідролізі АТФ, і їх відносний рух може служити основою генерації тягнучої сили.
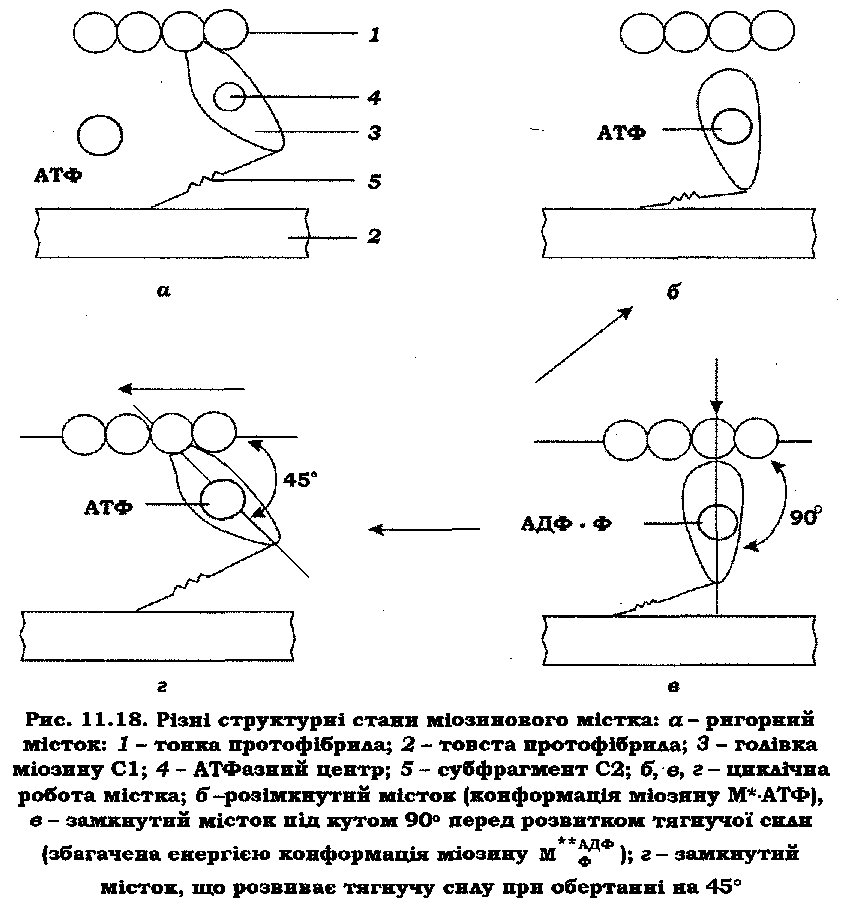
У даний час значного поширення набула модель "ковзного" філамента – містка, що обертається (А. Хакслі із співав., 1971). Аргументація на користь даної моделі базується на наведених нижче положеннях. Обертання містка у стрижневій частиш міозину забезпечують існуючі гнучкі шарнірні ділянки (рис. 11.11): один шарнір з'єднує голівку із субфрагментом С2 (шарнір С1-С2), інший – з'єднує С2 з ЛММ (шарнір С2-ЛММ). Поперечні містки виконують циклічні рухи при скороченні м'яза. За допомогою електронної мікроскопії й дифракції рентгенівських променів вивчено різні стани містка. За нормальних фізіологічних умов у саркомері міститься близько 5 ммоль/л АТФ. При відмиванні концентрація АТФ у м'язових волокнах значно зменшується, що приводить до утворення жорстких поперечних містків між: товстими й тонкими протофібрилами. Завдяки цьому м'яз переходить у стан ригора. Ригорні містки орієнтовані під кутом 45° до тонких протофібрил (рис. 11.18, а). Експериментальні факти свідчать про те, що ригорний стан містка фактично відображує завершення циклу тягнучого містка. Три інші стани містка (рис. 11.18, б, в і г) за фізіологічних умов відповідають його циклічній роботі.
У релаксованому м'язі поперечні містки міозинових протофібрил (рис. 11.18, б) орієнтовані перпендикулярно (кут 90°) до актинової протофібрили, але не зв'язані з нею. У цих умовах конформація міозинових голівок відповідає інтермедіату М*АТФ, що утворюється при гідролізі АТФ (рис. 11.12). Перед розвитком тягнучої сили місток замикається під кутом 90°, і в результаті активації актином утворюється збагачений енергією інтермедіат МФ**АДФ (рис. 11.12, в). Запасена енергія витрачається на обертання містка (перехід 90 ° —> 45 °), у результаті чого генерується тягнуча сила, яка змішує актинону протофібрилу на невелику відстань близько 10 нм (рис. 11.18, г). Слід підкреслити, що наведені дані (В. Зима, А. Філенко, рис. 11.13) можна так само використати для обґрунтування двох останніх моделей скорочення.
Незважаючи на велику кількість робіт, що обґрунтовують модель ковзання протофібрил, лишається не вирішеним головне питання – як перетворюється енергія гідролізу АТФ на молекулярному рівні на механічне взаємне переміщення протофібрил. За гіпотезою О. Давидова (1977), енергія гідролізу АТФ (33 кДж • моль-1) є достатньою для збудження внутрішньомолекулярних коливань у білку. Такими коливаннями можуть бути коливання пептидних груп (Амід І) із частотою 1650-1660 см-1 (енергія становить 20,5 кДж • моль-1).
Регулярне розташування пептидних груп в а-спіральних ділянках міозинових філаментів спричинює колективний характер коливань певних груп. Колективне збудження, яке називається солітоном, передається на значні відстані вздовж: суперспіральних ділянок міозину. Отже, за цією гіпотезою, енергія гідролізу АТФ перетворюється на солітонні збуджені стани, які можуть виконувати певну роль у генерації механічної сили. У цій гіпотезі велика роль відводиться не лише голівці, але й стрижневій частині міозину.
