
11.2. Зв'язок між збудженням і скороченням у поперечносмугастих м'язах
Потенціал дії фазного м'язового волокна викликає поодиноке скорочення. Це скорочення починається, як правило, вже після закінчення потенціалу дії й триває 200-300 мс. Час від початку виникнення потенціалу дії до початку появи скорочення називають латентним періодом скорочення, який триває 5-10 мс.
Якою ж є роль потенціалу дії в активації скорочення? По-перше, скорочення, як уже згадувалось, починається після того, як практично припинилися потенціал дії й спричинені ним іонні струми в мембрані. По-друге, за прямої дії електричного струму на міофібрили не вдається одержати їх скорочення по всій довжині. Водночас м'язове волокно скорочується у відповідь на його деполяризацію по всій довжині, наприклад, гіперкалієвим розчином, за відсутності можливості виникнення локальних кільцевих струмів.
Іони Nа+, що беруть участь у генерації потенціалу дії, мабуть, також не впливають на активацію скорочення, оскільки за їх повної відсутності в омивному розчині або за блокування їх входу в м'язове волокно ТТХ, а отже, й за блокування потенціалу дії можна викликати скорочення у відповідь на деполяризацію м'язового волокна гіперкалієвим розчином або електричним струмом. Усі ці факти свідчать про те, що при збудженні активації скорочення головним є сам факт деполяризації мембрани м'язового волокна під час генерації потенціалу дії, а не іонна природа цієї деполяризації.
А. Хілл показав (1948), що позаклітинні іони Са2+ не здатні прямо активувати міофібрили, оскільки для дифузії іонів від поверхні м'язового волокна до його центру потрібно набагато більше часу, ніж час фактичного латентного періоду скорочення. Крім того, обробка м'язового волокна гліцерином або гіпертонічним розчином Рінгера спричиняє зворотне пригнічення скорочення, хоч волокно не втрачає здатності генерувати потенціали дії й відповідати деполяризацією на дію гіперкалієвого розчину Рінгера.
Разом з тим, кофеїн викликає скорочення м'язового волокна, зовсім не впливаючи при цьому на його мембранний потенціал. Більше того, кофеїн активує скорочення й у тих м'язових волокнах, в яких деполяризація плазматичної мембрани й потенціал дії вже не здатні викликати скорочення, наприклад, у волокнах, підданих дії гліцерину.
Усі ці спостереження свідчать, що між збудженням плазматичної мембрани м'язового волокна та його скороченням має існувати складний структурно-функціональний зв'язок. А. Хакслі (1959) припустив, що цей зв'язок здійснюється за допомогою системи поперечних трубочок плазматичної мембрани (Т-системи) і внутрішньоклітинного саркоплазматичного ретикулума (рис. 11.3). Дійсно, локальна деполяризація м'язового волокна жаби електричним струмом, що підводився до поверхні волокна за допомогою мікроелектрода, викликала скорочення лише тоді, коли мікроелектрод перебував у ділянці Z-дисків, тобто в ділянці виходу Т-трубочок назовні. При цьому скорочення охоплювало лише прилеглі до даного Z-диска дві половинки І-смужок. Отже, розрив зв'язку між збудженням і скороченням під впливом гліцерину або гіпертонічного розчину Рінгера зумовлено порушенням деполяризації й збудженням Т-системи внаслідок її руйнування.

Рис. 11.3. Одночасна реєстрація потенціалу дії й скорочення фазного
м'язового волокна щура (методика подвійного сахарозного містка а).
Схематичне зображення послідовності процесу збудження-скорочення в поперечносмугастому м'язовому волокні (б-г);
а: 1 - скорочення; 2 - потенціал дії; б- м'язове волокно в розслабленому
стані, поверхнева 1 і тубулярна 2 мембрани поляризовані, потенціал
спокою дорівнює -90 мВ, внутрішньоклітинна концентрація іонів Са2+
становить 10-7 моль/л; АТФ - 5 • 10-3 моль/л; 3, 4 - термінальні цистерни
й поздовжні трубочки саркоплазматичиого ретнкулума, відповідно;
С - саркомер; в - під час потенціалу дії різниця потенціалів
на поверхневій і тубулярних мембранах реверсує й стає всередині
позитивною (+30 мВ), відбувається стимуляція виділення іонів Са2+
із цистерн саркоплазматичного ретнкулума; г - у кінці потенціалу дії
внутрішньоклітинна концентрація іонів Са2+ досягає 10-5 моль/л,
потенціал спокою майже відновлюється до початкової величини (-80 мВ)
Скорочення, що виникають за цих умов під впливом кофеїну, пов'язані з прямою дією цієї речовини на саркоплазматичний ретикулум, що приводить до вивільнення з нього іонів Са2+, які активують скорочення. Таким чином, необхідна спеціальна система керування скоротливою діяльністю всіх міофібрил – від периферії й до центру м'язового волокна. Збудження має швидко поширюватись в товщу волокна на відстань понад 10 мкм від сарколеми й синхронізувати активність усіх міофібрил. Цю роль виконує спеціальна струкгурно-функціональна система електромеханічного зв'язку. Вона включає сарколему, Т-систему, саркоплазматичний ретикулум і регуляторні білки тонкої протофібрили. Т-система має велику кількість інвагінацій плазматичної мембрани до середини волокна. Це система поперечних трубочок діаметром близько 0,03 мкм, що проходять перпендикулярно до осі волокна й розташовуються в ділянці 2-дисків або поблизу перекриття І- та А-смужок.
Порожнини Т-трубочок сполучаються із зовнішнім середовищем. Сумарна площа поверхні мембран Т-трубочок у чотири рази більша, ніж площа поверхневої плазматичної мембрани волокна діаметром 50 мкм. Повноцінний потенціал дії, що виникає в мембрані Т-системи, здатен збуджувати всі міофібрили волокна в радіальному напрямку. Це зумовлює швидке скорочення волокна за типом "все або нічого". Поряд із цим мембрана Т-системи здатна й до градуальної деполяризації, яку викликає, наприклад, гіперкалієвий розчин або електричний струм в умовах фіксації потенціалу. Ця деполяризація активує градуальне скорочення м'язового волокна.
Усе це засвідчує, що деполяризація мембрани Т-трубочок передає й регулює надходження сигналу від поверхневої частини плазматичної мембрани до саркоплазматичного ретикулума, завдяки чому стимулюється вивільнення з нього іонів Са2+.
Саркоплазматичний ретикулум (СР). Кожна структурно-функціональна мікросубодиниця фазного м'язового волокна – саркомер – оточена сіткою СР, який становить 10-15 % об'єму волокна. Площа мембрани СР приблизно у 100 разів більша, ніж площа плазматичної мембрани. У порожнинах СР містяться ті самі іони, що й у міоплазмі: К+, Na+, С1- і Са2+, і його мембрана є добре проникною для цих іонів.
Ретикулум кожного саркомера містить термінальні цистерни, що охоплюють міофібрили у вигляді майже суцільних манжет з обох боків від Z-диска, і поздовжні канали, які посередині А-смужки зливаються у плоску цистерну, що охоплює міофібрили з усіх боків. Ця структура має назву продірявлений комірець, або обруч, оскільки для неї характерними є невеликі круглі отвори. СР двох сусідніх саркомерів однієї міофібрили ізольовані один від одного Z-диском. Інколи ця ізоляція порушується анастомозами між сусідніми цистернами. Усі елементи СР і Т-трубочки є спільними для сусідніх паралельно розміщених міофібрил даного саркомера. СР містить, виділяє й реакумулює іони Са2+, які відіграють основну роль в активації скорочення.
Через мембрану термінальних цистерн іони Са2+ виходять з ретикулума в міоплазму, тоді як через мембрану поздовжніх трубочок відбувається активний транспорт іонів Са2+ назад до ретикулума.
Структурно-функпдонадьний зв'язок між Т-системою й саркоплазматичним ретикудумом. Як правило, на поздовжніх зрізах волокон трубочки Т-системи й прилеглі до них термінальні цистерни СР виглядають як трикомпонентні структури, що мають назву тріади. У тісному контакті з термінальними цистернами перебуває приблизно 80 % поверхні Т-системи.
Найхарактернішими рисами ділянки контакту Т-системи з термінальними цистернами ретикулума є: паралельне розміщення мембран цих структур на відстані 10-20 нм і наявність містків між двома мембранами. Високомолекулярні маркери – феритин, пероксидаза хрону та інші – добре проникають у порожнину Т-трубочок, але не проникають усередину СР. Водночас досліди з калієвою деполяризацією, а також з деполяризацією в умовах фіксації потенціалу свідчать про надійний і точний контроль мембранним потенціалом сили скорочення м'язового волокна.
На сьогодні немає задовільного пояснення передачі сигналу від Т-системи до СР для активації вивільнення іонів Са2+ з останнього. Припускається, що в цьому процесі велику роль відіграє зміщення негативних зарядів у мембрані Т-трубочок під час збудження або деполяризації. Ці заряди або механічно зміщують містки у тріадах, що спонукає до відкриття Са2+-каналів мембрани ретикулума (механічна модель), або заряди, проходячи через містки, деполяризують мембрану ретикулума, що, у свою чергу, активує відкривання її Са2+-каналів (електрична модель). Згідно із хімічною моделлю, при збудженні передача сигналу від Т-системи до СР здійснюється або за допомогою іонів Са2+, що входять у м'язове волокно через Са2+-канали мембрани Т-трубочок, або за допомогою інозитолтрифосфату, що утворюється в мембрані Т-трубочок. Іони Са2+ та інозитолтрифосфат, у свою чергу, активують звільнення іонів Са2+ із цистерн СР.
Вивільнення іонів Са2+ із саркопдазматичного ретикулума. Найбільш ефективним методом дослідження вивільнення іонів Са2+ із СР є метод використання актованих (позбавлених плазматичної мембрани) м'язових волокон. Цей метод дозволяє прямо стимулювати СР різними агентами, оминувши плазматичну мембрану. Показником же кількості вивільненого кальцію є напруження, що створюється скінованим волокном, і вихід 45Са із ретикулума. Ці дослідження показали, що вивільнення кальцію із СР стимулюється: а) деполяризацією мембрани ретикулума електричним струмом; б) іонами Са2+ (кальційіндуковане вивільнення кальцію) або інозитолтрифосфатом, які додаються до розчину, що омиває м'язове волокно; в) зменшенням в омивному розчині концентрації іонів Мg2+; г) додаванням до омивного розчину кофеїну.
Досліди на скінованих волокнах дозволили точно визначити співвідношення між концентрацією іонізованого кальцію й механічним напруженням волокна. Виявилось, що: а) концентрація 10-7 моль/л іонів Са2+ є пороговою для активації скорочення; б) скорочення зберігається доти, поки утримується підвищена концентрація іонів Са2+ в омивному розчині; в) крива співвідношення між концентрацією іонів Са2+ і напруженням м'яза має класичну S-подібну форму.
Застосування в останні 20 років кальційчутливих барвників (арсеназо III, квін-2, мурексид, фура-2, індо-1 та ін.) і фотопротеїну екворину дозволило прямо визначати концентрацію іонів Са2+ у міоплазмі у процесі спряження між збудженням і скороченням м'язового волокна.
Як видно з рис. 11.4, а, між початком виникнення потенціалу дії (без урахування препотенціалу) й появою арсеназного сигналу існує латентний період близько 2 мс. Це і є якраз той час, що витрачається на спряження збудження зі скороченням. Саме ж скорочення починається тоді, коли, судячи з розвитку арсеназного сигналу, внутрішньоклітинна концентрація іонів Са2+ в міоплазмі наближається до свого максимуму.
Зменшення арсеназного сигналу, а отже, й внутрішньоклітинної концентрації вільного кальцію в міоплазмі відбувається за простою експонентою. Це означає, що в даному процесі задіяний, мабуть, лише один механізм – активний транспорт іонів Са2+ всередину СР.
За даними арсеназного методу, один потенціал дії вивільняє близько третини всього кальцію, що є в СР. Якби не працював механізм зворотного активного транспорту іонів Са2+ всередину СР, то тієї концентрації кальцію, що є в ретикулумі (близько 1 ммоль/л), вистачило б тільки для трьох-чотирьох поодиноких скорочень, що виникали б одне за одним.
За частої стимуляції м'язового волокна арсеназний сигнал уже на другий стимул помітно зменшується, хоч амплітуди потенціалів дії та фазних скорочень при цьому залишаються сталими. Водночас зменшується, мабуть, і робота активного зворотного закачування іонів Са2+ всередину СР. Як результат - загальний рівень вільного кальцію за тетанусу залишається таким самим, як і при першому стимулі або навіть трохи збільшується (рис. 11.4, б, в).
Цікаві дані отримано при дослідженні зв'язку між деполяризацією й скороченням фазних м'язових волокон, а також між деполяризацією й концентрацією іонів Са2+ в міоплазмі. Стійку й тривалу деполяризацію м'язових волокон можна отримати шляхом або збільшення зовнішньої концентрації іонів К+, або зміщення мембранного потенціалу в умовах фіксації напруження.
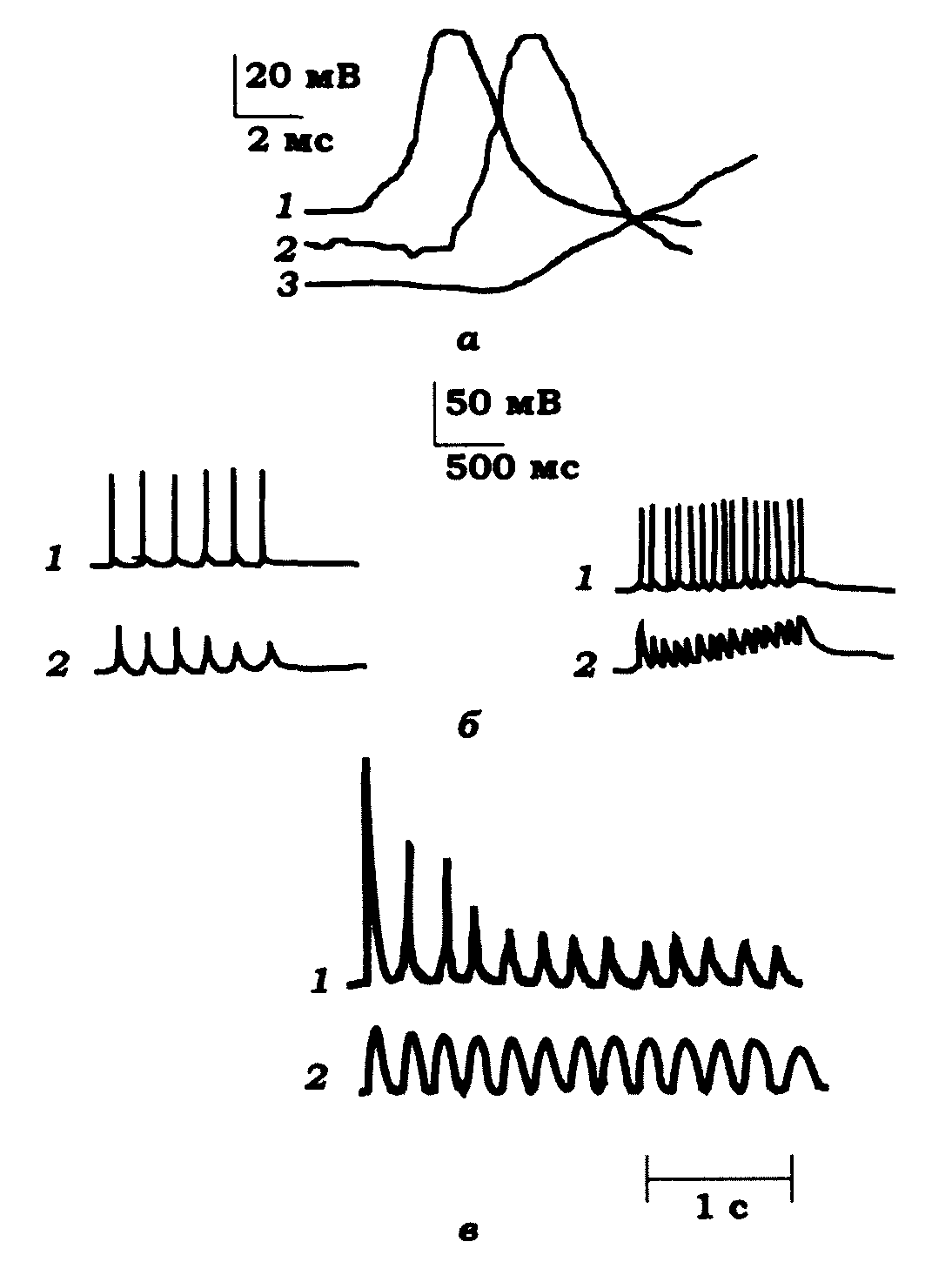
Рис. 11.4. Зміна внутрішньоклітинної концентрації іонів Са2+,
що виявляється за допомогою арсенази (a, б) і екворнну (в) всередині
фазного м'язового волокна жаби у відповідь на поодиноку й часту
стимуляцію. На електрограмах а, б: 1 - потенціал дії; 2 - арсеназний
сигнал; 3 - скорочення (на електрограмах б частота стимуляції
становить 3 Гц (ліворуч) і 7 Гц (праворуч)); в - одночасна реєстрація
екворинового сигналу (1) і фазних скорочень (2) (частота подразнення
дорівнює 5 Гц)
В обох випадках деполяризація супроводжується скороченням м'язового волокна, що має такі особливості (рис. 11.5, а, б):
а) за тривалої деполяризації м'язового волокна після початкового скорочення настає мимовільне його розслаблення, яке починається тим раніше, чим більшою є величина деполяризації;
б) амплітуда максимального скорочення перебуває в S-подібній залежності від ступеня деполяризації м'язового волокна;
в) порогова деполяризація для активації скорочення становить 30-35 мВ, а максимальне скорочення спостерігається за деполяризації до 40 мВ;
г) повторна деполяризація м'язового волокна супроводжується зменшенням амплітуди скорочення;
д) відсутність в омивному розчині іонів Са2+ не перешкоджає розвитку скорочення у відповідь на деполяризацію.
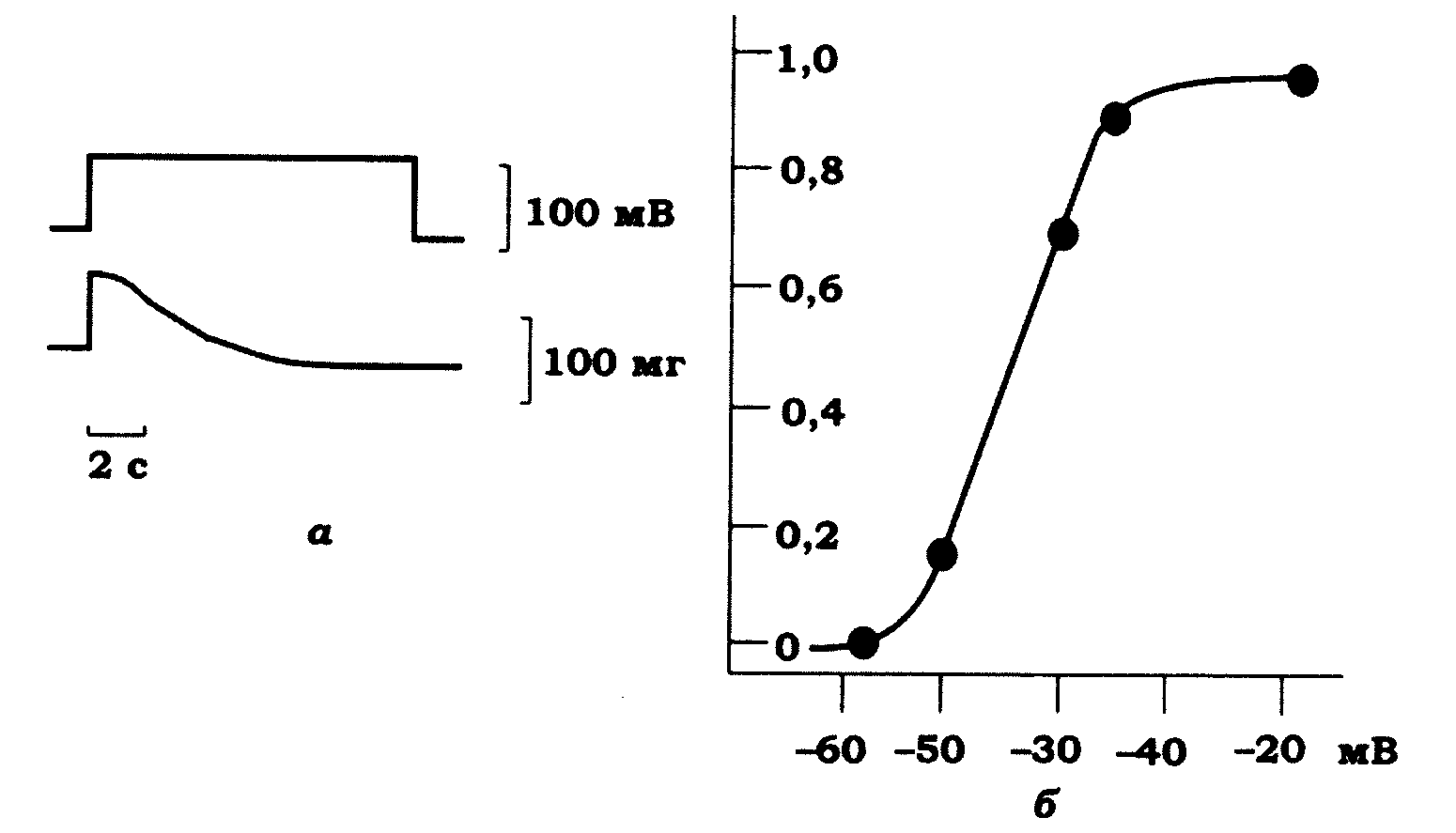
Рис. 11.5. Скорочення (а) ізольованого поперечносмугастого фазного
м'язового волокна (нижня крива) у відповідь на фіксовану ступінчасту
деполяризацію (верхня крива) і залежність амплітуди скорочення
від величини ступінчастої фіксованої деполяризації (б). Тривалість
деполяризації становить 1 с. Підтримуваний потенціал досягає -100 мВ.
Вісь ординат - відносна амплітуда скорочення (максимальне
скорочення прийнято за одиницю), вісь абсцис - мембранний
потенціал, мВ. Потенціали дії пригнічені тетродотоксином (ТТХ)
Еквориновий сигнал, що відображає концентрацію вільного кальцію в міоплазмі, також збільшується зі збільшенням ступеня й тривалості деполяризації м'язового волокна. При цьому і скорочення, і еквориновий сигнал інактивуються в міру дії тривалої стійкої деполяризації. Звідси випливає, що довільне розслаблення м'язового волокна за калієвої контрактури зумовлюється виключно інактивацією вивільнення іонів Са2+ із СР.
Особливості активації скорочення в тонічних поперечносмугастих м'язових волокнах. Характерною властивістю тонічних м'язових волокон є те, що за нормальних умов вони не здатні генерувати потенціали дії. У відповідь на деполяризацію в цих волокнах виникає контрактурне скорочення, яке триває до того часу, поки зберігається деполяризація. Максимально активоване тонічне м'язове волокно вкорочується або розвиває напруження приблизно в 10 разів повільніше, ніж фазне волокно, а потім у стільки ж разів повільніше розслаблюється. Т-система й саркоплазматичний ретикулум тонічного волокна розвинуті слабкіше, зв'язок між ними існує не лише у вигляді тріад, але й діад, а площа контакту становить тільки 63 %. Проте амплітудно-кінетичні характеристики скорочення в тонічних і фазних волокнах є подібними. Ця схожість полягає в тому, що обробка тонічного волокна гліцерином (хоч і в більшій, ніж у випадку фазних волокон, концентрації) роз'єднує електромеханічний зв'язок, а поріг активації й латентний період скорочення, що спричинюється деполяризацією в умовах фіксації напруження, є однаковими.
Механізми активації вивільнення іонів Са2+ із СР фазних і тонічних волокон є ідентичними, й різниця полягає тільки у відсутності в тонічних волокнах потенціало- і часозалежної інактивації вивільнення іонів Са2+ з ретикулума.
Повільний же розвиток напруження в тонічних волокнах зумовлений, імовірно, більш повільними процесами взаємодії іонів Са2+ з тропонін-тропоміозиновим комплексом і зворотним активним транспортом іонів Са2+ в СР.
