
- •ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
- •КИЇВ НУХТ 2010
- •Лабораторна робота № 3
- •Лабораторна робота № 4
- •Лабораторна робота № 5
- •Таблиця 5.1
- •Кількісний облік мікроорганізмів
- •Лабораторна робота № 6
- •Лабораторна робота № 7
- •Лабораторна робота № 9
- •Лабораторна робота № 11
- •Лабораторна робота № 15
- •Нітрифікуючі бактерії
- •Nitrosomonas europaea
- •Nitrobacter winogradskyi
- •Nitrobacter winogradskyi
- •Характеристика накопичувальних культур мікроорганізмів
- •ЛІТЕРАТУРА
- •ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
- •ЛАБОРАТОРНИЙ ПРАКТИКУМ
показник БГКП), чашки з сусло-агаром (для виявлення грибів і дріжджів), чашки з середовищем Чистовича (для виявлення стафілококів).
5. Здійснити мікробіологічний контроль лабораторного обладнання,
посуду, стін, підлоги, рук та одягу. Змиви з обладнання, стін, підлоги, рук та одягу, промивні води після ополіскування посуду висіяти на чашки з МПА.
Контрольні запитання
1. Які мікробіологічні показники характеризують якість сировини та готової продукції?
2.Що таке показник МАФАМ? У яких одиницях він виражається?
3.Назвіть санітарно-показові мікроорганізми. Що таке показник БГКП? У яких одиницях виражається?
4.Охарактеризуйте контамінуючу мікрофлору меляси. Які заходи використовують для знищення небажаної мікрофлори у мелясі?
5.Які мікроорганізми можуть інфікувати кукурудзяний екстракт?
6.Назвіть контамінуючу мікрофлору солоду та способи її попередження.
7.Охарактеризуйте кількісний і якісний склад мікрофлори борошна.
8.Охарактеризуйте сторонню мікрофлору цукру.
9.Як здійснюється мікробіологічний контроль хлібопекарських дріжджів, кефіру та пива?
Лабораторна робота № 11
ФІЗІОЛОГІЯ МІКРООРГАНІЗМІВ. КАТАБОЛІЗМ ВУГЛЕВОДІВ
(4 год.)
Мета роботи: ознайомлення із шляхами метаболізму глюкози та інших вуглеводів в аеробних та анаеробних умовах, методами визначення типу метаболізму (окислювальний чи бродильний, аеробний чи анаеробний), опанування тестів на мікробний гідроліз крохмалю, MRVPта O/F-тестів.
Матеріали та обладнання: спиртівки, бактеріологічні петлі, чашки Петрі з картопляним агаром, пробірки з рідкими поживними середовищами, що містять різні вуглеводи, пробірки з напіврідким O/F-глюкозним середовищем, стерильна вазелінова олія або стерильний«голодний» агар, пробірки з MRVPсередовищем, термостат, мікроорганізми (Bacillus subtilis, Escherichia coli, Pseudomonas aureofaciens, Alcaligenes faecalis, Enterobacter cloaceae, Proteus vulgaris).
Загальні відомості
Основні поняття про метаболізм. Поживні речовини, які поступають у клітину, піддаються суттєвим перетворенням і змінам. Перетворення речовин у
89
клітині називається обміном речовин, |
або |
метаболізмом. |
Такі |
перетворення |
|
||||||||
речовин у клітині можна розділити на три етапи. |
|
|
|
|
|
||||||||
На |
першому |
етапі |
поживні речовини розщеплюються на невеликі |
||||||||||
фрагменти. Так, з |
глюкози утворюється |
фосфоенолпіруват, піруват, ацетил- |
|
||||||||||
КоА. Цей етап називається розпадом, або катаболізмом. |
|
|
|
|
|||||||||
На |
другому |
етапі |
ці |
утворені |
з |
субстрату |
невеликі |
фрагмен |
|||||
перетворюються в |
ряд |
органічних кислот(наприклад, |
оксалоацетат |
та 2- |
|
||||||||
оксоглутарат) та фосфорних ефірів. Другий етап називаєтьсяпроміжним |
|
||||||||||||
обміном, або амфіболізмом. Перший та другий етапи непомітно переходять |
|||||||||||||
один в другий. |
|
|
|
|
|
|
|
|
|
|
|
||
На |
третьому етапі |
з проміжних |
сполук |
утворюються |
так |
звані |
|||||||
«будівельні блоки» – мономери (амінокислоти, цукрофосфати, жирні кислоти, |
|
||||||||||||
нуклеотиди), |
необхідні |
для |
синтезу |
|
полімерних |
макромолекул(білків, |
|
||||||
амінокислот, |
полісахаридів, |
ліпідів, нуклеїнових кислот), з яких складається |
|||||||||||
мікробна клітина. Цей етап утворення клітинних речовин(синтез мономерів та |
|
||||||||||||
полімерів) |
|
називається |
анаболізмом, |
конструктивним |
метаболізмом, |
||||||||
біосинтезом. У науковій літературі найуживанішим є термін«конструктивний |
|
||||||||||||
метаболізм». |
|
|
|
|
|
|
|
|
|
|
|
|
|
Шляхи катаболізму глюкози у мікроорганізмів. На сьогоднішній день |
|
||||||||||||
відомо 4 шляхи катаболізму глюкози, які функціонують у мікроорганізмів. |
|
|
|||||||||||
Фруктозо-1,6-дифосфатний шлях (гліколіз). Третя |
назва |
цього |
шляху |
||||||||||
катаболізму глюкози – шлях Ембдена-Мейєргофа-Парнаса. У процесі гліколізу |
|
||||||||||||
глюкоза перетворюється на піруват. |
|
Перетворення 1,3-дифосфогліцерату у |
|
||||||||||
3-фосфогліцерат спряжено з утворенням АТФ. Ця реакція є одним з пунктів |
|
||||||||||||
гліколізу, |
в |
яких |
АТФ утворюється |
в |
результаті фосфорилювання |
на |
рівні |
||||||
субстрату. Перетворення ФЕП на піруват є другим пунктом утворенням АТФ на рівні субстратного фосфорилювання.
Сумарну реакцію розщеплення глюкози за шляхом Ембдена-Мейєргофа- Парнаса можна представити у вигляді:
Глюкоза ® 2 Піруват + 2 АТФ + 2 НАДН.
Шлях Ентнера-Дудорова. Шлях Ентнера-Дудорова є характерним тільки для мікроорганізмів. Його особливістю є , тещо один з інтермедіатів (проміжних продуктів) – 2-кето-3-дезокси-6-фосфоглюконова кислота (КДФГ)
– унікальний, у зв’язку з чим шлях Ентнера-Дудорова називають також КДФГшляхом. Під час КДФГ-шляху глюкоза перетворюється на піруват:
Глюкоза ® 2 Піруват + АТФ + НАДН + НАДФН.
Шлях Ентнера-Дудорова досить широко розповсюджений у аеробних
бактерій, а от у анаеробів він зустрічається дуже рідко. І зрозуміло чому. В |
|
||||||
анаеробів |
немає |
дихального |
ланцюга, і |
АТФ |
утворюється |
під |
час |
фосфорилювання на рівні субстрату. У зв’язку з цим гліколіз для них є економічнішим: він дає 2 молекули АТФ у процесі перетворення1 моль глюкози у 2 моль пірувату, в той час як у КДФГ-шляху на два моль пірувату утворюється лише один моль АТФ.
90
Розщеплення глюкози через глюконат. Деякі бактерії (наприклад,
псевдомонади) здатні розкладати глюкозу через глюконат. При цьому глюкоза під дією глюкозодегідрогенази окиснюється до глюконату. Акцепторами електронів у глюкозодегідрогеназній реакції можуть бути НАД, НАДФ, а також піролохінолінхінон (ПХХ), тому глюкозодегідрогенази можуть бути НАД-, НАДФта ПХХ-залежними.
Пентозофосфатний цикл. Інші назви цього циклу – фосфоглюконатний шлях, гексозофосфатний шунт. Пентозофосфатний цикл не є основним шляхом розщеплення глюкози. Він слугує постачальником НАДФН для реакцій
конструктивного метаболізму і рибози – для синтезу нуклеотидів. |
|
|
|
||||||||
У пентозофосфатному |
циклі |
глюкозо-6-фосфат перетворюється на |
|
||||||||
рибулозо-5-фосфат (окиснювальні етапи циклу). Наступні реакції є реакціями |
|
||||||||||
перетворення пентозофосфатів у гексозофосфати та навпаки. Дегідрогенази, які |
|
||||||||||
беруть участь у функціонуванні пентозофосфатного циклу, можуть бути НАД+- |
|
||||||||||
або НАДФ+-залежними. |
|
|
|
|
|
|
|
|
|
||
Катаболізм вуглеводів, відмінних від глюкози. |
|
|
|
|
|||||||
Полісахариди. Полімери не можуть проникати через клітинну мембрану. |
|
||||||||||
Тому мікроорганізми синтезують позаклітинні ферменти(гідролази), що |
|
||||||||||
розкладають полімери до невеликих молекул, які можуть транспортуватись у |
|
||||||||||
клітину. |
|
|
|
|
|
|
|
|
|
|
|
Дисахариди. |
Внутрішньоклітинне |
руйнування |
дисахаридів |
часто |
|||||||
починається |
з пірофосфоролітичного |
розщеплення за |
участю |
ферментів |
|
||||||
фосфорилаз: |
|
|
|
|
|
|
|
|
|
|
|
Целобіоза + Ф ® Глюкозо-1-фосфат + Глюкоза (целобіозофосфорилаза); |
|
||||||||||
Деякі |
дисахариди (сахароза, лактоза) |
можуть |
|
розщеплюватися |
|
||||||
гідролазами (інвертаза та b-галактозидаза відповідно). Звичайно, фосфорилази є |
|
||||||||||
більш економічними, ніж вказані гідролази, оскільки під дією фосфорилаз |
|
||||||||||
відразу утворюється фосфорильований вуглевод, тобто для утворення вуглевод- |
|
||||||||||
1-фосфату не потрібна АТФ. |
|
|
|
|
|
|
|
|
|||
Пентози. |
Для |
розщеплення |
пентоз |
у |
багатьох |
мікроорганізмів |
|||||
використовуються неокиснювальні реакції пентозофосфатного циклу. |
|
|
|||||||||
Взаємоперетворення |
|
моносахаридів. |
|
Взаємоперетворення |
|||||||
моносахаридів |
|
відбуваються |
|
|
за |
|
участю |
У |
|||
(уридиндифосфатпохідних вуглеводів). |
|
|
|
|
|
|
|
||||
Окислювальний та бродильний тип метаболізму глюкози. O/F-тест. |
|
||||||||||
Окислювальний (дихальний) метаболізм відбувається в аеробних умовах. За |
|
||||||||||
відсутності |
кисню |
глюкоза |
може |
асимілюватися шляхом бродіння. Для |
|
||||||
визначення типу метаболізму здійснюютьO/F-тест (назва від англійських слів |
|
||||||||||
«oxidation» |
− окиснення і«fermentation» |
− зброджування). Для проведення |
|
||||||||
цього тесту використовують середовище Хью-Лейфсона |
з глюкозою(або |
|
|||||||||
іншими вуглеводами). Це напіврідке поживне середовище, що містить високу |
|
||||||||||
концентрацію вуглеводу і низьку − |
пептону. Пептон забезпечує ріст тих |
|
|||||||||
батерій, які не споживають вуглевод. Посів бактерій здійснюють у дві пробірки |
|
||||||||||
з доступом кисню і без доступу(середовище заливають шаром стерильної |
|
||||||||||
вазелінової |
олії). |
Середовище |
містить |
індикатор бромтимоловий |
синій(за |
|
|||||
91
нейтрального значення рН– зелений), який змінює забарвлення на жовте за присутності кислот, що вказує на метаболізм вуглеводу. Якщо має місце споживання пептону, індикатор має синє забарвлення, оскільки у цьому разі
відбувається |
підлужнення |
середовища. Якщо |
мікроорганізми |
здатні |
||||||
асимілювати |
вуглевод |
шляхом |
його |
окиснення, то |
жовте |
забарвлення |
||||
(утворення |
кислоти) |
буде спостерігатися |
лише у«відкритих» пробірках |
(за |
||||||
доступу кисню), якщо ж відбувається зброджування |
вуглеводу, то кислота |
|||||||||
утворюватиметься |
у |
пробірках, залитих |
шаром |
вазелінової |
.оліїУ |
разі |
||||
зброджування вуглеводів окрім кислот можуть утворюватися і газоподібні продукти. Газоутворення можна спостерігати за наявністю пухирців або розривів напіврідкого середовища.
Зброджувані і незброджувані субстрати. Субстратна специфічність.
Зброджуються полісахариди, гексози, пентози, багатоатомні спирти, органічні кислоти, амінокислоти (за винятком ароматичних), пурини та піримідини. Не можуть зброджуватися насичені аліфатичні та ароматичні вуглеводні, стероїди, каротиноїди. Однією з причин цього є те, що ці сполуки можуть окислюватися тільки в присутності молекулярного кисню за участю оксигеназ. Очевидно, завдяки такій стабільності вуглеводні так довго зберігаються на нафтових
родовищах. |
|
|
|
|
|
|
|
|
Для |
визначення |
субстратної |
специфічності |
за |
бродильного |
тип |
||
метаболізму використовують рідке поживне середовище, що містить пептон, |
|
|||||||
кислотно-лужний індикатор та різні вуглеводи у концентрації0,5−1,0 %. |
|
|||||||
Індикатор феноловий червоний забарвлює нейтральне незасіяне середовище у |
|
|||||||
червоний колір. У процесі зброджування вуглеводів з утворенням кислот рН |
|
|||||||
середовища знижується, і індикатор змінює забарвлення на жовте. |
|
|
|
|||||
MRVP-тест. Цей тест дає змогу визначити які продукти(кислоти чи |
|
|||||||
нейтральний |
ацетоїн) утворюються в результаті бродіння. Середовище MRVP |
|
||||||
(середовище |
Кларка) – це |
поживний |
бульон, |
збагачений |
глюкозою. Воно |
|
||
використовується для проведення тесту з метиленовим червоним(Methyl Red – |
|
|||||||
MR) та реакції Фогес–Проскауера (Voges–Proskauer – VP). Якщо в результаті |
|
|||||||
бродіння з глюкози утворюється кисло, тао після додавання індикатора |
|
|||||||
метилового червоного, середовище почервоніє (рН нижче 4,4). У разі утворення |
|
|||||||
нейтральних продуктів (ацетоїну) метиловий червоний змінює забарвлення на |
|
|||||||
жовтий (рН вище 6,0). Утворення ацетоїну визначають додаванням гідроксиду |
|
|||||||
калію і α-нафтолу. У цьому разі(за наявності ацетоїну) верхня частина |
|
|||||||
середовища стане червоною. У разі негативної реакції Фогес-Проскауера |
|
|||||||
середовище набуде світло-коричневого забарвлення. |
|
|
|
|
||||
|
Завдання на виконання |
|
|
|
|
|||
1. Аналіз мікробіологічного контролю біотехнологічної і харчової |
|
|||||||
продукції (лабораторна робота № 10). |
|
|
|
|
|
|
||
Одержані результати кількісного обліку мікроорганізмів оформити у |
|
|||||||
вигляді табл. 11.1. Узагальнити результати |
дослідів, одержаних |
іншими |
|
|||||
студентами |
за іншими |
варіантами. Скласти |
загальну |
таблицю, |
зробити |
|
||
92

висновки |
про |
якість |
,водисровини |
та |
відповідність |
лабораторного |
|||||
приміщення санітарно-гігієнічним вимогам, а також висновки про якість |
|||||||||||
біотехнологічної і харчової продукції та |
відповідність |
її нормативни |
|||||||||
документам. |
|
|
|
|
|
|
|
|
Таблиця 11.1 |
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Кількість мікроорганізмів, КУО/г |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Зразок |
|
|
|
|
Гриби і |
|
|
|
Молочно- |
||
|
|
|
МАФАМ |
БГКП |
|
Стафілококи |
|
кислі |
|
||
|
|
|
дріжджі |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
бактерії |
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
Гідроліз крохмалю. Дно чашки Петрі, заповненої картопляним агаром, |
|
|
розділяють маркером на три сектори. На перший сектор висівають штрихом |
|
||
культуру Bacillus subtilis, на другий – Escherichia coli, на третій – Pseudomonas |
|
||
aureofaciens. Чашку Петрі, засіяну культурами бактерій, інкубують у термостаті |
|
||
при температурі 37 °С упродовж 1 доби. |
|
|
|
3. |
О/F-тест. Засіяти уколом по |
два стовпчики з напіврідким/F |
О |
глюкозним середовищем однією з таких культур: Escherichia coli, Pseudomonas |
|
||
aureofaciens або Alcaligenes faecalis (на одну бригаду– одна культура). Одну |
|
||
пробірку залити стерильною вазеліновою |
олією або охолодженим 40до °С |
|
|
стерильним «голодним» агаром. Інкубувати в термостаті при37 °С до наступного заняття.
4. |
Визначення субстратної специфічності. Досліджувану культуру |
||||||||
бактерій (Escherichia coli, Pseudomonas aureofaciens, Alcaligenes faecalis, |
|||||||||
Enterobacter cloaceae, Proteus vulgaris) |
за допомогою бактеріологічної петлі |
||||||||
висівають у пробірки з рідким поживним середовищем, що містить відповідний |
|||||||||
цукор. |
Пробірки з |
засіяним |
середовищем |
інкубують |
у |
термостаті при |
|||
температурі 37 °С упродовж 1–2 діб. |
|
|
|
|
|
|
|||
5. |
MRVP-тест. Засіяти |
петлею |
дві |
пробірки MRVPз |
середовищем |
||||
культурою Escherichia |
coli і |
дві |
пробірки |
MRVPз |
середовищем |
культурою |
|||
Enterobacter cloaceae. Інкубувати при 37 |
°С упродовж 48 год чи довше. |
||||||||
Контрольні запитання
1.Що таке метаболізм? На які етапи можна поділити перетворення речовин у клітині?
2.Охарактеризуйте шляхи катаболізму глюкози. Які з них функціонують тільки у мікроорганізмів?
3.Чому КДФГ-шлях рідко зустрічається у ?анаеробівЧому пентозофосфатний шлях не є основним шляхом катаболізму глюкози?
93
4. |
Яким |
чином відбувається катаболізм вуглевод, ідміннихв від |
глюкози? |
|
|
5. |
Чому |
фосфорилази є більш економічними для розщеплення |
дисахаридів, ніж відповідні гідролази?
6.У чому полягає суть O/F-тесту? Чому він так називається?
7.Для чого використовується O/F-тест?
8.Які субстрати можуть зброджуватися?
9.Які субстрати не піддаються зброджуванню і чому?
10.Для чого використовується MRVP-тест? Поясність назву цього тесту.
Лабораторна робота № 12
ФІЗІОЛОГІЯ МІКРООРГАНІЗМІВ. РОЗЩЕПЛЕННЯ БІЛКІВ (4 год.)
Мета |
роботи: ознайомлення |
із |
|
шляхами |
катаболізму |
|
білків |
та |
|||||||||
амінокислот, опанування тестів на мікробний гідроліз желатини та казеїну, |
|
||||||||||||||||
декарбоксилювання аргініну, утворення сірководню та індолу. |
|
|
|
|
|
|
|||||||||||
Матеріали |
та обладнання: спиртівки, |
бактеріологічні |
петлі, |
розчин |
|
||||||||||||
Люголя, розчин метиленового червоного, розчин α-нафтолу, 40 %-ний розчин |
|
||||||||||||||||
КОН, пробірки |
з м’ясо-пептоно-желатиновим середовищем, пробірки з |
|
|||||||||||||||
молоком і метиленовим синім, пробірки з аргініновим бульйоном, стерильна |
|
||||||||||||||||
вазелінова |
|
олія, |
пробірки |
з |
бульйоном |
Хоттінгера, індикаторні папірці, |
|
||||||||||
насичені |
солями |
свинцю і щавлевою кислотою, термостат, мікроорганізми |
|
||||||||||||||
(Escherichia |
coli, |
Pseudomonas |
aureofaciens, |
Enterobacter |
cloaceae, |
Proteus |
|
||||||||||
vulgaris). |
|
|
|
Загальні відомості |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Катаболізм |
білків та амінокислот. Як |
і |
інші |
|
високомолекулярні |
|
|||||||||||
сполуки, |
білки |
спочатку |
розкладаються |
|
позаклітинними |
протеазами |
на |
||||||||||
фрагменти, що здатні легко проникати у клітину– пептиди, олігопептиди та |
|
||||||||||||||||
частково |
амінокислоти. |
Пептиди |
поступають |
у |
клітину |
і |
гідролізуються |
||||||||||
внутрішньоклітинними |
пептидазами |
до |
амінокислот. Амінокислоти |
або |
|
||||||||||||
використовуються |
клітиною |
|
як |
такі |
для |
синтезу , |
абобілка |
піддаються |
|
||||||||
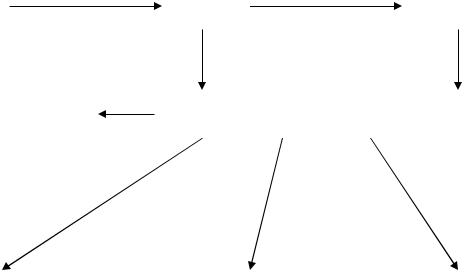
перетворенням, в результаті яких вони дезамінуються і після цього залучаються до проміжного обміну (рис. 12. 1).
Гідроліз желатини можна продемонструвати у процесі вирощування бактерій на середовищі МПЖ(м’ясо-пептонна желатина). Це середовище є щільним за температури нижче 25 °С і розріджується при вищій температурі. У разі гідролізу желатини мікробними екзоферментами, середовище МПЖ залишається рідким за низької температури (нижче 25 °С).
Гідроліз казеїну можна спостерігати у процесі вирощування бактерій на середовищі з молоком і індикатором метиленовим синім. Вихідне середовище є каламутним, оскільки казеїн перебуває у колоїдному стані, барвник має
94
голубий колір. У результаті пептонізації(гідролізу) молока середовище стає прозорим за рахунок розщеплення казеїну до водорозчинних амінокислот та
пептидів. |
Таке |
молоко |
використовують |
для |
визначення |
можливос |
зброджування молочного цукру (лактози). У цьому разі в результаті утворення |
||||||
кислоти |
рН знижується, що |
може супроводжуватися |
коагуляцією |
молока |
||
(утворення осаду). Катаболізм амінокислот може спричинити підлужнення середовища. Крім того, деякі бактерії можуть відновлювати метиленовий синій,
у результаті чого він стає |
безбарвним, |
середовище |
набуває кремового |
||||||||
кольору. |
|
|
|
|
|
|
|||||
|
|
Протеази |
|
Пептидази |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Білки |
Екзоферменти |
|
Пептиди |
Ендоферменти |
Амінокислоти |
|
||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
|
Безпосереднє |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Внутрішньоклітинні амінокислоти |
|
|
|||||
|
використання для |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
|
синтезу білків |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Декарбоксилювання |
|
Дезамінування і |
|
Трансамінування і |
|
|
розпад С-скелета |
|
розпад С-скелета |
Рис. 12.1. Розпад білків і можливі подальші перетворення амінокислот
Першою |
реакцією |
катаболізму |
амінокислот декарбоксилюванняє |
, |
|
|
дезамінування або трансамінування. В |
результаті |
дезамінування |
та |
|||
трансамінування амінокислоти перетворюються на відповідні кетокислоти. |
|
|
||||
Декарбоксилювання відбувається переважно у кислому середовищі. У |
|
|||||
результаті декарбоксилювання амінокислот утворюється СО2 |
і первинні аміни |
є |
||||
(які називаються також«біогенними» амінами). З них |
найвідомішими |
|||||
кадаверін, путресцин і агматин(раніше їх називали трупною отрутою); вони |
|
|||||
утворюються відповідно з лізіну, орнітину та аргініну. Первинні аміни |
|
|||||
виявляються при звичайних гнильних процесах у |
кишечнику та |
інши |
||||
анаеробних процесах розпаду білків. |
|
|
|
|
||
Для проведення тесту на реакцію декарбоксилювання амінокислот використовують поживне середовище, що містить глюкозу, поживний бульйон, індикатор рН та певну амінокислоту. Як індикатор рН зазвичай застосовують
95

бромкрезоловий пурпуровий. У кислому середовищі цей індикатор має жовте
забарвлення.У |
|
процесі |
декарбоксилювання відбувається |
підлужнення |
||||
середовища, про що свідчить зміна кольору індикатора на пурпуровий. |
|
|||||||
Під дезамінуванням розуміють відщеплення аміаку від амінокислоти. В |
||||||||
залежності |
від |
частки |
|
вуглецевого |
скелета |
амінокислоти |
розрізняю |
|
окиснювальне дезамінування, гідролітичне дезамінування та дезамінування, яке |
||||||||
супроводжується утворенням ненасичених сполук. |
|
|
|
|||||
У процесі |
деструкції |
сірковмісних |
амінокислот(цистеїн, |
метіонін) |
||||
виділяється сірководень, який можна виявити за утворенням забарвлених у чорний колір сульфідів заліза і свинцю. Для цього у культуральну рідину добавляють солі заліза чи свинцю, або насичену солями свинцю смужку фільтрувального паперу розміщують у пробірці над культуральною рідиною.
Для виявлення здатності деяких бактерій перетворювати триптофан на індол їх вирощують на збагаченому цією ароматичною амінокислотою середовищі Хоттінгера, а появу індолу визначають за допомогою індикарного папірця, насиченого щавлевою кислотою. За присутності індолу індикарний папірець набуває червоного кольору.
Завдання на виконання
1. Аналіз досліду з вивчення гідролізу крохмалю (лабораторна робота № 11). Розглянути чашки з картопляним агаром, на яких виросли культури
Bacillus subtilis, Escherichia coli, Pseudomonas aureofaciens, залити зони росту
культур розчином Люголя і спостерігати утворення прозорих(жовтих) зон |
|
||||||
навколо штриха. Якщо крохмаль не гідролізується, то середовище посиніє. |
|
||||||
Записати результати. |
|
|
|
|
|
|
|
2. Аналіз О/F-тесту (лабораторна робота № 11). Заповнити табл. 12.1. |
|
||||||
|
|
|
|
|
Таблиця 12.1 |
|
|
Назва культури |
Окиснювальний метаболізм |
Бродильний метаболізм |
|
|
|||
ріст |
кислота |
газ |
ріст |
кислота |
|
газ |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Аналіз досліду з вивчення субстратної специфічності(лабораторна
робота № 11). У |
процесі аналізу |
результатів |
записати |
наявність , росту |
|||||||
утворення кислоти та газу. Записати в табл. 12.2 результати досліду для всіх |
|||||||||||
культур. |
|
|
|
|
|
|
|
Таблиця 12.2 |
|||
|
|
|
|
|
|
|
|
|
|||
|
|
Джерело вуглецю у ферментаційному середовищі |
|
||||||||
Назва |
|
|
|
|
|
|
|
|
|
|
|
|
Глюкоза |
|
|
Лактоза |
|
Сахароза |
|
||||
культури |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ріст |
КислотаГаз |
|
Ріст |
Кислота |
|
Газ |
Ріст |
|
КислотаГаз |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
96
4. Аналіз MRVP-тесту (лабораторна робота №11). В одну пробірку з
Escherichia coli і в одну пробірку зEnterobacter cloaceae внести по 5 крапель розчину метиленового червоного. Записати результати тесту у табл. 12.3. Червоний колір – це (+) реакція на метиленовий(метиловий) червоний, що свідчить про накопичення кислоти. До двох інших пробірок додати по0,6 мл (12 крапель) розчину α-нафтолу і 0,2 мл (2–3 краплі) 40 %-ного розчину КОН.
Акуратно струсити пробірки, відкривши пробки, для контакту середовища з киснем повітря (для окиснення ацетоїну). Дати пробіркам постояти 15–30 хв.
За позитивної реакції Фогес–Проскауера в пробірці на поверхні середовища розвивається рожеве чи червоне забарвлення. Записати результати у табл. 12.3.
|
|
|
Таблиця 12.3 |
|
|
|
|
|
|
Назва культури |
|
Кінцеві продукти зброджування глюкози |
||
|
|
|
|
|
|
|
MR-тест (утворення |
VP-тест (утворення |
|
|
|
кислоти, реакція з |
ацетоїну, реакція Фогес- |
|
|
|
метиленовим червоним) |
Проскауера) |
|
|
|
|
|
|
|
|
|
|
|
5. Гідроліз |
желатини. Засіяти одну |
пробірку з м’ясо-пептонною |
||
желатиною Pseudomonas aureofaciens, а другу – Proteus vulgaris. Інкубувати при кімнатній температурі до наступного заняття.
6.Гідроліз казеїну. Засіяти одну пробіркуз молоком і метиленовим синім Pseudomonas aureofaciens, а другу – Proteus vulgaris. Інкубувати при 37 °С
упродовж 24–48 год.
7.Декарбоксилювання аргініну. Засіяти одну пробірку з аргініновим
бульйоном Enterobacter cloaceae, а другу – Proteus vulgaris. Залити обидві пробірки вазеліновою олією (товщина 5 мм). Інкубувати при 37 °С упродовж тижня. Спостерігати зміну кольору на першу, другу, третю та сьому добу.
8.Утворення сірководню. Засіяти одну пробірку з бульйоном Хоттінгера культурою Escherichia coli, а другу – Proteus vulgaris. Над поверхнею
середовища розмістити індикаторний папірець, затиснувши його пробкою. Інкубувати при 37 °С упродовж тижня.
9.Утворення індолу. Засіяти одну пробірку з бульйоном Хоттінгера культурою Escherichia coli, а другу – Enterobacter cloaceae. Над поверхнею
середовища розмістити індикаторний папірець, затиснувши його пробкою. Інкубувати при 37 °С упродовж тижня.
Контрольні запитання
1. Як відбувається катаболізм білків?
2. Охарактеризуйте можливі варіанти перетворення амінокислот у клітині.
97
3. Як відбувається декарбоксилювання амінокислот? Які тести використовуються для визначення здатності мікроорганізмів декарбоксилювати амінокислоти?
4. Що таке дезамінування амінокислот? Які типи дезамінування Ви знаєте?
5.Як можна визначити здатність мікроорганізмів гідролізувати желатину?
6.Як можна визначити здатність мікроорганізмів гідролізувати казеїн?
7.Для чого використовується тест на утворення сірководню та індолу?
Лабораторна робота № 13
ФІЗІОЛОГІЯ МІКРООРГАНІЗМІВ. НІТРАТРЕДУКЦІЯ ТА ДЕНІТРИФІКАЦІЯ (4 год)
Мета роботи: ознайомлення з особливостями аеробного та анаеробного дихання у бактерій, типами анаеробного дихання(нітратне, сульфатне та карбонатне дихання), опанування методів визначення каталазної та оксидазної активності мікробних клітин, виявлення здатності бактерій до денітрифікації.
Матеріали та обладнання: спиртівки, бактеріологічні петлі, пробірки з нітратним бульйоном, пробірки з напіврідким нітратним середовищем, термостат, фільтрувальний папір, скляні палички, розчин N,N-диметил- парафенілендиаміндигідрохлориду, 3 %-ний розчин перекису ,водню мікроорганізми (Escherichia coli, Pseudomonas aureofaciens, Bacillus megaterium).
|
|
|
|
Загальні відомості |
|
|
|
|
|||
|
Анаеробне |
дихання. |
У |
результаті |
фосфорилювання, спряженого |
з |
|
||||
перенесенням |
електронів |
у |
процесі |
дихання |
аеробних мікроорганізмів, |
||||||
утворюється набагато більше АТФ, ніж при субстратному фосфорилюванні, яке |
|
||||||||||
відбувається під час бродіння. Тому не дивно, що в процесі еволюції виник і |
|
||||||||||
зберігся такий тип метаболізму, у якому водень від органічного субстрату |
|
||||||||||
переноситься на “зв’язаний” |
кисень |
(нітрат, |
сульфат, карбонат та ін.); |
ці |
|
||||||
сполуки відновлюються воднем субстрату. Здатність переносити електрони на |
|
||||||||||
такі |
сполуки |
дає |
бактеріям |
змогу |
окиснювати |
субстрати |
без |
у |
|||
молекулярного кисню і одержувати більше енергії, ніж це можливо у процесі |
|
||||||||||
бродіння. |
|
|
|
|
|
|
|
|
|
|
|
|
Такі бактерії мають систему транспорту електронів, містять цитохроми. |
|
|||||||||
Одержання енергії фосфорилюванням, спряженим з перенесенням електронів |
|
||||||||||
на такі термінальні акцептори, як нітрат, сульфат тощо називають а н а е р о б - |
|
||||||||||
н и м |
д и х а н н я м. |
Залежно від природи неорганічного акцептора водню |
|
||||||||
розрізняють нітратне, сульфатне, карбонатне та інше дихання. |
|
|
|
||||||||
98
Денітрифікація та відновлення нітрату. |
Мікроорганізми |
викорис- |
||||
товують нітрат: 1) |
для синтезу |
азотвмісних |
клітинних |
компонентів. Така |
||
асиміляційна нітратредукція може відбуватися як в |
аеробних, так і |
в |
||||
анеробних умовах; 2) для нітратного дихання (дисиміляційна нітратредукція), |
||||||
при цьому нітрат |
в анаеробних |
умовах є |
термінальним |
акцептором |
водню |
|
(електронів). В обох цих випадках нітрат спочатку відновлюється до нітриту за |
|
|||||||||||||
допомогою нітратредуктази. |
|
|
|
|
|
|
|
|
|
|||||
Денітрифікуючі бактерії здатні відновлювати нітрат через нітрит до |
|
|||||||||||||
газоподібного закису азоту(N2O) та |
азоту (N2). Цей |
процес денітрифікації |
|
|||||||||||
виявлений тільки уфакультативних аеробів. Деякі денітрифікатори можуть |
|
|||||||||||||
рости, використовуючи як термінальний акцептор водню не тільки нітрат, а й |
|
|||||||||||||
нітрит, а також іноді й закис азоту. Представниками денітрифікуючих бактерій |
|
|||||||||||||
є грунтові бактерії, наприклад, бацили, |
Paracoccus denitrificans. |
|
|
|
|
|||||||||
Слід |
зазначити, що |
терміни |
нітратредукція, денітрифікація, нітратне |
|
||||||||||
дихання |
є |
синонімами. Проте |
часто у |
мікробіологічній |
|
практиці термін |
|
|||||||
«нітратредукція» використовують для характеристики процесу відновлення |
|
|||||||||||||
нітрату |
до |
нітриту, а термін «денітрифікація» – для |
утворення газоподібних |
|
||||||||||
продуктів нітратредукції. |
|
|
|
|
|
|
|
|
|
|
||||
Утворення |
сірководню |
у |
|
процесі |
|
відновлення . |
сул |
|||||||
Сульфатредукуючі |
(сульфатовідновлювальні) |
бактерії |
характеризуються |
|
||||||||||
здатністю |
до |
перенесення |
водню |
на сульфат як термінальний акцептор |
||||||||||
електронів і, таким чином, до відновлення сульфату до сульфіду. Цей процес |
|
|||||||||||||
називається |
с у л ь ф а т н и м |
д и х а н н я м, |
або д и с и м і л я ц і й н о ю |
|
||||||||||
с у л ь ф а т р е д у к ц і є ю. Основним продуктом цього процесу є сірководень. |
|
|||||||||||||
Більша |
частина |
сірководню, який |
є |
в |
природі, утворюється |
завдяки |
|
|||||||
життєдіяльності бактерій-сульфатредукторів. |
|
|
|
|
|
|
|
|||||||
Сульфатредукуючі бактерії – це фізіологічна група, для якої характерним |
|
|||||||||||||
є здатність до утворення сірководню з сульфату. Сульфатовідновлювальні |
|
|||||||||||||
бактерії, |
на |
відміну |
від |
нітратредукторів, є облігатними |
анаеробами. |
|
||||||||
Донорами водню служать прості низькомолекулярні сполуки, які утворюються |
|
|||||||||||||
при анаеробному розкладанні біомаси (в основному целюлози): лактат, ацетат, |
|
|||||||||||||
пропіонат, |
бутират, |
форміат, |
етанол, |
вищі |
|
жирні |
кислоти, |
молекулярний |
|
|||||
водень. За ступенем засвоєння органічних кислот розрізняють дві групи сульфатредукторів:
1)окиснюють донор не повністю та виділяють оцтову кислоту. Такими є представники спороутворювального родуDesulfotomaculum (наприклад, D. nigrificans) та неспороутворювального родуDesulfovibrio (D. vulgaris, D. desulfuricans). Ці бактерії не мають повного циклу трикарбонових кислот;
2)частина представників цієї групи може рости, використовуючи спирти, ацетат, вищі жирні кислоти або бензоат, тобто є хемоорганогетеротрофами, а інші здатні навіть до хемолітоавтотрофного росту у присутності водню та форміату. Деякі штами здатні синтезувати клітинні компоненти з ацетату, якщо
донором |
водню служить 2, Нтобто є хемолітогетеротрофами. До |
них |
|
належать |
спороутворювальні (Desulfotomaculum |
acetoxidans) |
та |
99
неспороутворювальні |
палички (Desulfobacter), коки (Desulfococcus), сарцини |
|
||||||||||||||
(Desulfosarcina), нитчасті форми, які рухаються ковзанням (Desulfonema), та ін. |
|
|||||||||||||||
Деякі сульфатредуктори можуть рости у |
присутності2 Нісульфату як |
|
||||||||||||||
єдиних джерел енергії. Здатність же до відновлення сульфату за допомогою |
|
|||||||||||||||
молекулярного водню і утворення при цьому великих кількостей сірководню, |
|
|||||||||||||||
не |
пов’язаного |
|
|
з |
помітним |
, ростомє характерною |
для |
більшості |
||||||||
сульфатредукторів. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Утворення |
|
|
метану |
у |
процесі |
відновлення |
карбонату. Метан |
|
||||||||
утворюється в результаті анаеробного розкладання органічних речовин. Його |
|
|||||||||||||||
запаси є досить значними. Розрахунки показують, що близько 1,5 % вуглецю, |
|
|||||||||||||||
який |
надходить |
|
в |
атмосферуу вигляді СОв2 |
результаті мінералізації |
|
||||||||||
органічних речовин, спочатку потрапляє туди у вигляді метану і тільки потім |
|
|||||||||||||||
під дією гідроксильних радикалів перетворюється на СО, а далі – на СО2. До |
|
|||||||||||||||
екосистем, у яких утворюється метан, належать тундри та болота(інша назва |
|
|||||||||||||||
метану – |
болотний |
|
газ), рисові поля, осади на дні озер і ставків, лимани, |
|
||||||||||||
відстійники очисних споруд, а також |
шлунки(рубці) жуйних |
тварин. |
В |
|
||||||||||||
анаеробних умовах органічні речовини спочатку зброджуються до ацетату, СО2 |
|
|||||||||||||||
та Н2. |
Ці |
продукти |
метаболізму |
використовуються метаноутворювальними |
|
|||||||||||
(метаногенними) бактеріями. |
|
|
|
|
|
|
|
|
|
|
||||||
За |
морфологією |
метаноутворювальні |
бактерії |
можна поділити |
на |
|||||||||||
паличкоподібні |
(Methanobacterium), |
кокоподібні |
(Methanococcus), |
|
||||||||||||
сарциноподібні (Methanosarcina), спірилоподібні (Methanospirillum). |
|
|
|
|
||||||||||||
Метаногени |
|
|
відрізняються |
від |
інших |
бактерій |
не |
тільки |
тип |
|||||||
метаболізму, а й за складом клітинних структур. У них немає типового |
|
|||||||||||||||
пептидогліканового |
|
скелета, |
тому |
|
пеніцилін |
не |
пригнічує |
.їх |
ріс |
|||||||
Цитоплазматична мембрана містить ліпіди, які складаються з ефірів гліцерину |
|
|||||||||||||||
та ізопреноїдних вуглеводнів. Рибосоми за своєю величиною подібні до таких у |
|
|||||||||||||||
еубактерій (70S), проте послідовність 16S |
рРНК зовсім інша, ніж у еубактерій. |
|
||||||||||||||
Механізм трансляції є нечутливим до дії антибіотиків, що пригнічують синтез |
|
|||||||||||||||
білка в еубактерій. Метаногени відносять до окремого царства архебактерій. |
|
|
||||||||||||||
Метаногени – строгі анаероби, кисень повітря їх вбиває. Тільки після |
|
|||||||||||||||
розробки методу Хангейта з’явилась |
можливість пересівати та виділяти ці |
|
||||||||||||||
бактерії. |
Більшість |
відомих метаногенів |
здатні |
використовувати |
2Няк донор |
|
||||||||||
водню, а деякі з них– також форміат, метанол, ацетат або метиламін. У ряді |
|
|||||||||||||||
анаеробних екосистем основним субстратом для утворення метану є ацетат. |
|
|
||||||||||||||
Метаногени тісно взаємодіють з бактеріями, які виділяють водень. Вони |
|
|||||||||||||||
здатні |
активувати |
|
водень |
і здійснювати |
йогоокиснення, спряжене |
з |
|
|||||||||
відновленням СО2. Клітинні речовини можуть синтезуватися з СО2 як єдиного |
|
|||||||||||||||
джерела вуглецю, тому спосіб існування цих бактерій можна розглядати як |
|
|||||||||||||||
хемолітоавтотрофний. |
Таким |
чином, |
для метаногенів |
СО2 |
є |
джерелом |
|
|||||||||
вуглецю та термінальним акцептором електронів, а Н2 |
є донором водню. |
|
||||||||||||||
Джерелом енергії є СО2 та Н2. При цьому утворюється метан: |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
4 Н2 + СО2 ® СН4 + 2 Н2О. |
|
|
|
|
|
|||||
Метаноутворення за аналогією з іншими видами дихання можна назвати
к а р б о н а т н и м д и х а н н я м.
100
У біохімічному перетворенні водню та вуглекислого газу на метан беруть участь ряд коферментів і простетичних груп, які виявлені тільки у метаногенів (метаноптерин, метанофуран, кофермент М, фактори F420 та F430). Автотрофна фіксація СО2 у метаногенів (як і у сульфатредукторів та ацетогенних анаеробів) відбувається через синтез ацетил-КоА та піруват.
Метан, який утворюється метаногенами, використовується як паливо (біогаз). У сільському господарстві використовують біогаз-ферментатори, також ями для перегною, щоб зброджувати для одержання метану екскременти тварин разом з відходами, що містять целюлозу.
Утворення ацетату у процесі відновлення карбонату. У різних місцях,
де утворюється метан, утворюється також оцтова кислота. Ацетогенні бактерії
здатні перетворювати СО2 та Н2 на ацетат згідно з рівнянням |
|
|
|
||||||
Ацетогенні |
4 Н2 + 2 СО2 ® СН3-СООН + 2 Н2О. |
thermoaceticum, |
|||||||
бактерії (Clostridium aceticum, |
|
Clostridium |
|||||||
Acetobacterium woodii) слід |
розглядати як |
|
анаеробні |
хемолітоавтотрофні |
|||||
організми, |
здатні |
окиснювати |
водень |
і |
одержувати |
енергію |
шляхо |
||
анаеробного |
карбонатного |
дихання. Синтез |
клітинного |
матеріалу з |
2СО |
||||
відбувається через ацетил-КоА та піруват (як у метаногенів).
Аеробне дихання. Тест на каталазу та оксидазу. Під час аеробного дихання у дихальному ланцюгові під час перенесення електронів від НАДН на кисень як термінальний акцептор електронів вивільнюється енергія, яка використовується для синтезу АТФ. За окисно-відновним потенціалом компоненти дихального ланцюга можна розмістити в ряд, який починається з НАДН (найбільш негативний потенціал) і закінчується цитохромоксидазою та киснем (найбільш позитивний потенціал). Наявність цитохромоксидази є
ідентифікаційною |
ознакою |
бактерій. Цитохромоксидаза (цитохром аа3) – |
термінальна оксидаза, яка реагує з киснем і передає йому чотири електрони: |
||
|
|
O2 + 4 Fe2+ ® 2O2- + 4 Fe3+. |
Кисень є кінцевим (термінальним) акцептором електронів при аеробному |
||
диханні і тому |
потрібен |
усім аеробним організмам. Ще з часів Л.Пастера |
відомо, що кисень є токсичним для анаеробів. Виявилося несподіваним, що кисень може спричиняти токсичну дію і на аеробні організми. Тому у більшості організмів є ферменти, здатні захищати клітину від токсичної дії похідних кисню, якими є перекис водню, супероксид- і гідроксид-радикали, синглетний кисень. Такими ферментами єкаталаза та пероксидаза, які розкладають перекис водню:
2Н2О2 ® 2Н2О + О2 (каталаза);
Н2О2 + 2GSH ® GSSG + 2Н2О (глутатіонпероксидаза).
Ферментом, що нейтралізує дію супероксид-радикалів, є супероксид-
дисмутаза:
2 О2¯ + 2 Н+ ® 2Н2О2 + О2.
101
Як видно з наведеної ,реакціїсупероксиддисмутаза перетворює супероксид-радикали на перекис водню, який далі розкладається за допомогою каталази чи пероксидази.
Завдання на виконання
1. Аналіз досліду з гідролізу желатини(лабораторна робота № 12). За позитивного результату (гідроліз желатини) спостерігається розрідження желатини (середовище стає рідким). Помістити пробірки в холодильник чи у лід на кілька хвилин. Якщо желатина залишається рідкою, результат є позитивним.
2. Аналіз досліду з гідролізу казеїну(лабораторна робота №12).
Описати зовнішній вигляд середовища з молоком. За негативної реакції середовище каламутне, а індикатор має голубий колір. Після пептонізації (гідролізу молочних білків) середовище стає прозорим за рахунок розщеплення казеїну до розчинних амінокислот і пептидів. Якщо відбувається зброджування молочного цукру – лактози, то рН середовища знижується, а велика кількість утворюваної кислоти може призводити до коагуляції молока (утворення осаду). За катаболізму амінокислот, утворених у результаті гідролізу казеїну, реакція середовища може змінюватись на лужну. Крім того, деякі бактерії можуть відновлювати метиленовий синій, в результаті чого він стає безбарвним, середовище – кремовим. Процес відновлення починається на дні пробірки.
3.Аналіз досліду з декарбоксилювання аргініну(лабораторна робота
№12). Описати зміну кольору середовища на першу, другу, третю та сьому добу. Результат вважається позитивним, якщо колір середовища зміниться з
сірого через жовте на червоно-фіолетове. Якщо середовище пожовкло, результат негативний.
4.Аналіз досліду з утворення сірководню (лабораторна робота № 12).
Почорніння нижньої частини індикаторного папірця свідчить про утворення сірководню (утворення сульфіду свинцю чорного кольору).
5.Аналіз досліду з утворення індолу (лабораторна робота № 12).
Почервоніння індикаторного папірця за присутності індолу вказує на позитивну реакцію.
6.Визначення нітратредукції. Засіяти нітратний бульйон культурами
Pseudomonas aureofaciens та Escherichia coli. Інкубувати упродовж 2–3 діб при
37 °С.
7. Визначення денітрифікації. Засіяти напіврідке нітратне середовище культурами Pseudomonas aureofaciens та Escherichia coli. Пробірки залити вазеліновою олією (товщина шару 5 мм). Інкубувати упродовж 7 діб при 37 °С.
8. Оксидазна активність. Біомасу культур Bacillus megaterium та
Pseudomonas aureofaciens нанести скляною паличкою на фільтрувальний папір, капнути на біомасу розчином N-N-диметилпарафенілендиаміндигідрохлориду. Реакція позитивна, якщо біомаса через кілька хвилин забарвиться у червоний колір.
102
9. Каталазна активність. Нанести біомасу Bacillus subtilis на предметне скло, капнути краплю 3 %-ного пероксиду водню. Інтенсивне виділення газу свідчить про наявність каталазної активності.
Контрольні запитання
1.Чим відрізняється аеробне дихання від анаеробного?
2.Як відбувається дисиміляційна нітратредукція?
3.Що означають терміни «нітратредукція» та «денітрифікація»?
4.Що таке сульфатне дихання?
5.Які особливості притаманні сульфатовідновлювальним бактеріям?
6.Охарактеризуйте метаногенні бактерії. Чому вони належать до архей?
5.Які бактерії здатні здійснювати карбонатне дихання?
6.Як відбувається фіксація вуглекислого газу у метаногенних бактерій?
7.Назвіть кінцеві продукти різних типів анаеробного дихання.
Лабораторна робота № 14
ФІЗІОЛОГІЯ МІКРООРГАНІЗМІВ (підсумкове заняття)
УЧАСТЬ МІКРООРГАНІЗМІВ У ПЕРЕТВОРЕННІ РЕЧОВИН ТА ЕНЕРГІЇ У ПРИРОДІ ( 4 год.)
Мета роботи: проаналізувати та зробити висновки про здатність досліджуваних бактерій здійснювати процеси нітратредукції та денітрифікації, узагальнити результати дослідів(лабораторні роботи №11−13) з вивчення фізіології мікроорганізмів і навчитись використовувати ці результати для ідентифікації бактерій, ознайомитись з участю мікроорганізмів у кругообігу вуглецю і сірки у природі, навчитись виділяти накопичувальні культури целюлозоруйнівних мікроорганізмів і готувати середовища для виділення накопичувальних культур денітрифікаторів.
Матеріали та обладнання: реактив Грісса, зразки грунту, чашки Петрі з стерильним фільтрувальним папером, пінцети, ножиці, спиртівки, ексикатор, компоненти для приготування середовища Гільтая(лимоннокислий калій чи натрій (цитрат тризаміщений); аспарагін; KNO3; KH2PO4; MgSO4·7H2O; CaCl2·2H2O; FeCl3·6H2O), ваги, чашки Петрі з середовищем Гетчинсона, колби конічні об’ємом 50 і 100 мл, циліндри, пробірки, автоклав, термостат.
Загальні відомості
Ідентифікація бактерій. Ідентифікація бактерій базується зазвичай на вивченні їхніх морфолого-культуральних і фізіолого-біохімічних . ознак Останнім часом з цією метою широко використовуються генетичні та молекулярно-біологічні методи (аналіз 16S р РНК, ДНК−ДНК-гібридизація та
103
ін.). З практичної точки зору важливо, щоб кількість тестів для ідентифікації було мінімальним, а самі тести максимально інформативні.
Техніка ідентифікації бактерій добре та доступно викладена у розд. I – V дев’ятого видання Визначника бактерій Бергі(далі – Визначник Бергі). Перше видання цього Визначника було опубліковано у1923 р. групою американських бактеріологів під керівництвом Д.Х.Бергі. При цьому слід мати на увазі, що починаючи з дев’ятого видання відбувся поділ цієї єдиної раніше праці на чотиритомну – Bergey’s Manual of Systematic Bacteriology (Керівництво Бергі з систематики бактерій) та коротку – Bergey’s Manual of Determinative Bacteriology (Керівництво Бергі з ідентифікації бактерій). Саме останню працю
було перекладено російською мовою у 1997 р. Вона називається “Визначник бактерій Бергі”, використовується для ідентифікації бактерій за фенотиповими ознаками і містить концентровану інформацію про всі види бактерій. Створене з практичною метою, це видання не претендує на еволюційну побудову.
Припустимо, що нам потрібно ідентифікувати виділений мікроорганізм. Загальний підхід до вирішення цього завдання складається з кількох основних етапів:
1)Визначник Бергі служить для ідентифікації бактерій. Тому необхідно бути переконаним, що виділений ізолят є прокаріотом. У розд. III наведено таблицю ознак, за якими прокаріоти відрізняються від еукаріот;
2)у Визначнику всі бактерії поділяються на чотири основні категорії (грамнегативні еубактерії, які мають клітинну стінку; грампозитивні бактерії,
які мають клітинну стінку; еубактерії, які не мають клітинної стінки; архебактерії). Ознаки, які дають можливість визначити ці категорії, наведені у розд. IV.
3)наступний крок після визначення основної категорії бактерій полягає в тому, щоб встановити розділ Визначника, в якому вона розглядається. У розд.
V наведено перелік груп всередині кожної основної категорії і короткий опис особливостей бактерій, які належать до кожної групи. Кожна з основних чотирьох категорій бактерій поділяється на групи: перша категорія складається
з16 груп бактерій (№ 1…16), друга – з 13 груп (№ 17…29), третя – з однієї групи (№ 30), четверта – з 5 груп (№ 31…35). Отже, у Визначнику бактерій описано 35 груп бактерій.
4)визначення роду бактерій. Для більшості груп наведено таблиці або ключі, де вказано ознаки, за якими можна диференціювати роди всередині групи;
5)визначення виду бактерій. У описі більшості родів містяться таблиці,
за допомогою яких можна диференціювати види всередині даного роду.
У роботі з ідентифікації мікроорганізмів необхідно дотримуватися таких загальних правил:
використовувати чисті культури; застосовувати для вивчення властивостей мікроорганізмів стандартні
методи; використовувати для інокуляції діагностичних середовищ культури в
активному фізіологічному стані.
104
|
Якщо визначені морфолого-культуральні |
і фізіолого-біохімічні ознаки |
|||
для |
досліджуваного штаму |
повністю збігаються з описаними для відомих |
|||
бактерій у Визначнику Бергі, детальніші молекулярно-біохімічні дослідження |
|||||
можна не проводити. |
|
|
|
|
|
|
Морфолого-культуральні |
ознаки – |
це |
морфологія клітини(коки, |
|
палички, спірили, розміщення |
клітин – поодиноко чи |
в агрегатах), наявність |
|||
ендоспор, капсули, джгутиків, їх розміщення, забарвлення за Грамом, а також |
|||||
характер росту на агаризованих (характеристика колоній) та в рідких поживних |
|||||
середовищах. |
|
|
|
|
|
|
Фізіолого-біохімічні (або |
фізіологічні) |
ознаки – |
відношення до кисню, |
|
яким |
чином одержують енергію, залежність |
росту |
від температури, рН, |
||
асиміляція різних поживних речовин (джерела вуглецю, азоту та ін.), потреба в додаткових факторах росту, відношення до антибіотиків тощо.
Дослідження фізіологічних ознак у процесі ідентифікації насамперед
передбачає |
визначення |
типу |
живлення(фототрофія, |
хемоавтотрофія, |
|
||||||||
хемогетеротрофія), типу метаболізму (окислювальний, бродильний), потім |
− |
|
|||||||||||
визначення |
здатності |
мікроорганізмів |
використовувати |
певні |
|
вуглеводи, |
|||||||
цукроспирти, |
органічні |
кислоти, |
відношення |
до |
|
кисню, визначення |
|
||||||
ферментативної |
активності (тести |
на |
каталазу |
і |
|
оксидазу, утворення |
|
||||||
сірководню, індолу, відновлення нітратів тощо). |
|
|
|
|
|
|
|
||||||
Участь мікроорганізмів у кругообігу речовину природі. За своєю |
|
||||||||||||
роллю та функцією у балансі природи живі організми |
|
поділяються |
на |
три |
|||||||||
групи. Зелені |
|
рослини синтезують органічні речовини, використовуючи |
|
||||||||||
енергію сонця та вуглекислоту, тому їх називаютьпродуцентами. Тварини є |
|
||||||||||||
споживачами |
(консументами); вони витрачають значну частину первинної |
||||||||||||
біомаси для побудови свого тіла. Рештки рослин і тварин кінець кінцем |
|||||||||||||
піддаються |
|
розкладанню, в |
|
результаті |
якого |
|
органічні |
речовин |
|||||
перетворюються |
на мінеральні, |
неорганічні сполуки. Цей процес називається |
|
||||||||||
м і н е р а л і з а ц і є ю, його здійснюють у першу чергу гриби та бактерії, у |
|
||||||||||||
балансі природи вони служать деструкторами. |
|
|
|
|
|
|
|
|
|||||
Мікроорганізми |
беруть |
активну |
участь |
у |
|
біогеохімічних |
цикла |
||||||
перетворення |
|
речовин |
у |
біосфері. Глобальне |
значення |
має |
діяльність |
||||||
мікроорганізмів у циклах вуглецю, азоту та сірки. |
|
|
|
|
|
|
|
||||||
Кругообіг вуглецю. У кругообігу вуглецю мікроорганізми забезпечують |
|
||||||||||||
мінералізацію вуглецю, переведеного зеленими рослинами в органічні сполуки, |
|
||||||||||||
підтримуючи |
тим самим досить нестійку рівновагу. Атмосферне |
повітря |
|
||||||||||
містить трохи більше 0,03 % вуглецю. Фотосинтетична продуктивність зелених |
|
||||||||||||
рослин є настільки великою, що запаси СО2 |
в атмосфері були б вичерпані |
|
|||||||||||
приблизно за 20 років. Зеленим |
рослинам довелося б припинити фіксацію СО2, |
|
|||||||||||
якби нижчі тварини та мікроорганізми не забезпечували повернення цього газу в атмосферу завдяки безперервніймінералізації органічного матеріалу. У
загальному балансі речовин у природі грунтові бактерії і гриби відіграють не менш значну роль, ніж фотосинтезувальні зелені рослини. Взаємозв’язок усіх живих істот на Землі найчіткіше відображається у кругообігу вуглецю.
105
Першими деструкторами природних полімерів(білки, нуклеїнові кислоти, геміцелюлоза, пектин, крохмаль, целюлоза, лігнін та ін.) можуть бути лише ті мікроорганізми, які синтезують гідролітичні ферменти. В аеробній зоні до таких мікроорганізмів належать гриби ,і головнимдеякі чином, грампозитивні бактерії, у тому числі й актиноміцети. В анаеробній зоні − це тільки бактерії, в основному з групи клостридій. В аеробній зоні відбувається
практично повне перетворення полімерів з вивільненням СО. В анаеробних
2
умовах у процесі первинного розкладання органічних речовин утворюються жирні кислоти, спирти і молекулярний водень, які частково використовуються
вторинними |
анаеробами, |
наприклад, |
сульфатовідновлювальними |
і |
|||
денітрифікуючими |
бактеріями |
як |
джерела |
вуглецю |
за |
відновл |
|
неорганічних акцепторів електронів або метаноутворювальними бактеріями у процесі карбонатного дихання.
Тому однією особливістю процесу мінералізації є надходження невеликої частини мінералізованого вуглецю (1–1,5 %) в атмосферу не у вигляді СО2, а в формі метану (СН4). Цей газ утворюється з органічних речовин у місцях, недоступних для кисню(у грунтах тундр, на рисових полях, у рубці жуйних тварин).
Найпоширенішою вуглецевою сполукою у природі є целюлоза. Целюлоза
становить від 15 до 60 % маси рослин, у бавовнику |
і льоні вміст целюлози |
|||
досягає 80−95 %. |
|
|
|
|
Розкладання целюлози мікроорганізмами є наймасштабнішим природним |
||||
деструкційним |
процесом, ланкою |
кругообігу |
вуглецю, що |
забезпечує |
повернення фіксованого у процесі фотосинтезу вуглецю в атмосферу у вигляді СО2.
Глобальна роль мікроорганізмів у цьому процесі визначається тим, що ні
тварини, ні |
рослини |
не |
здатні |
розкладати |
целюлозу. Трансформація |
целюлозовмісних сполук |
у |
природі |
відбувається |
як в аеробних, так і в |
|
анаеробних |
умовах, при різних |
температурах і рН середовища. Розкладання |
|||
целюлози у природі − це складний комплексний процес, що відбувається за участю спільноти мікроорганізмів, до складу якої входять целюлозоруйнівні
мікроорганізми, |
а |
також |
мікроорганізми-супутники, які |
використовують |
|||
продукти розпаду. |
|
|
|
|
|
||
В анаеробних умовах розкладання целюлози здійснюється анаеробними |
|||||||
бактеріями |
роду Clostridium. |
При |
цьому |
утворюється |
велика кількість |
||
органічних кислот (оцтова, бурштинова, молочна, масляна, мурашина), етанол, |
|||||||
вуглекислий |
газ |
та |
водень. В |
анаеробних |
умовах глюкоза |
зброджується в |
|
основному за типом маслянокислого бродіння.
На відміну від анаеробного розкладання целюлози, здійснюваного тільки |
|||
бактеріями, в аеробних умовах клітковину розкладають гриби і бактерії, у тому |
|||
числі міксобактерії і актиноміцети. |
|
||
У кислих |
лісових |
грунтах основна роль у перетворенні целюлози |
|
належить базидіальним грибам і представникам родівTrichoderma, |
Aspergillus, |
||
Penicillium. У |
грунтах |
під трав’янистою рослинністю, степових |
і лугових |
106
ландшафтах у розкладанні целюлози крім грибів беруть участьміксобактерії, актиноміцети, вібріони роду Cellovibrio.
Розкладання целюлози здійснюється комплексом целюлозолітичних ферментів:
1) екзоцелюлаз, що гідролізують нерозчинні целюлозні субстрати з невпорядкованим розривом b-1,4-зв’язків у молекулі целюлози;
2) ендоцелюлаз, що гідролізують розчинні целюлозні субстрати з розривом b-1,4-зв’язків у будь-якому місці полімерного ланцюга;
3)b-глюкозидаз, целобіаз, що гідролізують целобіозу та іншіb- глюкозиди;
4)b-глюкозилтрансфераз.
Кругообіг |
сірки. У |
живих |
клітинах |
сіркапредставлена |
сульфогідрильними |
групами |
у складі |
сірковмісних |
амінокислот(метіонін, |
цистеїн, гомоцистеїн), вітамінів, ферментів. У сухій речовині організмів частка сірки становить 1 %.
У природі сірка піддається різноманітним хімічним і біологічним перетворенням і переходить з неорганічних сполук в органічні і навпаки. У процесі розкладання залишків тварин, рослин, мікроорганізмів вивільнюються сірковмісні амінокислоти, тіоспирти, тіофеноли, тіоефіри, гетероциклічні сполуки, у складі яких сірка перебуває у відновленому стані.
У циклі перетворення сірки беруть участь різноманітні групи бактерій
(рис. 14.1).
Ваеробних умовах окислювальні процеси сірки та її відновлених
неорганічних і органічних сполук здійснюють хемоавтотрофні прокаріоти (сіркові, тіонові бактерії), а також деякі типові гетеротрофні бактерії родів
Bacillus, Pseudomonas та ін.
Ванаеробних процесах беруть участь фототрофні сіркові пурпурові
ізелені бактерії, які здійснюють аноксигенний фотосинтез.
Під час асиміляції сульфатів як джерела сірки відбувається відновлення сірки у процесах конструктивного метаболізму− асиміляційна сульфатредукція.
Ванаеробних умовах сульфати відновлюються до сірковод
вузькоспеціалізованою |
групою |
сульфатредукуючих |
бактерій |
у |
процесі |
||||
анаеробного сульфатного дихання. |
|
|
|
|
|
|
|||
|
Відновлення SO32- |
і S2O32- |
до S0 |
здійснюють |
облігатно |
анаеробні |
|||
термофільні бактерії роду Clostridium. У відновленні молекулярної сірки до H2S |
|
||||||||
беруть участь багато які термоацидофільні строго анаеробні архебактерії. |
|
|
|||||||
|
У процесі розкладання білкових речовин (зазвичай цей процес називають |
|
|||||||
гниттям) виділяється |
сірководень |
та |
інші леткі сполуки з неприємним |
||||||
запахом. Гнильні мікроорганізми − це аеробні і анаеробні представники родів |
|||||||||
Bacillus і Clostridium відповідно. Процеси відновлювальних ланок циклу сірки |
|
||||||||
тісно |
спряжені |
з |
окиснювальними, і |
часто |
сульфатредукуючі |
бактерії |
|||
107

розвиваються у місцях існування, де мешкають сіркові бактерії, які окиснюють сірководень, що поступає з анаеробної зони.
|
Молекулярна |
|
|
|
SO32-, S2O32- |
||
|
сірка |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
7 |
3 |
|
|||
|
|
|
|
5 |
|
|
|
|
S2- |
|
|
|
SO42- |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
6 |
4 |
Органічні сполуки сірки
Рис. 14.1. Цикл перетворення сірки:
− окислювальні процеси;  − процеси без зміни валентності сірки;
− процеси без зміни валентності сірки;  - відновлювальні процеси.
- відновлювальні процеси.
Збудники процесів : 1 − безбарвні сіркобактерії, тіонові (в аеробних умовах) і фототрофні сіркобактерії (в анаеробних умовах); 2, 3 − тіонові бактерії, архебактерії; 4 − всі мікроорганізми і рослини(асиміляція); 5 − сульфатредукуючі бактерії; 6 − термоацидофільні анаеробні бактерії; 7 − облігатно анаеробні термофільні клостридії.
|
|
Завдання на виконання |
|
|
|
|
||
1. |
Аналіз досліду з визначення нітрат редукції (лабораторна робота № |
|
||||||
13). Додати у пробірки з нітратним |
бульйоном |
кілька |
кристалів |
реактиву |
|
|||
Грісса. Почервоніння середовища свідчить про появу нітриту, що утворився в |
|
|||||||
результаті відновлення нітрату. |
|
|
|
|
|
|
||
2. |
Аналіз досліду з визначення денітрифікації (лабораторна робота № |
|
||||||
13). Розглянути пробірки з напіврідким нітратним середовищем. Поява розривів |
|
|||||||
агару |
свідчить |
про |
утворення |
газоподібних |
, продуктівтобто |
про |
|
|
денітрифікацію. |
|
|
|
|
|
|
|
|
3. |
Заповнити підсумкову табл. 14.1 результатів з вивчення фізіолого- |
|
||||||
біохімічних ознак бактерій. |
|
|
|
|
|
|
||
4. |
Із |
зразків |
грунту |
одержати |
накопичувальну |
ку |
||
целюлозоруйнівних аеробних мікроорганізмів. |
|
|
|
|
||||
Для одержання целюлозоруйнівних |
аеробних |
бактерій використовують |
|
|||||
агаризоване середовище Гетчинсона (г/л): NaNO3 − 2,5; KH2PO4 − 0,1; NaCl − 0,1; CaCl2·2H2O − 0,1; MgSO4·7H2O − 0,3; FeCl3·6H2O − 0,001, агар-агар −2 %.
108
Середовище |
розливають |
у чашки .ПетріНа поверхню чашок кладуть |
попередньо простерилізований фільтрувальний папір, вирізаний за розміром |
||
чашки. За |
допомогою |
пінцета на поверхні фільтра розкладають рядами |
шматочки грунту на відстані 1 см один від одного. Засіяні чашки розміщують в ексикаторі над водою і ставлять в термостат(25−30 °С). Тривалість інкубації
7–14 днів.
5. Приготувати середовище Гільтая для одержання накопичувальної
культури денітрифікуючих бактерій. |
Розчин 1 (г/ 25 мл дистильованої води): |
||||
KNO3 |
− 0,2; KH2PO4 – 0,2; аспарагін – 0,1. Розчин 2 (г/ 5 мл дистильованої |
||||
води): |
лимоннокислий |
калій чи |
натрій(цитрат |
тризаміщений) – |
0,5; |
MgSO4·7H2O – 0,2; CaCl2·2H2O – 0,02; FeCl3·6H2O |
– сліди. Розчини |
1 і 2 |
|||
зливають, доводять об’єм до 100 мл дистильованою водою. рН середовища – 7,0. Середовище розливають високим шаром у пробірки і стерилізують при0,5 атм упродовж 20 хв.
Контрольні запитання
1.Як Ви розумієте поняття «ідентифікація бактерій»?
2.На дослідженні яких ознак базується ідентифікація бактерій?
3.Охарактеризуйте морфолого-культуральні і фізіолого-біохімічні ознаки мікроорганізмів.
4.Як визначається тип метаболізму мікроорганізмів(окиснювальний, бродильний) ?
5.Як визначається відношення мікроорганізмів до кисню?
6.Як визначається здатність мікроорганізмів до синтезу гідролітичних ферментів, здатних розщеплювати різні полімери?
7.Охарактеризуйте тест на каталазу і оксидазу.
8.Які фізіологічні ознаки, досліджувані Вами у ході виконання лабораторних робіт, можуть бути використані для ідентифікації бактерій?
9. Яких |
правил |
необхідно |
дотримуватися |
під |
час |
ідентифікаці |
мікроорганізмів? |
|
|
|
|
|
|
10.Охарактеризуйте основні етапи ідентифікації згідно Визначника Бергі
зідентифікації бактерій.
11.На які групи поділяються організми за роллю і функцією у природі?
12.Яку роль відіграють мікроорганізми у кругообігу вуглецю?
13.Які фізіологічні групи бактерій беруть участь у кругообігу вуглецю?
14.Охарактеризуйте целюлозоруйнівні мікроорганізми.
15.Які ферменти необхідні для розщеплення целюлози?
17.Які фізіологічні групи бактерій беруть участь у кругообігу сірки?
18.Як здійснюється виділення накопичувальної культури аеробних целюлозоруйнівних мікроорганізмів?
109
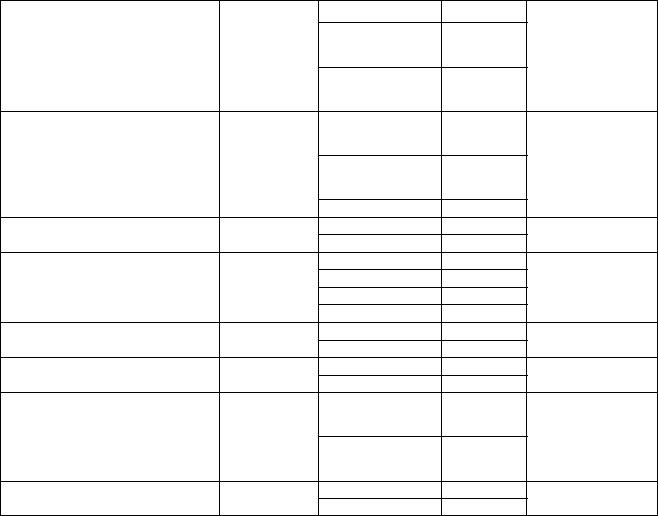
Таблиця 14.1 Фізіологія мікроорганізмів (підсумкова таблиця результатів)
|
Властивість, |
Культури |
Результат |
За якою реакцією |
|
Назва тесту |
яку цей тест |
діагностується |
|||
мікроорганізмів |
тесту |
||||
|
визначає |
результат тесту |
|||
|
|
|
|||
|
|
|
|
|
|
Гідроліз крохмалю |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Тип метаболізму |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Глюкоза |
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Субстратна специфічність |
Лактоза |
|
|
|
|
|
|
|
|||
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Сахароза |
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Кінцеві продукти зброджування |
MR |
|
|
|
|
|
|
|
|||
|
|
|
|
||
глюкози |
VP |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Гідроліз желатини |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Пептонізація молока (гідроліз |
|
|
|
|
|
казеїну) |
|
|
|
|
|
|
|
|
|
|
|
Зброджування лактози в молоці |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Коагуляція молока |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Катаболізм амінокислот у |
|
|
|
|
|
молоці |
|
|
|
|
|
|
|
|
|
|
|
Накопичення відновлених |
|
|
|
|
|
|
|
|
|
|
110
продуктів у молоці
Декарбоксилювання
амінокислот
Утворення сірководню
Утворення індолу
Нітратредукція
Денітрифікація
Наявність цитохромоксидази
Наявність каталази
111
