
- •ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
- •КИЇВ НУХТ 2010
- •Лабораторна робота № 3
- •Лабораторна робота № 4
- •Лабораторна робота № 5
- •Таблиця 5.1
- •Кількісний облік мікроорганізмів
- •Лабораторна робота № 6
- •Лабораторна робота № 7
- •Лабораторна робота № 9
- •Лабораторна робота № 11
- •Лабораторна робота № 15
- •Нітрифікуючі бактерії
- •Nitrosomonas europaea
- •Nitrobacter winogradskyi
- •Nitrobacter winogradskyi
- •Характеристика накопичувальних культур мікроорганізмів
- •ЛІТЕРАТУРА
- •ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
- •ЛАБОРАТОРНИЙ ПРАКТИКУМ
6.Чим відрізняються між собою такі показники як концентрація бактерій
ібіомаса?
7.Які існують методи визначення концентрації бактерій?
8.Які методи визначення біомаси Ви знаєте?
9.Що таке періодична культура?
10.Охарактеризуйте фази росту періодичної культури?
11.Чим зумовлене настання стаціонарної фази росту?
Лабораторна робота № 9
РІСТ МІКРООРГАНІЗМІВ У ПЕРІОДИЧНІЙ КУЛЬТУРІ. ВПЛИВ УМОВ КУЛЬТИВУВАННЯ НА ПОКАЗНИКИ РОСТУ МІКРООРГАНІЗМІВ
(закінчення) (4 год.)
Мета роботи: оцінка впливу умов культивування (концентрація джерел вуглецю, азоту, фосфору, концентрація інокуляту тощо) на показники мікроорганізмів у періодичній культурі, побудова кривої росту мікроорганізмів і визначення параметрів кривої росту.
Матеріали та обладнання: спиртівки, бактеріологічні петлі, предметні і накривні скельця, чашки Петрі з агаризованим середовищем(ГКА або СА), мікроскопи, досліджувані культури мікроорганізмів, фотоелектроколориметр, кювети (5 мм).
Загальні відомості
Параметри кривої росту. Основними параметрами кривої росту(рис. 9.1) є біомаса, швидкість росту та тривалість лаг-фази(у разі, якщо ріст періодичної культури аналізують за збільшенням біомаси, не за кількістю клітин).
Біомаса – це різниця між максимальною та вихідною біомасою бактерій:
Х = Хмакс. – Х0. |
(9.1) |
Цю величину виражають у грамах сухої речовини. Важливим показником є відношення врожаю клітин до кількості спожитого субстрату– Х/S. Якщо ці
дві величини виражені у вагових одиницях, то відношення Х/S |
називають |
е к о н о м і ч н и м к о є ф і ц і є н т о м (Y). Якщо врожай у грамах відноситься |
|
до кількості молей спожитого субстрату, то одержану величину |
називають |
м о л я р н и м е к о н о м і ч н и м к о е ф і ц і є н т о м.
Швидкість експоненційного росту – це міра швидкості росту клітин в експоненційній фазі. Її визначають за формулою виходячи з початкової та кінцевої біомаси Х0 та Хt у моменти часу t0 та t:
75
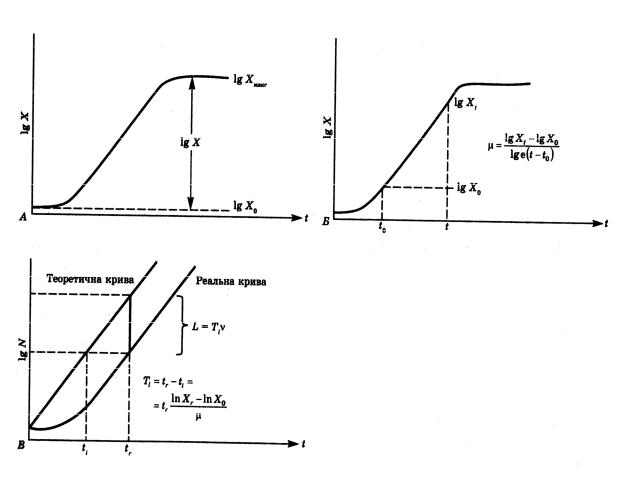
Рис. 9.1. Параметри кривої росту:
А – урожай клітин (біомаса); Б – швидкість росту; В – тривалість лаг-фази
m = |
lg Xt – lg X0 |
ln Xt – ln X0 |
|
----------------- = ------------------ |
, |
(9.2) |
|
де lg e = 0,43429. |
lg e (t – t0) |
t – t0 |
|
|
|
|
|
Тривалість подвоєння визначається за формулою: |
|
||
|
td = ln 2 / m. |
і td = g. |
(9.3) |
Для «стандартних» клітин m = ln 2 n |
|
||
Тривалість лаг-фази (Тl) – визначають як проміжок часу між моментом tr, в який культура досягла певної біомаси Хr, і моментом tі, в який вона могла б
досягти такої самої біомаси, якби відразу ж після інокуляції починався експоненційний ріст.
Ріст у безперервній культурі. Метод безперервного культивування полягає в тому, що в посудину (ферментатор, культиватор), в якій вирощуються бактерії, весь час надходить свіже поживне середовище і одночасно з такою самою швидкістю відводиться культуральна рідина, яка вміщує бактеріальні
клітини |
та продукти метаболізму. За такого культивування |
можна якоюсь |
|
мірою |
наблизитись до |
ідеальної ситуації, коли клітини |
тривалий час |
76
перебувають у фазі експоненційного росту за постійної концентрації субстрату та інших незмінних умов. Розглянемо безперервне культивування в режимі хемостату та турбідостату.
Ріст у хемостаті. У цьому режимі ріст бактерій контролюється концентрацією субстрату. Підтримуючи постійну концентрацію одного з необхідних субстратів (джерело азоту чи вуглецю) регулюванням швидкості протоку середовища (швидкості надходження поживного середовища), можна
стабілізувати |
ріст |
культури. Основним |
показником |
безперервного |
культивування є швидкість розбавлення середовища D: |
|
|||
|
|
D = f / V, |
|
(9.4) |
де f – швидкість протоку (швидкість надходження поживного середовища в л за 1 год), V – об’єм культиватора, л.
Отже, величина D відображує об’єм рідини, який змінюється за 1 годину. Швидкість зміни біомаси в культиваторі dХ/dt визначається за рівнянням
dХ/dt = mХ – DХ= Х (m - D), |
(9.5) |
де mх – приріст біомаси, Dx – втрати в результаті вимивання клітин. |
|
Якщо швидкість ростуm і швидкість розбавлення |
середовищаD є |
однаковими, то втрати в результаті вимивання клітин і приріст біомаси врівноважують одне одного, тобто зміна дорівнює нулю і біомасаХ залишається постійною. Культура при цьому перебуває в стані динамічної рівноваги.
Ріст культури в хемостаті контролюється концентрацією субстрату. На
такому обмеженні швидкості росту |
концентрацією одного з необхідних |
субстратів (лімітувальний фактор) грунтується стабільність системи. |
|
Ріст у турбідостаті. Принцип |
роботи турбідостату грунтується на |
регулюванні швидкості протоку середовища густиною(мутністю) популяції. Датчик мутності регулює через керуючу систему надходження поживного середовища. Турбідостатний контроль може грунтуватися на інших методах вимірювання біомаси або продуктів, які утворюються в процесі їхнього росту. Наприклад, рН–статний спосіб керування швидкістю протоку, використання оксистату – управління швидкістю протоку за швидкостю споживання кисню.
Принципові відмінності між періодичною та безперервн культурами:
Періодичну культуру можна розглядати як замкнуту систему(якоюсь мірою подібну до багатоклітинного організму), яка в своєму розвитку проходить кілька фаз (лаг-фаза, експоненційна та ін.). Умови існування у всіх цих фазах різні. Автоматичне регулювання в періодичній культурі навряд чи можливе.
Безперервна культура – це відкрита система, яка намагається досягти динамічної рівноваги. Фактор часу певною мірою виключається. Для організмів створюються незмінні умови середовища. Легко піддається автоматичному регулюванню.
77
Завдання на виконання
1.Аналіз посівів перевірки стерильності поживних середовищ
(лабораторна робота № 8).
2.Мікробіологічний контроль посівів(лабораторна робота №8).
Здійснюється шляхом мікроскопії(препарати «роздавлена крапля»), а також розсівом на чашки Петрі з агаризованим середовищем(ГКА, або СА) до ізольованих колоній.
3.Аналіз посівів з дослідження впливу умов культивування на
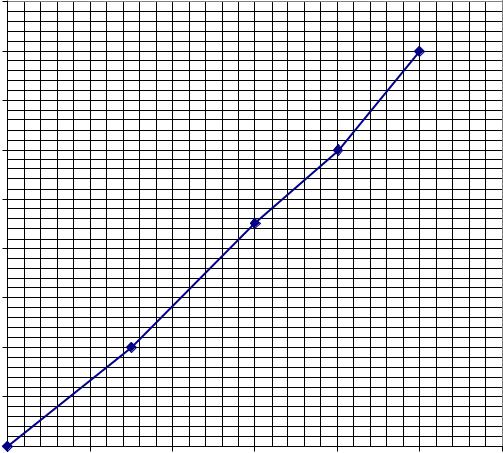
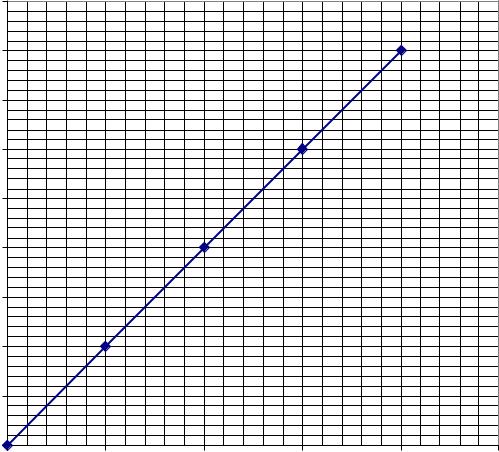
показники росту мікроорганізмів у періодичній культурі(лабораторна робота № 8). Ріст мікроорганізмів оцінюють за оптичною густиною клітинної суспензії (ФЕК, 540 нм, довжина світлового шляху5 мм). За одержаними даними побудувати графік – криву росту (калібрувальні графіки перерахунку оптичної густини клітинної суспензії на біомасунаведено на рис. 9.2. і 9.3). Визначити тривалість лаг-фази, питому швидкість росту в експоненційній фазі росту, рівень біомаси, вихід біомаси від заданого субстрату. Одержані дані оформити у вигляді табл. 9.1. Узагальнити результати дослідів, одержаних іншими студентами за іншими варіантами. Скласти загальну таблицю. Зробити загальні висновки.
|
|
|
|
Таблиця 9.1 |
|
|
|
|
|
|
|
Варіанти |
|
Параметри росту |
Морфологія |
||
|
|
|
|
клітин |
|
|
Тривалість |
Максимальна |
Вихід біомаси |
||
|
|
|
|||
|
лаг-фази |
питома |
від заданого |
|
|
|
|
швидкість росту |
субстрату (Y), |
|
|
|
|
(μ), год.-1 |
% |
|
|
1. |
|
|
|
|
|
2. |
|
|
|
|
|
3. |
|
|
|
|
|
і т.д. |
|
|
|
|
|
|
|
|
|
|
|
Контрольні запитання
1.Охарактеризуйте параметри кривої росту.
2.Як визначається рівень біомаси?
3.Як можна розрахувати економічний коефіцієнт?
4.Як визначається тривалість лаг-фази?
5. |
Які |
способи |
скорочення |
тривалості |
лаг-фази |
Ви |
мо |
запропонувати? |
|
|
|
|
|
|
|
6. Як визначається питома швидкість росту? |
|
|
|
||||
7. |
Які |
особливості |
притаманні |
безперервному |
культивуванню |
||
мікроорганізмів?
78
8.Охарактеризуйте культивування у режимі хемостату.
9.Охарактеризуйте культивування у режимі турбідостату.
10.Назвіть принципові відмінності між періодичною табезперервною культурами.
|
0,9 |
|
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
|
0,7 |
|
|
|
|
|
|
густина |
0,6 |
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оптична |
0,4 |
|
|
|
|
|
|
0,3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
|
|
|
|
Біомаса, г/л |
|
|
|
|
|
Рис. 9.2. Калібрувальний графік для визначення біомаси |
|
||||
|
|
дріжджів за оптичною густиною клітинної суспензії |
|
|
|||
79
|
0,9 |
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
0,7 |
|
|
|
|
|
густина |
0,6 |
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Оптична |
0,4 |
|
|
|
|
|
0,3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
|
|
|
Біомаса, г/л |
|
|
|
|
|
Рис. 9.3. Калібрувальний графік для визначення біомаси бактерій |
||||
|
за оптичною густиною клітинної суспензії |
|
|
|||
Лабораторна робота № 10
МІКРОБІОЛОГІЧНИЙ КОНТРОЛЬ СИРОВИНИ, ВИКОРИСТОВУВАНОЇ У БІОТЕХНОЛОГІЧНІЙ І ХАРЧОВІЙ ПРОМИСЛОВОСТІ, А ТАКОЖ БІОТЕХНОЛОГІЧНОЇ І ХАРЧОВОЇ ПРОДУКЦІЇ (4 год)
Мета |
роботи: опанування |
мікробіологічних |
методів |
санітарно- |
гігієнічного контролю виробничих процесів, виявлення мезофільних аеробних і |
||||
факультативно |
анаеробних мікроорганізмів(показник |
МАФАМ), |
бактерій |
|
групи кишкової палички (показник БГКП), а також грибів і дріжджів у різних видах води, сировини, біотехнологічної та харчової продукції.
80
Матеріали та обладнання: спиртівки, колби і пробірки з стерильною водопровідною водою, стерильні піпетки, шпателі Дригальського, чашки Петрі з МПА, з середовищем ЕНДО, Чистовича (або середовищем №10) і суслоагаром, рідке капустяне середовище (капустяна вода), зразки біотехнологічної та харчової продукції(сухі та пресовані хлібопекарські дріжджі, кефір або сметана, пиво або вино тощо), зразки сировини (меляса, борошно, солод тощо), зразки води (річкова, водопровідна, артезіанська, колодязна, акваріумна), термостат.
Загальні відомості
Однією з умов одержання доброякісної харчової та біотехнологічної продукції є дотримання санітарно-гігієнічних вимог у процесі виробництва. З метою виявлення та попередження контамінації сторонньою мікрофлорою на всіх підприємствах харчової та біотехнологічної галузі проводиться строгий мікробіологічний контроль сировини та готової продукції.
На харчових підприємствах можуть бути як зовнішні, так і внутрішні джерела контамінації. До зовнішніх належать сировина, вода і повітря. До
внутрішніх – |
повітря |
виробничих |
приміщень, виробничі |
культури |
|
мікроорганізмів, |
технологічне |
обладнання, |
тара, руки, одяг |
персоналу. |
|
Сторонні мікроорганізми, потрапивши у виробничий процес, за сприятливих умов швидко розмножуються, і якщо не застосувати відповідні заходи для їх знищення, розповсюджуються по всьому підприємству. У результаті життєдіяльності мікроорганізмів порушується технологічний процес, зростають втрати сировини, знижується вихід та якість готової продукції.
Мікроорганізми, які потрапляють у виробництво, можуть бути як нешкідливими для здоров’я людини, так і призводити до тяжких інфекційних захворювань та харчових отруєнь. Тому важливим є визначення санітарнопоказових мікроорганізмів, у першу чергу, в сировині та готовій продукції.
Мікрофлора харчових продуктів являє собою складну динамічну систему,
пов’язану |
з |
зовнішнім середовищем. Це значно ускладнює способи її |
||||||
дослідження і трактування одержаних результатів. Для оцінки якості харчових |
||||||||
продуктів, |
а |
також |
умов |
їх |
виробництва |
та |
зберігання |
користуютьс |
кількісними і якісними мікробіологічними показниками. |
|
|
|
|||||
Кількісні |
показники вказують загальну кількість мікроорганізмів у1 г (1 |
|||||||
см3) продукту. Основним кількісним тестом є кількість живих мезофільних аеробних і факультативно-анаеробних мікроорганізмів у1 г (1 см3) продукту – число МАФАМ. Для більшості продуктів цей показник нормується. Чим вище число МАФАМ, тим більша імовірність потрапляння в досліджуваний об’єкт патогенних мікроорганізмів – збудників інфекційних захворювань та харчових отруєнь.
Стійкість харчових продуктів під час зберігання оцінюють також за кількістю міцеліальних грибів, дріжджів і специфічних для кожного виду продукції збудників псування.
81
Зметою прогнозування можливих видів псування продукту чи сировини,
атакож їх безпечності для здоров’я населення, використовують якісні мікробіологічні показники.
Якісні показники вказують на відсутність(наявність) мікроорганізмів конкретних видів у певній масі продукту чи сировини.
Пряме виявлення у харчових продуктах патогенних або - умовно
патогенних мікроорганізмів та їх токсинів проводять відповідно до діючої |
|
||||||||||
нормативної |
|
документації. Зазвичай |
перевіряють |
|
наявність |
сальмонел, |
|
||||
золотистого стафілокока, протея. Для ряду харчових продуктів встановлюють |
|
||||||||||
додаткові правила – виявлення Clostridium botulinum та їх токсинів, Clostridium |
|
||||||||||
perfringens, Bacillus cereus та ін. Згідно вимог ДСТУ патогенні мікроорганізми |
|
||||||||||
та їх токсини повинні бути відсутні в певному об’є(масі) досліджуваного |
|
||||||||||
матеріалу – 25, 50 г і т.д. |
|
|
|
|
|
|
|
|
|||
Виявити |
|
в |
об’єктах |
|
навколишнього |
середовища |
па |
||||
мікроорганізми, порівняно з сапрофітною мікрофлорою, складніше, так як їх |
|
||||||||||
кількість |
досить |
незначна. Тому |
визначення |
можливого |
забруднення |
|
|||||
патогенною мікрофлорою проводять не лише |
прямими, а й непрямими |
|
|||||||||
методами – |
на |
основі |
кількісного |
і |
якісного |
обліку санітарно-показових |
|
||||
мікроорганізмів, до яких належать кишкова паличка, гемолітичні стрептококи і |
|
||||||||||
стафілококи. |
|
|
|
|
|
|
|
|
|
|
|
Санітарно-показові |
мікроорганізми |
входять |
|
до |
складу |
нормальної |
|||||
мікрофлори тіла та з його виділеннями потрапляють у зовнішнє середовище. |
|
||||||||||
Наприклад, виявлення кишкової палички і ентерокока– бактерій, специфічних |
|
||||||||||
для кишкових виділень(фекалій) вказує на можливу присутність збудників |
|
||||||||||
кишкових інфекцій. |
|
|
|
|
|
|
|
|
|
||
На сьогодні як показник фекального забруднення харчових продуктів та |
|
||||||||||
інших досліджуваних об’єктів використовують |
бактерії |
групи кишкової |
|||||||||
палички (БГКП). До цієї групи, крім Еscherichia coli, належать бактерії інших |
|
||||||||||
родів родини Enterobacteriaceae: Enterobacter, Citrobacter, Klebsiella, Serratia, |
|
||||||||||
які також зустрічаються в кишківнику людини і теплокровних тварин, проте на |
|
||||||||||
відміну від E. coli більш поширені в природі. |
|
|
|
|
|
|
|||||
Допустимий вміст БГКП виражається як показник“титру БГКП” (колі- |
|
||||||||||
титр) – мінімальна кількість (маса чи об’єм) продукту, в якому можуть бути |
|
||||||||||
виявлені ці бактерії. Користуються також показником“індекс БГКП” (колі- |
|
||||||||||
індекс) – певна маса (об’єм) продукту, в якій БГКП повинні бути відсутні. |
|
||||||||||
Виявлення БГКП під час дослідження продуктів чи сировини свідчить про |
|
||||||||||
незадовільний санітарний стан об’єкта. |
|
|
|
|
|
|
|
||||
Мікробіологічний контроль здійснюється на всіх стадіях виробництва, |
|
||||||||||
починаючи з контролю сировини, що надходить на переробку, і закінчуючи |
|
||||||||||
готовою продукцією. |
|
|
|
|
|
|
|
|
|
||
Мікробіологічний |
контроль |
сировини. |
У |
біотехнологічній |
|
||||||
промисловості використовують різні види сировини: мелясу, кукурудзяний екстракт, солод, борошно, цукор тощо.
82
У м ел яс і визначають загальну кількість мікроорганізмів в1 г, якісний
склад |
мікрофлори, з |
метою |
виявлення |
мікроорганізмів– шкідників |
біотехнологічного виробництва та їх відсоткове співвідношення, кількісний |
||||
склад. |
Мікроорганізми |
у мелясу |
потрапляють |
з буряків, апаратури, води, |
повітря у процесі виробництва цукру. У густій мелясі з високим вмістом цукру |
|
|||||||||||||||
(близько 50 %) за |
концентрації сухих |
речовин76−80 % мікроорганізми |
не |
|
||||||||||||
розмножуються, а |
під час тривалого зберігання в закритих |
сховищах |
їх |
|||||||||||||
кількість постійно зменшується внаслідок відмирання менш |
стійких |
до |
||||||||||||||
осмотичного тиску форм. Проте якщо під час зберігання у мелясу потрапляє |
|
|||||||||||||||
волога, то кількість мікрофлори у розведеному поверхневому шарі може різко |
|
|||||||||||||||
збільшитися. З часом внаслідок активної діяльності мікроорганізмів хімічний |
|
|||||||||||||||
склад меляси змінюється: знижується вміст цукру і накопичуються шкідливі |
|
|||||||||||||||
продукти обміну речовин мікроорганізмів. |
|
|
|
|
|
|
|
|
|
|
||||||
Найчастіше в мелясі виявляються дріжджі родівCandida і Torulopsis, а |
|
|||||||||||||||
також різні види бактерій(спороутворювальні – Bacillus subtilis, |
B. brevis, B. |
|
||||||||||||||
megaterium |
та ін., |
неспороутворювальні – представники |
роду Pseudomonas, |
|
||||||||||||
кишкова |
паличка, |
протей, мікрококи, молочнокислі |
бактерії – |
зокрема, |
|
|||||||||||
Leuconostoc mesenteroides). Гриби та актиноміцети потрапляють у мелясу з |
|
|||||||||||||||
повітря, з поверхні буряків, з ґрунтовими і дощовими водами. Виявляють гриби |
|
|||||||||||||||
родів Penicillium, |
Aspergillus, |
Rhizopus, |
Endomyces. |
У |
мелясі |
|
вони |
не |
|
|||||||
розмножуються, а тільки зберігаються у вигляді спор чи конідій. |
|
|
|
|
|
|||||||||||
Для |
визначення |
загальної |
кількості |
мікроорганізмів1 гу |
меляси |
|
||||||||||
використовують агаризоване мелясне сусло (вміст сухих речовин (СР) – 12 %) з |
|
|||||||||||||||
дріжджовим автолізатом (СР 0,5−1,0 %). Показник МАФАМ у 1 г доброякісної |
|
|||||||||||||||
меляси |
не |
повинен |
перевищувати2·103 |
КУО/г. |
Меляса |
|
вважається |
|
||||||||
непридатною, якщо в 1 г міститься понад 2·104 КУО/г. |
|
|
|
|
|
|
|
|||||||||
Для виявлення у мелясі молочнокислих бактерій використовують сусло, в |
|
|||||||||||||||
яке додають стерильну крейду. Гнильні бактерії визначають на молочному |
|
|||||||||||||||
агаризованому середовищі, дріжджі – на синтетичному середовищі з лізином. |
|
|
||||||||||||||
За вмісту у мелясі спороутворювальних гнильних бактерій90 % від |
|
|||||||||||||||
загальної кількості мікроорганізмів її не рекомендують використовувати у |
|
|||||||||||||||
виробництві |
дріжджів, |
оскільки |
у |
цьому |
разі |
ймовірна |
наявніст |
|||||||||
нітритоутворювальних бактерій. За наявності у мелясі нітритів |
у |
кількості |
|
|||||||||||||
навіть 0,0005 % затримується нормальне брунькування дріжджових клітин. |
|
|
||||||||||||||
Якщо меляса містить небезпечні для виробництва мікроорганізми або |
|
|||||||||||||||
характеризується підвищеною обнасіненням, її пастеризують чи миттєво |
|
|||||||||||||||
нагрівають |
|
до |
температури120 °С. Можливе |
застосування |
антибіотика |
|
||||||||||
біоміцину (у |
кількості 5−10 г |
на |
1 м3 |
мелясного сусла) або |
антисептиків |
|
||||||||||
(суміш молочної та борної кислот, фурацилін або фуразолідон). Ці речовини |
|
|||||||||||||||
використовуються для пригнічення небажаної мікрофлори у приточній мелясі у |
|
|||||||||||||||
поєднанні з нагріванням її до85 °С. Антисептики додають у кількості 0,01−0,1 |
|
|||||||||||||||
% на 1 м3 мелясного сусла залежно від ступеню інфікування меляси. |
|
|
|
|
||||||||||||
Ку ку ру д з ян и й е кс т ра к т може |
містити спори міцеліальних грибів, |
|
||||||||||||||
спороутворювальні |
(аеробні – Bacillus subtilis |
і |
анаеробні – маслянокислі) |
|
||||||||||||
бактерії та |
неспороутворювальні(сарцина, мікрококи), |
інколи |
виявляють |
|
||||||||||||
83
дріжджі. Контроль здійснюють мікроскопуванням або висівом на поживні середовища, використовувані для аналізу меляси. Допускається зараження від 5·102 до 104 КУО/г. Під час переробки сильно обнасіненого кукурудзяного
екстракту необхідну порцію перед використанням розбавляють водою у співвідношенні 1:1 та парою доводять температуру до 90−95 °С.
С ол о д одержують замочуванням і пророщуванням зерна, при цьому його численна мікрофлора активізується і посилено розмножується. Загальна кількість мікроорганізмів у солоді збільшується 10у−20 разів порівняно з мікрофлорою зерна. Склад мікроорганізмів солоду безпосередньо залежить від якості зерна, умов його зберігання та підготовки до солодорощення(якості промивання і дезинфекції).
На зібраному доброякісному зерні переважає бактеріальна мікрофлора, що не утворює спор– гнильні бактерії родуPseudomonas, гомо- і гетероферментативні молочнокислі бактерії. Вони становлять до90 % всіх мікроорганізмів, які знаходяться на поверхні зерна. Показником доброякісності зерна є високий вміст клітин Ervinia herbicola (трав’яна паличка), які належать до сапрофітної мікрофлори. Міцеліальна мікрофлора свіжезібраного зерна
представлена грибами родів Alternaria, Fusarium, Cladosporium. |
|
||
Інтенсивне |
збільшення |
міцеліальних , |
мікрококівгрибів, |
спороутворювальних бактерій спостерігається за підвищеної вологості зерна. Так, у ячмені, сильно ураженому міцеліальними грибами, виявляються токсичні речовини: афлатоксини, охратоксини та .інЯчмінь з різко вираженими ознаками псування має низьку пророслість і непридатний для виготовлення солоду.
Серед мікроорганізмів свіжопророслого солоду переважають гриби родів
Penicillium, Aspergillus, Rhizopus, Mucor, Endomyces. Для попередження мікробної контамінації солоду проводять дезінфекцію обладнання, приміщень антисептиками: хлорним вапном, формаліном, 2−4 %-им розчином мідного купоросу. Зерно, яке надходить на замочування, після ретельного миття теж дезінфікують розчинами перманганату калію, хлорним вапном або формаліном.
М ікрофл ора |
б орошн а визначається в основному мікрофлорою |
зерна. У процесі |
помелу зерна мікроорганізми, які знаходяться на його |
поверхні, у значній кількості переходять в борошно. Тому кількісний і якісний склад мікрофлори борошна залежить від ступеню інфікування зерна, також способів його помелу та очищення. У борошні вищого ґатунку мікроорганізмів менше порівняно з низькосортним борошном з великою кількістю висівок. Загальна кількість мікроорганізмів у1 г борошна може досягати3·106 КУО і
залежить від вмісту вологи, тривалості його зберігання тощо. |
|
|
|||
Якість |
борошна |
характеризують |
за |
наявністю |
в |
неспороутворювальних бактерій Ervinia herbicola – їх |
вміст |
повинен бути |
не |
||
менше 90 %. У борошні доброї якості не повинно бути кокових форм бактерій, |
|||||
наявність яких свідчить про підвищену вологість борошна. |
|
|
|||
Специфічна мікрофлора борошна представлена спороутворювальними |
|||||
бактеріями, |
зокрема найнебезпечнішими єBacillus subtilis, |
які спричиняють |
|||
84
тягучу хворобу хліба. Тому для оцінки якості борошна перевіряють наявність у
ньому спор цих бактерій. |
|
||
У |
борошні |
виявляють також |
молочнокислі та оцтовокислі бактерії, |
дріжджі та спори міцеліальних грибів, серед яких переважають пеніцили, |
|||
аспергіли, |
рідше – |
мукорові гриби. Так, |
гетероферментативні молочнокислі |
газоутворювальні бактерії спричиняють спучування і прокисання макаронних
виробів. |
|
|
|
|
|
|
|
|
|
Внаслідок неправильного зберігання борошна(з вологістю понад 14 %) |
|
||||||||
кількість |
мікроорганізмів |
у |
ньому |
підвищується, що |
супроводжується |
|
|||
прокисанням, згіркненням та пліснявінням борошна. |
|
|
|
|
|||||
Борошно в першу чергу аналізують за органолептичними показниками. |
|
||||||||
Якщо в партії борошна наявний сторонній запах плісняви, кислий або згірклий |
|
||||||||
смак, то |
проводять |
висів |
|
зразків |
для |
визначення |
загальної |
кількос |
|
мікроорганізмів. Проби висівають на різні поживні середовища залежно від |
|||||||||
групи мікроорганізмів, які виявляють. |
|
|
|
|
|
||||
Борошно з підвищеним |
|
вмістом |
мікроорганізмів, |
також |
з ознаками |
|
|||
згіркнення, прокисання та пліснявіння непридатне для використання у
хлібопекарському виробництві. |
|
|
|
|
М і кр о фл о р а |
ц у кр у є |
переважно |
мікрофлорою |
вторинного |
походження. Готовий цукор інфікується мікроорганізмами у процесі його очищення, сушіння, пакування та зберігання, особливо за підвищеної вологості продукту. Вміст мікроорганізмів у цукрі порівняно незначний і за стандартної вологості (0,15 %) становить від 50 до 100 КУО в 1 г. За підвищеної вологості, наявності сторонніх домішок чи забруднення кількість мікроорганізмів у цукрі може сягати 104 КУО/г.
У сухому цукрі виявлені мезофільні і термофільні спороутворювальні бактерії, а також лейконосток, осмофільні дріжджі та міцеліальні гриби. У вологому цукрі переважають міцеліальні гриби.
Наявність сторонньої мікрофлори в цукрі є особливо небезпечною для харчових виробництв, які використовують цукор як сировину. У кондитерській промисловості газоутворювальні бактерії і дріжджі призводять до спучування і розтріскування цукерок; осмофільні дріжджі, спороутворювальні термофільні і мезофільні аероби і анаероби спричиняють бродіння і закисання фруктових пюре, варення, джему.
Цукор-пісок часто є джерелом слизоутворювальних бактерійLeuconostoс mesenteroides, розвиток яких сприяєослизненню фруктових соків, сиропів, квасного сусла, хлібного квасу. Ці бактерії утворюють капсули на поверхні клітин, є досить термостійкими і витримують температуру нагрівання до90 °С, швидко розмножуються за зниженої загальної кислотності. За накопичення 0,7−1 % кислоти лейконосток гине. У виробництві квасу для пригнічення розвитку слизоутворювальних бактерій цукровий сироп необхідно кип’ятити не менше 30 хв і строго дотримуватися санітарно-гігієнічних вимог виробництва.
Для попередження контамінації цукру його необхідно зберігати за відносної вологості не більше 70 %.
85
Мікробіологічний контроль готової продукції. |
|
|
|
|
|
|
|
|||||||||
Хлібопекарські |
|
|
дріжджі. |
Виробництво |
сухих |
|
і |
|
пресован |
|||||||
хлібопекарських дріжджів належить до біотехнологічного виробництва, яке |
|
|
||||||||||||||
передбачає вирощування чистої культури Saccharomyces cerevisiae періодичним |
|
|
||||||||||||||
способом. Пресовані дріжджі характеризуються вологістю67−75 |
%. Сухі |
|
|
|||||||||||||
дріжджі |
одержують висушуванням за певних умов |
пресованих |
до |
вологості |
|
|||||||||||
8−10 %. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оцінку |
якості |
|
дріжджів |
|
проводять |
насамперед |
мікроскопуванням: |
|
||||||||
визначають величину і однорідність клітин сахароміцетів, |
також наявність |
|
||||||||||||||
сторонньої |
мікрофлори. |
Висівом |
проб |
дріжджів |
на |
поживні |
|
середовища |
|
|||||||
визначають |
ступінь загальної контамінації і наявність мікроорганізмів– |
|
||||||||||||||
шкідників виробництва. Для розрахунку кількості дріжджів-сахароміцетів висів |
|
|
||||||||||||||
здійснюють на сусло-агарове середовище. |
|
|
|
|
|
|
|
|
|
|||||||
Найнебезпечнішими |
|
для |
дріжджового |
виробництва |
є |
|
деякі |
групи |
||||||||
бактерій, |
які |
виявляють |
у |
готових |
дріжджах, зокрема, |
спороутворювальні |
|
|
||||||||
(Bacillus |
subtilis, B. mycoides, B. megaterium, B. brevis), неспороутворювальні |
|
|
|||||||||||||
гнильні (представники |
роду Pseudomonas, |
а також |
кишкова |
паличка, протей, |
|
|
||||||||||
мікрококи), молочнокислі (Leuconostoс mesenteroides та ін.). |
|
|
|
|
|
|
||||||||||
Наряду |
з бактеріальною |
мікрофлорою |
у |
готовій |
продукції |
можуть |
||||||||||
розвиватися |
дріжджі |
|
родівCandida |
і |
Torulopsis. |
Швидкість |
росту |
та |
|
|||||||
розмноження |
цих дріжджів у кілька разів більша, ніж |
у основної |
культури |
|
||||||||||||
хлібопекарських дріжджів. Наявність у готовій продукції сторонніх дріжджів |
|
|||||||||||||||
знижує стійкість пресованих дріжджів, погіршує їх консистенцію, підйомну |
|
|
||||||||||||||
силу і мальтазну активність. |
|
|
|
|
|
|
|
|
|
|
|
|
||||
У |
доброякісних |
|
пресованих |
дріжджах |
допускається |
наявні |
||||||||||
кислотоутворювальних бактерій не більше15−35 %, гнильні бактерії повинні |
|
|||||||||||||||
бути відсутні, сторонніх дріжджів – не більше 30 %. |
|
|
|
|
|
|
|
|
||||||||
Кефір – єдиний кисломолочний напій, що виготовляється на природній |
|
|||||||||||||||
симбіотичній |
заквасці – кефірних |
грибках (зернах), до складу |
яких |
входять |
|
|||||||||||
мезофільні молочнокислі стрептококи, мезофільні молочнокислі і термофільні |
|
|||||||||||||||
палички типу стрепто- і бетабактерій, болгарська паличка, а також дріжджі й |
|
|||||||||||||||
оцтовокислі |
бактерії. |
До |
сирого |
молока |
для |
виробництва |
кефіру |
не |
||||||||
пред'являють |
особливих вимог, тому що мікрофлора кефірної |
закваски |
|
|||||||||||||
порівняно невимоглива до якості молока. |
|
|
|
|
|
|
|
|
|
|||||||
Процес сквашування і дозрівання кефіру здійснюють за температури не |
|
|||||||||||||||
вище 25 ºС, тому |
|
залишкова |
|
мікрофлора |
пастеризованого |
молока |
||||||||||
розмножується незначно. У процесі виробництва кефіру основним джерелом |
|
|||||||||||||||
мікробного забруднення є кефірна закваска. Молоко інфікується також різними |
|
|
||||||||||||||
мікроорганізмами, що потрапляють з устаткування. |
|
|
|
|
|
|
|
|
||||||||
До сторонньої мікрофлори належать бактерії групи кишкової палички. У |
|
|
||||||||||||||
процесі сквашування і дозрівання кефіру їх кількість підвищується 10в разів. |
|
|
||||||||||||||
Потім у результаті антагоністичного впливу дріжджів і оцтовокислих бактерій |
|
|||||||||||||||
кількість БГКП знижується до вихідного рівня. У зв'язку з тим, що бактерії |
|
|
||||||||||||||
групи кишкової палички спричиняють газоутворення в молоці при температурі |
|
|||||||||||||||
понад 30 ºС, |
вони не викликають спучування кефіру. |
|
|
|
|
|
|
|
||||||||
86
Плісняві гриби потрапляють у кефір з устаткування, з повітря, іноді з неякісної закваски, і за тривалого зберігання продукту можуть розвиватися на
його поверхні. |
|
|
|
|
Мікробіологічний |
контроль |
технології |
виробництва |
кисломолочних |
продуктів полягає в дослідженні пастеризованого молока, призначеного для заквашування, закваски, напівфабрикатів і готової продукції. Готову продукцію контролюють, як правило, на наявність бактерій групи кишкової палички, золотистого стафілокока, іноді виявляють плісняву і дріжджі, а за необхідності
– мікроскопуванням не рідше одного разу на п’ять .днівПри епідемічних показах виявляють патогенні мікроорганізми, у тому числі й сальмонели як основні збудники харчових отруєнь. Проби відбирають із продукту після розливно-закупорювального автомата або з пляшки і холодостату.
Для вироблення кефіру необхідно, щоб у заквашеному молоці БГКП були відсутні в 0,3 дм3. У сметані нормується також кількість пліснявих грибів і дріжджів, КУО яких не повинно перевищувати50 у 1 мл продукту. Патогенні мікроорганізми, у тому числі сальмонели, у 25 г кисломолочних продуктів не допускаються.
Пиво. Виробництво пива основане на життєдіяльності дріжджів та проводиться в нестерильних умовах, тому на певних стадіях технологічного процесу можливе інфікування різними мікроорганізмами, які спричиняють
псування |
готової продукції. Важливим показником |
якості пива є |
його |
біологічна |
стійкість – здатність протистояти помутнінню, |
причиною якого |
є |
розвиток мікроорганізмів. Псування пива можуть викликати культурні пивні дріжджі, які залишилися у невеликих кількостях у результаті неякісного сепарування або фільтрування. При розвитку в готовому пиві вони утворюють
рихлий осад на дні пляшки, надають продукту |
дріжджового |
присмаку |
та |
|||
псують його товарний вигляд. |
|
|
|
|
|
|
Найнебезпечнішими |
для |
пива |
є |
сторонні |
мікроорганізми, які |
|
спричиняють його помутніння, підвищують |
кислотність, змінюють смак |
та |
||||
аромат, роблячи його непридатним до споживання. Основними шкідниками пивоварного виробництва є молочнокислі бактерії(Lactobacillus і Pediococcus),
оцтовокислі бактерії (Acetomonas, |
Acetobacter), |
бактерії групи кишкової |
палички (Escherichia, Klebsiella). У |
пивоварному |
виробництві зустрічаються |
дикі дріжджі, які відрізняються за деякими фізіологічними ознаками від культурних пивних дріжджів. До них належать дріжджі родівSaccharomyces, Brettanomyces, Candida, Hansenula та ін. Активно розмножуючись у готовому пиві, вони викликають суттєві зміни його біохімічних і органолептичних властивостей: з’являються сторонні запахи(фруктово-ефірний, лікарський), неприємний смак та гіркота, утворюється сильне помутніння, осад. Деякі дріжджі, наприклад представники роду Candida, розвиваються на поверхні пива
у вигляді плівки. |
|
|
|
|
|
|
У |
готовому |
пиві |
перевіряють |
загальну |
кількість |
мікроорганізмів |
(показник МАФАМ) та наявність бактерій групи кишкової палички. У 1 мл пива не повинно бути більше 102 КУО сторонніх мікроорганізмів.
87
|
Загальні |
принципи |
мікробіологічного |
контролю |
|
сировини |
|||||||||||
продукції. Порядок відбору проб, методи їх дослідження і нормативи якості |
|
||||||||||||||||
регламентуються відповідною нормативно-технічною документацією. |
|
|
|
|
|||||||||||||
|
Вихідним |
матеріалом |
|
для |
посівів |
харчових |
|
продуктів |
щіль |
||||||||
консистенції зазвичай є10 %-на суспензія продукту. Для її приготування |
|
||||||||||||||||
стерильно відібрану з різних місць проби наважку(як |
правило 15 |
г) |
|
||||||||||||||
подрібнюють |
у |
гомогенізаторі(або |
розтирають |
у |
стерильній |
),ступці |
|||||||||||
добавляють 135 мл стерильної водопровідної води або ізотонічного розчину |
|
||||||||||||||||
хлориду натрію. Рідкі і напіврідкі продукти ретельно перемішують і у разі |
|
||||||||||||||||
кислої реакції підлужнюють стерильним10 %-ним розчином |
бікарбонату |
|
|||||||||||||||
натрію до рН7,2−7,4. Рідкий продукт або суспензію щільного продукту |
|
||||||||||||||||
використовують для приготування ряду послідовних десятикратних розведень |
|
||||||||||||||||
залежно від характеру продукції і передбачуваного обнасінення. |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
Завдання на виконання |
|
|
|
|
|
|
|
|
|
|||
№9). |
1. Аналіз посівів (мікробіологічний контроль) |
(лабораторна |
робота |
|
|||||||||||||
2. |
Посіяти |
зразки |
|
води |
для |
визначення |
|
мікробного |
ч |
||||||||
|
|
|
|||||||||||||||
(поверхневий посів на чашки з МПА для виявлення мезофільних аеробів– |
|
||||||||||||||||
вирощування при 30 °С та глибинний посів на чашки з МПА для виявлення |
|
||||||||||||||||
факультативних анаеробів – вирощування при 37 °С), а також для визначення |
|
||||||||||||||||
індексу БГКП (бактерій групи кишкової палички) на середовище ЕНДО. |
|
|
|||||||||||||||
|
3. |
Здійснити |
мікробіологічний |
контроль |
|
сировини(меляса, |
|
||||||||||
кукурудзяний екстракт, солод, борошно, зерно, молоко, м’ясо, картопля тощо). |
|
||||||||||||||||
Для цього 1–10 г сировини (залежно від об’єкту досліджень) суспендують у 99 |
|
||||||||||||||||
мл |
стерильної |
водопровідної |
, водизалежно |
від |
|
ступеня |
|
мікробного |
|||||||||
забруднення готують ряд послідовних десятикратних розведень, які висівають |
|
||||||||||||||||
на чашки з МПА(для виявлення мезофільних аеробних і факультативно |
|
||||||||||||||||
анаеробних мікроорганізмів – показник МАФАМ), чашки з середовищем ЕНДО |
|
||||||||||||||||
(для виявлення бактерій групи кишкової палички– показник БГКП), чашки з |
|
||||||||||||||||
сусло-агаром |
(для виявлення |
грибів |
і дріжджів), чашки |
з |
середовищем |
|
|||||||||||
Чистовича |
(для |
виявлення стафілококів). Для |
виявлення |
молочнокислих |
|
||||||||||||
бактерій у мелясі здійснюють висів на капустяне середовище або середовище |
|
||||||||||||||||
МРС. |
4. |
Провести |
мікробіологічний |
аналіз |
готової |
біотехнологічної |
і |
||||||||||
|
|||||||||||||||||
харчової продукції (пресовані хлібопекарські дріжджі різних виробників, |
|
||||||||||||||||
білково-вітамінні концентрати, кефір і сметана різних виробників, пиво різних |
|
||||||||||||||||
виробників тощо). Для цього 1–10 г продукції (залежно від об’єкту досліджень) |
|
||||||||||||||||
суспендують |
у 99 |
мл |
стерильної |
водопровідної |
води, залежно від ступеня |
|
|||||||||||
мікробного забруднення готують ряд послідовних десятикратних розведень, які |
|
||||||||||||||||
висівають на чашки з МПА(для виявлення |
мезофільних |
|
аеробних |
і |
|||||||||||||
факультативно анеробних мікроорганізмів– показник МАФАМ), |
чашки |
з |
|
||||||||||||||
середовищем |
ЕНДО (для виявлення бактерій |
групи |
кишкової |
палички– |
|
||||||||||||
88
