
- •ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
- •КИЇВ НУХТ 2010
- •Лабораторна робота № 3
- •Лабораторна робота № 4
- •Лабораторна робота № 5
- •Таблиця 5.1
- •Кількісний облік мікроорганізмів
- •Лабораторна робота № 6
- •Лабораторна робота № 7
- •Лабораторна робота № 9
- •Лабораторна робота № 11
- •Лабораторна робота № 15
- •Нітрифікуючі бактерії
- •Nitrosomonas europaea
- •Nitrobacter winogradskyi
- •Nitrobacter winogradskyi
- •Характеристика накопичувальних культур мікроорганізмів
- •ЛІТЕРАТУРА
- •ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
- •ЛАБОРАТОРНИЙ ПРАКТИКУМ
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
ЗАГАЛЬНА МІКРОБІОЛОГІЯ І ВІРУСОЛОГІЯ
ЛАБОРАТОРНИЙ ПРАКТИКУМ
для студентів напряму 6.051401 “Біотехнологія” денної форми навчання
СХВАЛЕНО на засіданні кафедри
біотехнології мікробного синтезу Протокол №5
від 02.11.2009 р.
КИЇВ НУХТ 2010
Загальна мікробіологія і вірусологія: Лабораторний |
практикум для |
студентів напряму 6.051401 “Біотехнологія” денної форми |
навчання/ Уклад. |
Т.П. Пирог, М.М. Антонюк, С.В. Ігнатенко. – К.: НУХТ, 2010. — 1279 с.
Рецензент О.В. Карпов, д-р біол.наук
Укладачі: Т.П. Пирог, д-р біол. наук, проф.
М.М. Антонюк, канд. техн. наук
С.В. Ігнатенко
Відповідальний за випуск Т.П. Пирог, д-р біол. наук, проф.
Видання подається в авторській редакції
2
|
Правила роботи в мікробіологічній лабораторії |
|
|
|||||||
Під час роботи у мікробіологічній лабораторії слід суворо дотримуватись |
|
|||||||||
вимог, викладених |
в інструкції з |
техніки безпеки. У |
разі, |
якщо |
студент не |
|
||||
ознайомлений |
з зазначеними вимогами, він повинен повідомити про |
це |
||||||||
викладача. Студент |
несе персональну |
відповідальність за власну |
безпеку під |
|||||||
час перебування у лабораторії, що підтверджує підписом у журналі з техніки |
|
|||||||||
безпеки під час проведення інструктажу. |
|
|
|
|
|
|||||
Перед |
початком |
кожної |
лабораторної |
роботи |
студент |
пови |
||||
ознайомитись |
з |
особливостями |
техніки |
безпеки |
у |
процесі |
виконан |
|||
лабораторної роботи та поставити свій підпис у журналі. |
|
|
|
|
||||||
У лабораторію забороняється входити у верхньому одязі. Усі студенти |
|
|||||||||
повинні працювати в чистих бавовняних халатах, які мають бути застебнуті на |
|
|||||||||
всі ґудзики. Волосся необхідно прибрати з обличчя та сховати під шапочку. |
|
|||||||||
Кожен |
студент |
працює |
на |
постійному |
місці |
та |
виконує |
завдан |
||
індивідуально. На робочому місці потрібно підтримувати зразковий порядок. Особисті речі повинні зберігатися в спеціально відведеному місці.
Під час виконання лабораторної роботи категорично забороняється
користуватися мобільними телефонами та залишати їх увімкненими. |
|
|||||
У лабораторії забороняється вживати їжу та напої. |
|
|
||||
Під |
час |
виконання |
лабораторної |
роботи |
студентам |
заборон |
пересуватися по лабораторії без зайвої потреби. Всі рухи повинні |
бути |
|||||
спокійними та виваженими. |
|
|
|
|
||
До роботи не допускаються студенти, які |
мають |
пошкодження |
на |
|||
відкритих |
ділянках шкіри, не |
оброблені та |
не заклеєні бактерицидним |
|||
пластиром.
Працюючи з відкритим полум’ям (газовий пальник, спиртівка), потрібно дотримуватися таких вимог: запалювати спиртівку та газовий пальник лише за
3
допомогою |
сірника. Забороняється |
запалювати запальничкою |
та іншою |
запаленою |
спиртівкою (газовим |
пальником); гасити запалену |
спиртівку |
потрібно, закривши доступ повітря спеціальним ковпачком, а газовий пальник – |
|||
перекриттям доступу газу. Розташовувати спиртівку потрібно на відстані не менш, ніж 20 см від краю робочого стола. Запалену спиртівку заборонено пересувати з місця на місце. По закінченню роботи з газовими пальниками необхідно перевірити, що вихід газу перекрито.
У разі випадкового займання ватно-марлевого корка необхідно терміново
загасити його, закривши доступ повітря. |
|
Під час роботи з живими культурамікроорганізміви |
необхідно |
слідкувати за наявністю запобіжних ватних тампонів у піпетках та - ватно марлевих корків у пробірках.
Роботу з культурами мікроміцетів можна проводити лише за наявності індивідуальних засобів захисту дихальних шляхів.
У разі випадкового потрапляння мікробного матеріалу на відкриті ділянки шкіри, стіл чи підлогу це місце треба ретельно обробити дезинфікувальним розчином.
Роботу |
у |
мікробіологічному |
боксідозволено |
|
проводити |
лише |
за |
||||||||
проходження |
|
додаткового |
інструктажу |
з |
техніки , |
безпекинаявності |
|
||||||||
відповідного |
захисного |
одягу(халат, шапочка, захисна |
маска |
|
та |
|
захисні |
|
|||||||
окуляри). |
Категорично |
забороняється |
заходити |
у |
бокс |
|
за |
увімкнено |
|||||||
бактерицидної лампи. |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Всі предмети, використані у роботі з живими мікроорганізмами, мають |
|
||||||||||||||
бути знезаражені фламбуванням (петлі, голки), кип’ятінням |
(пробірки, |
чашки |
|
||||||||||||
Петрі), |
обробленням |
дезінфікувальними |
розчинами(шпателі, |
піпетки, |
|
||||||||||
предметні й накривні скельця). |
|
|
|
|
|
|
|
|
|
|
|
||||
Забороняється користуватися скляним посудом, що має сколи, тріщини, |
|
||||||||||||||
гострі краї. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У лабораторії необхідно дотримуватися обережностіпід час роботи з |
|
||||||||||||||
хімічними речовинами. За необхідності (робота з концентрованими хімічними |
|
||||||||||||||
речовинами) |
потрібно |
використовувати |
засоби |
індивідуального |
захисту |
||||||||||
(рукавички, респіратори, |
гумовий |
фартух, |
захисні |
окуляри). |
У |
|
процесі |
|
|||||||
розведення концентрованої кислоти необхідно кислоту вносити у розчинник, а |
|
||||||||||||||
не навпаки. У разі потрапляння будь-яких хімічних речовин на шкіру необхідно |
|
||||||||||||||
змити реактив |
великою |
кількістю |
води; нейтралізувати кислоту |
|
необхідно |
|
|||||||||
слабким розчином соди, а луг – слабким розчином оцтової кислоти. Роботу з концентрованими та леткими хімічними речовинами необхідно проводити під витяжною шафою.
Необхідно суворо дотримуватисявимог електробезпеки. Забороняється використовувати несправне електрообладнання і вмикати прилади без дозволу викладача або лаборанта, а також торкатися поверхні приладу мокрими руками.
Після закінчення роботи студент повинен упорядкувати робоче місце, руки необхідно ретельно вимити, а за потреби обробити дезінфікувальним розчином. Слід мати індивідуальний рушник або серветки для витирання рук.
4
Лабораторна робота № 1
ОРГАНІЗАЦІЯ МІКРОБІОЛОГІЧНОЇ ЛАБОРАТОРІЇ. ПРАВИЛА РОБОТИ З КУЛЬТУРАМИ МІКРООРГАНІЗМІВ.
МОРФОЛОГІЧНІ ТА КУЛЬТУРАЛЬНІ ОЗНАКИ БАКТЕРІЙ (4 год)
Мета роботи: ознайомлення з організацією мікробіологічної лабораторії та правилами роботи у ній; закріплення знань про різні методи мікроскопії, будову бактеріальної клітини, методи вивчення морфології мікроорганізмів, закріплення практичних навичок з фарбування бактерій за Грамом, виявлення спор і капсул у бактерій, ознайомлення з характером росту актиноміцетів на агаризованих середовищах.
Матеріали та обладнання: спиртівки, бактеріологічні петлі, предметні та накривні скельця, генціанвіолет, водний фуксин, карболовий фуксин Ціля, метиленовий синій, розчин Люголя, 3 %-ний розчин КОН, 5 %-ний розчин сірчаної кислоти, етанол 96°, 10 %-ний розчин КОН (або NaOH), рідка чорна туш, гліцерин, фільтрувальний папір, промивалки з дистильованою водою,
мікроскопи, культури бактерій Escherichia coli, Sarcina flava, Bacillus subtilis var. mesentericus, Azotobacter chroococcum, Actinomyces (Streptomyces) aureofaciens.
Загальні відомості
Методи мікроскопії
Фазово-контрастна мікроскопія. Око людини виявляє тільки відмінності у довжині (кольорі) та амплітуді (інтенсивність, контрастність) світлової хвилі, але не уловлює відмінностей у фазі. Препарати живих клітин мікроорганізмів за забарвленням і прозорістю мало відрізняються від навколишнього середовища, оскільки світлові промені, проходячи через живу клітину, не змінюють своєї амплітуди, хоча й змінюються за фазою. Метод фазово-контрастної мікроскопії дає змогу перетворювати невидимі фазові зміни, яким піддається світлова хвиля під час проходження через мікробну клітину, у видимі амплітудні і тим самим підвищити контрастність зображення. Оптична система, використовувана для одержання фазового контрасту, складається з фазової пластини і кільцевої діафрагми (рис. 1.1).
Фазова пластина − це круг напилення з солей рідкісних металів на одну з лінз об’єктива. Вона забезпечує зміну фази прохідної хвилі на ¼, що приводить до перетворення фазових відмінностей у амплітудні. Кільцева діафрагма − це непроникна для світла пластина, що має прозору щілину у вигляді кільця, через яку світло потрапляє у конденсор. Фазовий ефект досягається лише за точного суміщення фазового кільця з проекцією кільцевої діафр. Фагмизовоконтрастне обладнання складається з набору фазових об’єктивів, які мають на
металевій оправі крім позначки про |
збільшення ще й позначку«Ф», |
револьверного конденсора з набором |
кільцевих діафрагм, кожна з яких |
5
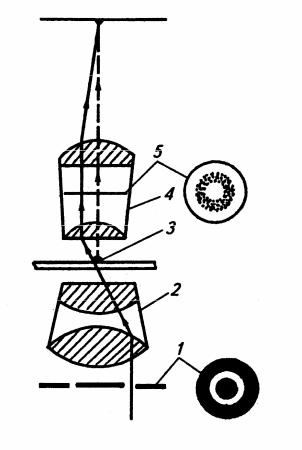
відповідає фазовій пластині певного об’єктиву, і допоміжного мікроскопа,
призначення якого |
− центрування |
кільцевої діафрагми |
відносно |
фазової |
пластини об’єктива. |
|
|
|
|
Мікроскопія у темному полі. Мікроскопія у темному полі базується на |
||||
освітленні об’єкта |
косими променями |
світла. Ці промені не |
потрапляють |
в |
об’єктив, тому поле зору виглядає темним. Якщо препарат містить клітини мікроорганізмів, то косі промені під час проходження через такий препарат значною мірою відбиваються від поверхні клітин і настільки відхиляються від
свого початкового напряму, що потрапляють в об’єктив. У цьому |
разі |
||||
спостерігач бачить на чорному фоні об’єкти, які інтенсивно світяться, навіть |
|||||
якщо |
їхній діаметр |
у10 разів менший, ніж розподільча здатність об’єктиву. |
|||
Таке |
освітлення |
препарату |
досягається |
використанням |
спеціально |
конденсора. Темно-польовий конденсор має затемнену середню частину, тому центральні промені світла, що йдуть від дзеркала, затримуються, а у площину препарату потрапляють тільки бокові промені, відбиті від дзеркальної поверхні, розміщеної всередині конденсора (рис. 1.2).
Рис. 1.1. Схема проходження променів у фазово-
контрастному обладнанні:
1 – кільцева діафрагма; 2 – конденсор; 3 – об’єкт; 4 – об’єктив; 5 – фазова пластина
6
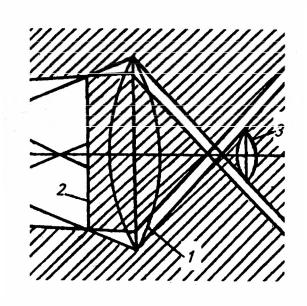
За мікроскопування у темному полі можна побачити об’єкти, величина яких вимірюється сотими долями мікрометра, лежить поза межами видимості
звичайного мікроскопа. Проте спостерігання об’єктів у темному полі дає можливість розрізнити тільки їх контури, але не дає можливості розглянути
внутрішню будову. |
|
|
|
|
|
|
|
|
|
|
|
|
||
Люмінесцентна |
(флуоресцентна) |
|
мікроскопія. |
Люмінесцентна |
|
|||||||||
мікроскопія базується |
на здатності ряду |
речовин біологічного |
походження |
|
||||||||||
(хлорофіл, вітамін В2, деякі алкалоїди, антибіотики та ін.) і деяких барвників |
|
|||||||||||||
світитися під дією світла, що падає на них. Молекули речовин, здатних до |
|
|||||||||||||
люмінесценції, |
поглинають |
енергію і |
переходять на |
вищий |
|
енергетичний |
||||||||
рівень. Проте у такому стані вони перебувають нетривалий , часпісля чого |
|
|||||||||||||
знову |
повертаються |
у |
|
вихідний |
|
енергетичний . Цейстан |
перехід |
|
||||||
супроводжується |
віддачею |
надлишку |
|
енергії |
у |
|
вигляді |
світл |
||||||
люмінесценцією, |
причому |
|
освітлюваний |
|
об’єкт |
випромінює |
,промені |
|||||||
енергетично |
бідніші, |
тобто |
|
з більшою довжиною , хвилініж промені |
|
|||||||||
збуджуваного |
|
світла. Тому |
спричиняти |
люмінесценцію |
|
слід |
аб |
|||||||
короткохвильовою |
частиною |
видимого спектру |
(синьо-фіолетові |
промені, |
|
|||||||||
Рис. 1.2. Схема проходження променів
конденсорі темного поля:
1 – лінза конденсора; 2 – чорна пластина; 3 – об’єктив
λ=460 нм) або ультрафіолетовими променями (λ=360−380 нм). В обох випадках виникає люмінесценція у кольоровій гаммі видимого спектра, тобто утворюється кольорове зображення об’єкта. Більшості мікробних клітин притаманна досить слабка власна або первинна люмінесценція, тому їх обробляють водними розчинами спеціальних барвників − флуорохромів, до яких належать акридин оранжевий, примулін, берберин та ін. Вони можуть забарвлювати не тільки всю мікробну клітину, а й вибірково концентруватися на певних клітинних структурах, спричиняючи їхнє світіння. Так, наприклад,
7
акридин оранжевий забарвлює у зелений колір протоплазму, |
рожевий |
− |
|
|||
вакуолі, у яскраво-червоний − |
метахроматинові зерна і у світло-зелений − |
|
||||
ядро. Невисока |
токсичність |
використовуваних |
розчинів |
барвників |
дає |
|
можливість вивчати живу непошкоджену клітину. Така наведена, або вторинна, |
|
|||||
люмінесценція має велике значення для проведення цитологічних досліджень. |
|
|
||||
Електронна |
мікроскопія. |
Електронні мікроскопи використовують |
для |
|
||
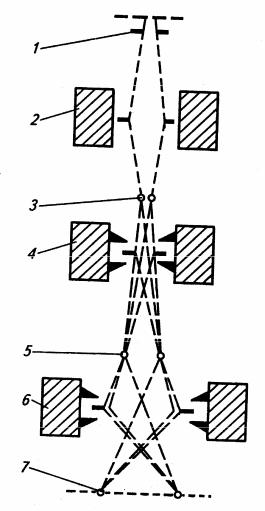
вивчення об’єктів і структур, що перебувають за межами видимості звичайних мікроскопів. Розподільча здатність електронних мікроскопів становить1−40 Å, збільшення у середньому105 раз. Будова електронного мікроскопа загалом аналогічна будові світлооптичного; окремі вузли електронного мікроскопа подібні до вузлів світлооптичного, перевернутого окуляром донизу, проте роль світлових променів в електронному мікроскопі відіграє пучок електронів, випромінюваних спеціальним джерелом − електронною гарматою (рис. 1.3).
Рис. 1.3. Схема дії електронного мікроскопа:
1 – електронна гармата; 2 – конденсорна лінза; 3 – об’єкт; 4 – об’єктна лінза; 5 – проміжне зображення; 6 – проекційна лінза; 7 – зображення об’єкта на екрані
8
Електрони потрапляють у магнітну конденсорну лінзу. Використовувати скляні лінзи або дзеркала для фокусування електронів не можна, оскільки скло непроникне для електронів. В електронному мікроскопі роль лінз відіграє кругове магнітне поле, під дією якого електрони можуть відхилятися або центруватися. Функція конденсорної лінзи електронного мікроскопа аналогічна
функції конденсора звичайного мікроскопа − |
зведення пучка |
електронів в |
|||||
одній точці на об’єкті. Пройшовши |
через |
об’єкт, електрони потрапляють в |
|||||
об’єктну |
лінзу, що знову |
фокусує |
пучок, який |
розходиться, і |
дає |
перше |
|
проміжне |
зображення |
об’єкта. Магнітний |
проектор (проекційна |
лінза, |
|||
аналогічна лінзі окуляра) дає кінцеве збільшення об’єкта на флуоресційному екрані − металевій пластинці, вкритій тонким шаром сірчистого цинку або мінерала вілеміту. За потрапляння на екран електронних променів кожна частинка цього шару починає світитися; за заміщення екрану фотографічною пластинкою зображення об’єкта можна фотографувати.
Препарати для електронно-мікроскопічних досліджень поміщають на спеціальні сітки, на які нанесена надзвичайно тонка целюлозна або пластмасова плівка (підкладка); загальна товщина препарату і підкладки не повинна перевищувати 2500 Å. Для збільшення контрастності об’єкта проводять його напилення важкими металами (хромом, золотом, паладієм) у вигляді пари або здійснюють обробку контрастними речовинами(фосфорно-вольфрамова кислота, уранілацетат). У процесі дослідження морфологічних особливостей клітин мікроорганізмів у електронному мікроскопі вивчають цілі клітини; ультраструктуру клітин вивчають на їхніх зрізах, товщина яких не перевищує 800−900 Å. За допомогою електронного мікроскопа не можна спостерігати живі клітини мікроорганізмів, так як вони гинуть під час проходження пучка електронів через препарат. Електронні мікроскопи мають досить складну конструкцію і не використовуються у навчальних лабораторіях.
Морфологія бактерій
Ці організми за формою поділяються на кілька: сферичнігуп, циліндричні, спіральні, незвичної форми та нитчасті.
Сферичні бактерії, або коки (від грец. kokkos – зерно) мають округлу
форму. Залежно від розташування клітин після |
їх ділення |
поділяються на |
групи. |
|
|
Мікрококи (Micrococcus) (від грец. mikros – малий) – коки, що діляться в |
||
одній площині і після поділу розміщуються поодиноко, наприклад, Micrococcus |
||
aqua – звичайний мешканець води. |
|
|
Диплококи (Diplococcus) (від грец. diploos – |
подвійний) |
– коки, що |
діляться в одній площині і після поділу розміщуються попарно, наприклад,
Methylococcus capsulatus – бактерія, що окиснює метан; Neisseria gonorrhoeae –
збудник гонореї.
Стрептококи (Streptococcus) (від грец. streptos – ланцюжок) – коки, що діляться в одній площині. Після поділу між клітинами зберігається зв’язок, і вони розміщуються у вигляді ланцюжків, наприклад, Streptococcus lactis –
9
молочнокисла бактерія, що спричиняє скисання молока. Ланцюжки можуть бути короткими – 3–4 клітини або довгими (кілька десятків клітин).
Тетракоки (Tetracoccus) (від грец. tetra – чотири) – коки, що діляться в двох взаємно перпендикулярних площинах і після поділу утворюють тетради.
Наприклад, Aerococcus.
Сарцини (Sarcina) (від грец. sarcio – з’єдную) – коки, що діляться в трьох взаємно перпендикулярних площинах і після поділу розміщуються у вигляді пакетів з 8, 16, 32, 64 клітин. Наприклад, Sarcina flava – жовта сарцина; Methanosarcina methanica – метаноутворювальна сарцина.
Стафілококи (Staphylococcus) (від грец. staphyle – виноградне гроно) – коки, що діляться в кількох площинах і після поділу розміщуються у вигляді виноградного грона. Наприклад, Staphylococcus aureus – золотистий стафілокок, збудник гнійних інфекцій.
Коки не завжди бувають правильної круглої форми, вони можуть бути ланцетоподібними (Streptococcus pneumoniae – збудник пневмонії), овальними
(Peptostreptococcus), подовженими (Ruminococcus).
Більшість коків є нерухливими і не утворюють ендоспор, хоча деякі
можуть |
мати |
джгутики(Planococcus, Planosarcina) та |
ендоспори |
(Sporosarcina). |
|
|
|
Циліндрична форма бактерій (від грец. bacteria, лат. bacillum – паличка)
є характерною для більшості бактерій. Паличкоподібні бактерії поділяються на такі, що утворюють ендоспори(Bacillus, Clostridium), і на такі, що не утворюють ендоспор (Pseudomonas, Xanthomonas). Паличкоподібні форми бактерій розрізняються за довжиною, поперечним діаметром, формою кінців клітин і характером їх розміщення. Розрізняють палички довгі (понад 3 мкм) (Bacillus megaterium – гнильна бактерія; Clostridium botulinum – збудник ботулізму), короткі (1 мкм) (бактерії кишкової групи), дуже короткі (менше 1 мкм), довжина яких не набагато перевищує діаметр клітини, тому їх називають кокобактеріями (Brucella abortus – збудник бруцельозу). За поперечним діаметром бактерії поділяються на тонкі(Mycobacterium tuberculosis – збудник туберкульозу) і товсті (Escherichia coli – кишкова паличка). Кінці паличок можуть бути закруглені, з обрізаними краями, загострені, потовщені. Розміщуються палички поодиноко, по дві клітини (Pseudomonas), ланцюжками (Bacillus mycoides – типова грунтова бактерія). Деякі палички розміщені під кутом одна до одної, утворюючи фігури, подібні до X чи Y, наприклад артробактерії, корінебактерії, нокардії, мікобактерії.
Бактерії спіральної формирозрізняються за кількістю і характером завитків, довжиною та товщиною клітин. Їх можна поділити на форми, що не гнуться (вібріони, спірили), і на такі, що вигинаються (спірохети).
Вібріони (від лат. vibrare – коливатися, тремтіти) мають вигляд зігнутої палички чи коми (Vibrio cholerae – збудник холери).
Спірили (від лат. spiro – вигин) – спірально вигнуті клітини, що мають великий поперечний діаметр і невелику кількість високих завитків(Spirillum volutans – сапрофітна бактерія; Spirillum minus – патогенна, здатна спричиняти захворювання спірила).
10
Спірохети (від |
лат. spira |
– |
вигин, грец. chaite |
– волосся) |
такі, що |
||
вигинаються, |
тонкі, |
спірально |
вигнуті клітини. До спірохет |
належить |
|||
Spirochaeta plicatilis – звичайний мешканець прісних, морських та стічних вод, |
|||||||
Treponema pallidum |
– збудник |
|
сифілісу, Treponema |
macrodentium |
– зубна |
||
спірохета, мешканець ротової порожнини при зубному карієсі. |
|
|
|||||
Бактерії |
незвичної формиморфологічно різноманітні. |
Тороїдальні |
|||||
(замкнуті чи незамкнуті кільця), |
зіркоподібні, тубероїдні клітини |
показані на |
|||||
рис. 1.4. Форма плоских квадратних пластинок і коробочкоподібних плоских клітин геометрично різноманітної форми є характерною для архебактерій.
Нитчасті форми бактерій (трихомні, від грец. trichoma – волосина) – це здебільшого паличкоподібні клітини, з’єднані в довгі ланцюжки, які об’єднані
слизом, |
чохлами-піхвами, |
плазмодесмами (місточками) або |
єдиною |
оболонкою. Зазвичай зовні трихом покритий додатковими оболонками, які не |
|||
беруть |
участі в утворенні перегородок між клітинами. Клітини |
трихом |
|
переважно є паличкоподібними. |
|
|
|
Всі |
бактерії характеризуються постійністю форми клітини завдяки |
||
особливостям будови однієї з оболонок – клітинної стінки. Але є бактерії, для |
|||
яких характерним є поліморфізм. Це мікоплазми, L-форми, клітини яких не мають клітинної стінки, а також артро-, нокардіота корінебактерії, в яких у циклі розвитку спостерігається зміна форми клітини – кок – паличка – кок.
Розміри бактеріальних клітин сильно варіюють. Діаметр сферичних бактерій становить від 0,2 до 2,5 мкм. Найменшими є мікоплазми – 0,15 мкм. Цей розмір є теоретичною межею клітинного рівня організації життя, у якому в клітині ще може бути мінімум молекул білка(близько 1200) і мінімум ферментних реакцій, необхідних для підтримання клітинноїструктури. Паличкоподібні бактерії мають товщину 0,5 – 1,0 мкм, довжину від 1 – 2 до 10 мкм. Нитчасті форми можуть досягати макроскопічних розмірів(1 мм) і їх можна побачити неозброєним оком. Довжина спірохет коливається від 1 – 3 до 100 – 500 мкм. Нижній розмір одноклітинних бактерій визначається простором,
необхідним для |
упаковки апарату, який забезпечує незалежне |
існування |
||||
клітини, верхній – оптимальним співвідношенням |
між |
поверхнею |
клітини і |
|||
об’ємом. |
|
Грамом. Диференційоване |
|
|
||
Фарбування |
за |
фарбування |
бактерій |
|||
генціанвіолетом |
було |
запропоновано 1884у |
р. |
датським фармакологом |
||
Г.Х.Грамом. У мікробіології забарвлення за Грамом є важливою таксономічною ознакою, з якою корелюють інші властивості бактерій. Суть методу полягає в тому, що при фарбуванні бактерій генціанвіолетом(кристалвіолетом, метилвіолетом) фарба з йодом утворює сполуку, що утримується клітинами при обробці їх спиртом. Такі бактерії забарвлені в синьо-фіолетовий колір і їх називають грампозитивними.
Бактерії, |
які знебаврвлюються при обробці спиртом, називаються |
|||||
грамнегативними. Їх потім дофарбовують контрастною фарбою (фуксином). |
||||||
Основними |
компонентами |
клітинної |
стінки |
бактерій |
є |
пептидоглікани |
(глікопептиди, |
мукопептиди, |
муреїни). Пептидоглікани виявлено |
тільки у |
|||
прокаріот. Специфічний гетерополімер пептидоглікан складається із:
11
− залишків N-ацетилглюкозаміну та N-ацетилмурамової кислоти, з’єднаних між собою b-1,4-глікозидними зв’язками;
− діамінокислот, з яких найчастіше зустрічаються мезо-діамінопімелінова
кислота, |
LL-діамінопімелінова |
кислота, |
лізин, |
орнітин. |
Наявність |
таких |
|||
амінокислот з двома аміногрупами має принципове значення для просторової |
|||||||||
організації пептидоглікану. Вони |
забезпечують |
утворення двох пептидних |
|||||||
зв’язків між пептидними угрупованнями в молекулі; |
|
|
|
||||||
− |
інших амінокислот(D- та |
L-аланін, D-глутамінова |
кислота, L-серин, |
||||||
гліцин). |
|
|
|
|
|
|
|
|
|
Клітинна стінка грампозитивних бактерій. У грампозитивних бактерій |
|||||||||
частка |
муреїнової сітки |
становить30–70 |
% |
сухої |
маси |
клітинної |
стінки |
||
(завтовшки 40 шарів). Замість мезо-діамінопімелінової кислоти часто міститься |
|||||||||
LL-діамінопімелінова кислота або лізин. У клітинній стінці грампозитивних |
|||||||||
бактерій |
полісахариди, якщо |
вони ,є зв’язані |
між |
собою |
ковалентно. Вміст |
||||
ліпідів і білків невисокий. У білках клітинних стінок грампозитивних бактерій набір амінокислот менший (4–12), ніж у грамнегативних (містяться практично всі амінокислоти, з яких складаються білки).
Характерною |
особливістю |
грампозитивних бактерій |
є |
наявність у |
|
клітинній стінці тейхоєвих кислот. |
Тейхоєві |
кислоти – це |
ланцюги, які |
||
складаються з 8–50 |
залишків гліцерину чи |
рибітолу, зв’язаних |
між |
собою |
|
фосфатними місточками. У молекулі тейхоєвої кислоти поліол може містити моносахариди як замісники. Деякі з тейхоєвих кислот містять еритритол чи маніт. Припускається, що тейхоєві кислоти зв’язані з муреїном через фосфат за типом аміду. У складі тейхоєвих кислот деяких грампозитивних бактерій
містяться жирні кислоти, які утворюють ефірні зв’язки |
з |
гліцериновими |
|||||
залишками. Їх називають л і п о т е й х о є в и м и к и с л о т а м и. Тейхоєві |
|
||||||
кислоти містяться в клітинах у значних кількостях. У деяких бактерій вони |
|
||||||
становлять більше половини маси клітинної стінки. |
|
|
|
|
|
||
Клітинна стінка грамнегативних бактерій. У |
грамнегативних |
бакте- |
|
||||
рій муреїнова сітка є одношаровою і становить менше10 % сухої |
маси |
|
|||||
клітинної стінки. Муреїн містить тількимезо-діамінопімелінову кислоту і не |
|
||||||
містить лізину. У складі клітинних стінок грамнегативних бактерій тейхоєві |
|
||||||
кислоти не виявлено. |
|
|
|
|
|
|
|
У всіх |
грамнегативних |
бактерій зверху одношарового |
чи |
найбільше |
|
||
двошарового муреїнового мішка розміщується зовнішній шар клітинної стінки. |
|
||||||
Це так званазовнішня мембрана, що складається з білків, фосфоліпідів та |
|
||||||
ліпополісахаридів (ЛПС). Ліпополісахариди – складні |
молекули |
з |
|||||
молекулярною масою більше 10 000. Вони складаються з трьох частин– ліпіду |
|
||||||
А, ядра (кор, |
серцевинна зона) |
та О-специфічного |
бокового |
ланцюга. |
ЛПС |
|
|
Salmonella typhimurium та інших ентеробактерій досліджені достатньо повно. |
|
||||||
Ендоспори. До утворення спор здатна лише невелика група бактерій. |
|
||||||
Велике значення спор пов’язано з їх термостійкістю. У той час, як майже вся |
|
||||||
решта бактерій, а також вегетативні клітини спороутворювальних видів гинуть |
|
||||||
при 80 °С (при температурі пастеризації) через 10 хв, терморезистентні спори |
|
||||||
12
витримують кип’ятіння впродовж кількох годин. Трудомістка та дорога техніка
стерилізації (знезараження) розрахована на знищення спор. |
|
|||
Спороутворювальні |
бактерії, за |
одним |
винятком, належать |
до |
паличкоподібних |
грампозитивних |
. |
бактерійГрамнегативними |
|
спороутворювальними бактеріями є представники родуDesulfotomaculum. Описано понад 10 родів бактерій, які утворюють ендоспори, наприклад,
Bacillus, Clostridium, Desulfotomaculum, Sporolactobacillus, Oscillospora та ін.
Більшість із цих бактерій є рухомими завдяки перитрихально розміщеним джгутикам. Бактерії, які належать до родуBacillus, є строгими аеробами або факультативними анаеробами. Роди Clostridium і Desulfotomaculum об’єднують анаеробні бактерії, здатні до утворення спор. Клостридії одержують енергію за рахунок бродіння, види Desulfotomaculum − шляхом анаеробного дихання. Sporolactobacillus належить до молочнокислих бактерій. Sporosarcina має сферичні клітини, але за своїми фізіологічними ознаками належить до бацил.
Характерною особливістю спороутворювальних бактерій є низький вміст ГЦ (гуанін + цитозин) у ДНК клітин. Так, у клостридій ДНК містить від 22 до
27 % ГЦ.
Спори утворюються всередині бактеріальної клітини. Цей процес починається з накопичення білкового матеріалу, тому показник заломлення світла у місці утворення спори збільшується. При цьому відбувається споживання запасних речовин(полі-b-гідроксимасляної кислоти у аеробів та полісахаридів у анаеробів). Упродовж перших 5 год спороутворення значна частина білків материнської клітини розкладається. При цьому утворюється специфічна для спор речовина– дипіколінова кислота, яка не зустрічається у
вегетативних |
клітинах. Дипіколінова |
кислота |
міститься |
тільки |
терморезистентних спорах. |
|
|
|
|
Спори |
не є обов’язковою |
стадією життєвого циклу |
. бактерійЗа |
|
сприятливих умов бактерії можуть необмежений час розмножуватися діленням як вегетативні клітини. Утворення спор починається лише тоді, коли не
вистачає поживних речовин або коли в надлишку накопичуються продукти обміну. Зрілі спори не проявляють ніякої метаболічної активності. Вони надзвичайно стійкі до дії високих температур, різного роду опромінень, хімічних агентів. Терморезистентність обумовлена низьким вмістом води – 15 % (стільки ж, скільки в сухому казеїні або у вовні). Терморезистентність спор приблизно пропорційна вмісту в них дипіколінової кислоти. Бактерії у вигляді спор можуть тривалий час перебувати у стані анабіозу. Так, у зразках грунту, які зберігались 50−100 років, були виявлені спори бацил.
Капсула та слизовий шар. Капсула розміщена поверх клітинної стінки. Розрізняють мікрокапсули, завтовшки 0,2 мкм. Їх не можна побачити за допомогою світлового мікроскопа, а тільки виявити імунологічно(за набуханням при змішуванні із специфічними антитілами). Макрокапсули – завтовшки понад 0,2 мкм, добре видимі у світловому мікроскопі. Слизовий шар
– за товщиною у багато разів перевищує розміри клітини. Являє собою гідратовану в’язку масу, що накопичується на поверхні клітини.
13
За хімічним складом капсули поділяються на1) капсули полісахаридної природи, які складаються з: а) гомополісахаридів (побудовані з одного і того ж моносахариду, наприклад, у Leuconostoc mesenteroides – з глюкози, у бактерій роду Klebsiella – з галактози); б) гетерополісахаридів (побудовані з різних моносахаридних залишків, наприклад, у Pseudomonas aeruginosa – із залишків глюкози, галактози, манози, рамнози, глюкуронової кислоти); 2) капсули, які складаються з поліпептидів і полісахаридів, наприклад, у Bacillus megaterium.
Актиноміцети. Актиноміцети – це грампозитивні бактерії, які утворюють розгалужені нитки або гіфи у вигляді міцелію, тобто утворюють подібність міцелію (повітряного та субстратного). Міцелій може бути стабільним або розпадатися на паличкоподібні та кокоподібні елементи. Якщо міцелій зберігається, то утворюються спори, за допомогою яких відбувається розмноження. Спори можуть утворюватись безпосередньо на повітряних гіфах (спорофорах), від яких відшнуровуються конідії, або в спорангіях. Деякі
представники |
|
утворюють |
спори |
зі |
джгутиками(рухомі). Рухомість |
у |
|||||
актиноміцетів (якщо вона є) за рахунок джгутиків. Майже всі аероби. Свою |
|
||||||||||
назву актиноміцети отримали від першого з описаних видів– Actinomyces bovis |
|
||||||||||
– “променистого грибка”, який викликає актиномікоз – захворювання великої |
|
||||||||||
рогатої |
худоби. |
Хемогетеротрофи, |
використовують |
різноманітні джерела |
|||||||
енергії, у тому числі і складні полімери. Роди розрізняються за морфологічними |
|
||||||||||
ознаками, |
а |
також |
за |
наявністю |
чи |
відсутністю |
маркерниххімічних |
|
|||
компонентів клітинної стінки. |
|
|
|
|
|
|
|
||||
Тривіальна |
назва «актиноміцети» закріпилася |
за стрептоміцетами |
− |
||||||||
представниками роду Streptomyces. Вони утворюють добре розвинутий міцелій, |
|
||||||||||
розмножуються конідіями. Мають будову, аналогічну будові грибів, але з більш |
|
||||||||||
тонкими прокаріотними гіфами, які містять багато нуклеоїдів і не завжди
розділені |
на |
окремі |
клітини. Це |
насамперед |
грунтові |
організми, які |
|||
пристосовані до існування у відносно засушливих |
умовах. Їм |
притаманна |
|||||||
висока |
гідролітична |
активність |
щодо |
різних |
полімерів. Багато |
які |
|||
стрептоміцети асимілюють целюлозу, хітин та інші природні речовини, що важко розкладаються. Міцелій поділяється на субстратний і повітряний, який служить для розмноження. Конідієспори є одночасно і органами розмноження, і формами спокою. Стрептоміцети є продуцентами антибіотиків(стрептоміцин, хлороміцетин, ауреоміцин, тетрацикліни).
|
|
Завдання на виконання |
|
|
|
||
1. Зафарбувати за |
Грамом |
бактеріїEscherichia |
coli, |
Sarcina |
flava. |
||
Фарбування за Грамом здійснюють так: на предметному склі готують мазок |
|||||||
досліджуваної культури |
бактерій, висушують його на повітрі, фіксують у |
||||||
полум’ї спиртівки. На фіксований мазок наносять достатню кількість розчину |
|||||||
карболового |
генціанвіолету, витримують |
1−2 хв, барвник |
зливають , іне |
||||
змиваючи |
водою, обробляють мазок |
розчином |
Люголя до |
почорніння |
|||
(приблизно 1−2 хв). Зливають розчин Люголя і обробляють препарат упродовж |
|||||||
0,5−1 хв (строго!) 96° етанолом (або |
зануренням у стаканчик |
зі спиртом, або |
|||||
14
нанесенням спирту на мазок). Від тривалості обробки мазка спиртом залежить
результат |
всього |
забарвлення: за |
недостатньої |
обробки |
всі |
бактерії |
|
залишаються забарвленими, за надмірної − всі знебарвлюються. |
Відразу після |
||||||
обробки |
спиртом препарат промивають |
водою і забарвлюють |
його |
упродовж |
|||
1−2 хв водним фуксином. Зливають барвник, препарат промивають водою, висушують фільтрувальним папером. Мікроскопують препарат з імерсійною системою. Грампозитивні бактерії забарвлюються у синьо-фіолетовий колір, грамнегативні − у червоний або рожевий колір фуксину(колір додаткового барвника).
2. Паралельно провести визначення грам-типу вказаних бактерій за допомогою експрес-методу (обробка 3 %-ним КОН). Цей експрес-метод базується на руйнуванні клітин грамнегативних бактерій у лужному середовищі і визначенні вільної ДНК. На предметне скло наносять краплю3 %-ного
розчину КОН, в яку за допомогою |
бактеріологічної |
петлі |
поміщають |
||||
досліджувані |
бактерії (24-годинні |
культури |
з агаризованого середовища) і |
||||
ретельно перемішують петлею. У разі дослідження грамнегативних бактерій |
|||||||
через 5−10 с |
за переміщення |
петлі по |
склу |
утворюється |
слизовий слід |
||
завдовжки 1−2 см. За тестування грампозитивних бактерій реакція негативна: |
|||||||
слиз не утворюється. |
|
|
у Bacillus |
subtilis |
var. |
||
3. Виявити спори (за методом Ціля-Златогорова) |
|||||||
mesentericus. Розглянути під мікроскопом, замалювати. |
|
|
|
|
|||
Виявлення спор здійснюють |
так. Мазок |
спороутворювальних |
бактерій |
||||
висушують на повітрі. Для фіксації і розрихлення оболонок ендоспор мазок не менше 10 раз проводять над полум’ям спиртівки. На препарат кладуть клаптик фільтрувального паперу, добре змочують карболовим фуксином , Ціля підігрівають упродовж 3−5 хв до появи пари(але не до кипіння). При цьому треба пильно слідкувати, щоб фарба не випаровувалася, а папір не підсихав, тому періодично добавляють нові порції фарби. Після охолодження знімають папір і упродовж 6−10 с препарат знебарвлюють 5 %-ним розчином сірчаної кислоти, відразу ж промивають водою(спори залишаються забарвленими у
червоний |
колір, а |
вегетативні |
клітини |
знебарвлюються). Додатково |
забарвлюють |
препарат |
метиленовим |
синім |
упродовж20 хв. Промивають |
водою, висушують і мікроскопують з імерсією. У разі правильного фарбування спори забарвлюються у яскраво-червоний колір і чітко виділяються на синьому фоні цитоплазми.
4. Виявити капсули у Azotobacter chroococcum за методом Омелянського. Розглянути під мікроскопом, замалювати.
Для виявлення капсул на предметне скло наносять краплю карболового фуксину Ціля і краплю води. Поміщають у краплю барвника досліджувану культуру бактерій і витримують упродовж2−3 хв. Добавляють краплю рідкої чорної туші або 10 %-ного водного розчину нітрозину і ретельно перемішують. Накривають накривним скельцем і розглядають з об’єктивом40х або розмазують по склу, висушують на повітрі і мікроскопують з імерсією.
15
Барвники не проникають у капсулу, тому безбарвна капсула добре видна на загальному темному фоні препарату і забарвлених у червоний колір клітин бактерій.
5.Ознайомитись з характером росту актиноміцетівActinomyces
(Streptomyces) aureofaciens на агаризованих середовищах. Приготувати препарат «відбиток» Actinomyces (Streptomyces) aureofaciens, розглянути та замалювати.
Культури стрептоміцетів, вирощені на середовищі в чашках Петрі, можна
вивчати безпосередньо на чашці за малого |
збільшення(об’єктив 10х), |
поміщаючи відкриту чашку на предметний столик |
мікроскопа. При цьому |
видно, що гіфи частково проникли у субстрат, частково стеляться по поверхні і піднімаються над нею. Можна побачити спорофори зі спорами. З цих же культур можна приготувати препарати для мікроскопічного вивче: наня предметне скло наносять краплю 10 %-ного розчину лугу (КОН або NaOH) або 70−90 %-ного розчину оцтової кислоти або 60° етанолу, в якій розщеплюють за допомогою двох препарувальних голок міцелій, взятий з невеликим шматочком середовища. Препарат щільно накривають накривним скельцем мікроскопують із збільшенням 40х. На такому препараті добре видно різницю у товщині субстратних і повітряних гіфів, форму спороносіїв.
Для вивчення типу спороутворення, форми та розміру спор готують препарат «відбиток». Для приготування такого препарату накривне скло щільно притиснюють до поверхні колонії, потім поміщають його на предметне скло у краплину води відбитком донизу і мікроскопують з об’єктивом 40х.
Контрольні запитання
1.Яких правил техніки безпеки необхідно дотримуватися під час роботи
умікробіологічній лабораторії?
2.У чому полягає суть фазово-контрастної мікроскопії?
3.Охарактеризуйте мікроскопію у темному полі.
4.Які особливості притаманні люмінесцентній мікроскопії?
5.У чому полягає суть електронної мікроскопії?
6.Які переваги і недоліки притаманні кожному з методів мікроскопії?
7.На які групи за морфологічними ознаками поділяються бактерії?
8.На основі яких ознак сферичні бактерії поділяються на кілька груп?
9.Що таке ендоспори?
10.Дайте характеристику спороутворювальних бактерій.
11.Як відбувається процес споруляції?
12.Що таке капсула? Як поділяються капсули за розміром і хімічною природою?
13.У чому полягає суть фарбування бактерій за Грамом?
14.Охарактеризуйте хімічний склад клітинних стінок бактерій.
15.Які відмінності виявлено у складі клітинної стінки грампозитивних і грамнегативних бактерій?
16.Що таке пептидоглікан?
16
17.Назвіть типові бактеріальні полісахариди.
18.Які функції виконує клітинна стінка і капсула?
19.Які характерні ознаки притаманні актиноміцетам?
20.На основі яких ознак актиноміцети належать до бактерій?
21.За якими методами можна виявити спори і капсули у бактерій?
22.Як здійснюється забарвлення за Грамом?
Лабораторна робота № 2
СКАНУЮЧА ЗОНДОВА МІКРОСКОПІЯ. МОРФОЛОГІЧНІ ТА КУЛЬТУРАЛЬНІ ОЗНАКИ ГРИБІВ І ДРІЖДЖІВ (4 год)
Мета роботи: ознайомлення з методом скануючої зондової мікроскопії, закріплення знань про будову дріжджової і грибної клітини, методи вивчення морфології мікроорганізмів, закріплення практичних навичок з приготування препаратів «роздавлена крапля» і препаратів для вивчення грибів.
Матеріали |
та |
обладнання: |
спиртівки, |
бактеріологічні |
петлі, |
|
препарувальні |
голки, предметні |
та |
накривні |
скельця, промивалки |
з |
|
дистильованою |
водою, |
мікроскопи, |
культури |
дріжджів Saccharomyces |
||
cerevisiae, Saccharomycoides ludwigii, Shizosaccharomyces pombe, Candida scottii, Rhodotorula glutinis, Trichosporon cutaneum, культури грибів Rhizopus nigricans, Aspergillus niger, Fusarium culmorum, Trichotecium roseum.
Загальні відомості
Скануюча зондова мікроскопія: методи та апаратура, побудова та обробка зображень. Скануюча зондова мікроскопія(СЗМ) – найсучасніший метод дослідження структури і властивостей поверхні різних об’єктів з наглядним представленням інформації у трьохмірному вигляді. Роздільна здатність зображення об’єктів може досягати тисячних долей нанометрів, що дає змогу візуалізувати навіть атомну та молекулярну структуру поверхні,
вплинути на неї на рівні окремих атомів та . молекулМетодами |
СЗМ |
|||
спостереження можна проводити в різних умовах: на повітрі, у вакуумі, в |
||||
розчинах і електролітах. |
|
|
|
|
На сьогодні існує безліч модифікацій зондових мікроскопів, основною |
||||
відмінністю яких є використання різних мікрозондів |
для |
вимірюванн |
||
властивостей |
і характеристик |
поверхні. Так, у скануючому |
тунельному |
|
мікроскопі (СТМ) в якості зонда використовують металеве вістря, |
яке разом з |
|||
поверхнею досліджуваного зразка утворюють тунельний перехід. У мікроскопі |
||||
вимірюють величину електричного струму тунельного переходу. В скануючому |
||||
силовому мікроскопі (ССМ) на пружній мікроконсолі закріплене мікровістря, |
||||
при взаємодії якого з поверхнею зразка реєструється |
сила |
їх .взаємодії |
||
Скануючий силовий мікроскоп носить ще назву атомно-силовий. Використання |
||||
скануючого |
електрохімічного |
мікроскопу(СЕМ) дозволяє |
візуалізувати |
|
17
окремі атоми в розчинах електролітів. Скануючий ємкісний мікроскоп (СЄМ)
реєструє |
варіації електричної ємності з роздільною |
здатністю500 нм, |
||
магнітно-силовий (МСМ) – |
зображення магнітних |
доменів |
з роздільною |
|
здатністю |
менше 100 нм, |
ближньопольний |
акустичний (БАМ) – |
|
низькочастотні звукові вимірювання з роздільною здатністю в 10 нм тощо. Прототипом всіх зондових мікроскопів нових конструкцій є скануючий
тунельний мікроскоп, який |
було винайдено у 1981 р. |
|
|
|
||
Принцип |
роботи |
СТМ |
базується |
на |
проходженні |
електро |
потенційного бар’єру, який утворений внаслідок розриву електричного ланцюга
– незначним проміжком між зондуючим мікровістрям і поверхнею зразка. В основі роботи приладу лежить відомий феномен електронного тунелювання: між металевим вістрям та поверхнею досліджуваного провідника прикладають
електричну напругу і вістря наближають до поверхні зразка до появ тунельного струму. Відстань від вістря до поверхні може становити долі нанометра. Підтримуючи постійну величину тунельного струму, переміщують металеве вістря над поверхнею зразка. При цьому траєкторія руху вістря співпадає з профілем поверхні.
В СТМ в якості зонда використовують заточене вістря, виготовлене із металевої проволоки (вольфрамова, із сплаву благородних металів). Для дослідження біологічних об’єктів застосовують зонди невеликого діаметру(1 –
2 мкм) при значній довжині (10–15 мкм). Переміщення зонду над поверхнею |
|
|||||||||||||
забезпечується |
механічним |
|
маніпулятором, який |
виготовляють |
із |
|||||||||
п’єзокерамічного матеріалу. |
Зазвичай використовують |
мікроманіпулятори, |
||||||||||||
виконані у вигляді тонкостінної трубки з декількома роздільними електродами. |
|
|||||||||||||
Управляюча |
напруга |
викликає |
подовження |
чи |
згин |
таких |
трубчат |
|||||||
маніпуляторів (може бути до трьох), і, відповідно, переміщення зонду по всіх |
|
|||||||||||||
трьох |
|
просторових |
координатах. Конструкції |
сучасних |
маніпуляторів |
|||||||||
забезпечують діапазон механічного переміщення зонду 100до –200 мкм у |
|
|||||||||||||
площині зразка і до5–12 мкм по нормалі до зразка. СТМ застосовують для |
|
|||||||||||||
дослідження поверхонь, що проводять електричний струм. |
|
|
|
|
||||||||||
|
Найбільшого використання на сьогодні набув атомно-силовий мікроскоп, |
|
||||||||||||
що |
являє |
оригінальну |
конструкцію |
надчутливого |
|
вимірювача |
профілю |
|||||||
поверхні. В якості зонда використовують мікромініатюрну пружну пластинку |
||||||||||||||
(кантилевер), на вільному кінці якої методами літографії формують вістря із |
||||||||||||||
твердого матеріалу (нітриду кремнію, кремнію). При переміщенні зонду вздовж |
|
|||||||||||||
поверхні |
реєструють |
|
відхилення |
кантилевера чи |
здійснюють |
переміщення |
||||||||
зонду таким чином, щоб прогин кантилевера залишався постійним. Такий |
|
|||||||||||||
мікроскоп дозволяє вимірювати не лише профіль поверхні, але й локальні сили |
|
|||||||||||||
тертя, |
величину |
адгезії, |
пружні |
та |
в’язкі |
властивості |
поверхні |
|||||||
субнанометровою просторовою роздільною здатністю. |
|
|
|
|
|
|||||||||
|
В скануючому оптичному мікроскопі ближнього поля в якості зонда |
|||||||||||||
використовують оптичне волокно з мініатюрною діафрагмою. При скануванні |
|
|||||||||||||
зразка маніпулятор переміщує діафрагму поблизу поверхні. Випромінювання |
|
|||||||||||||
лазерного |
джерела, |
проходячи |
через |
діафрагму, освітлює |
досліджувану |
|||||||||
поверхню. |
Реєструють |
розсіяне |
чи |
перевипромінюване |
світло. В результаті |
|
||||||||
18
того, що розсіювання світла відбувається у ближній зоні(на відстані до випромінюючої діафрагми меншому, ніж довжина хвилі) стають помітними
деталі поверхні розміром у десятки нанометрів. |
|
|
|
|
|||||
При |
аналізі |
та |
обробці |
зображень, одержаних |
методами |
СЗМ, |
|||
використовують |
цифрові |
методи |
збереження |
інформації. У |
комп’ютері |
||||
інформація представляється у вигляді двомірної матриці цілих чисел, кожне з яких (залежно від режиму сканування) може бути значенням тунельного струму чи значенням відхилення мікроманіпулятора, чи значенням якоїсь більш складної функції. Далі числа вихідної матриці перевтілюють у сприйнятливий
вигляд: |
між мінімальним і максимальним значенням визначають діапазон, |
якому |
співставляється кольорова палітра. Таким чином, кожне значення |
матриці відображається в точку певного кольору на прямокутному зображенні. Рядок і стовпчик, в яких знаходиться це значення, стають координатами точки. В результаті отримують картину, на якій, наприклад, висота поверхні передається кольором – як на географічній карті. Кількість кольорів при цьому
– сотні і тисячі.
Залежно від розміру об’єкта, що необхідно розглянути, використовують різні методи обробки зображень:
віднімання середнього нахилу – у разі наявності певного нахилу, що заважає виявленню структури об’єкта, із вихідної матриці значень віднімається площина середнього нахилу. У результаті одержують матрицю з меншим діапазоном значень і дрібні деталі відображаються більшою кількістю кольорів та стають більш помітними.
усереднення значень всіх точок матриці та навколишніх у випадку наявності високочастотного вихідного сигналу. Це дозволяє збільшити рівень розмірів навколишньої області, по якій проводиться усереднення.
медіанна фільтрація дозволяє відсортувати різки відхилення числових значень.
усереднення по рядках застосовують при появі дефектів зображення внаслідок швидкого зчитування інформації і зсуву числових рядків матриці вверх або вниз. Всі рядки зображення здвигаються вверх або вниз так, щоб їх значення були однаковими. При цьому профіль рядка залишається попереднім, а профіль стовпчика – змінюється за рахунок прибирання сходинок.
ефект |
освітлення |
моделюють |
для |
|
підвищення |
контрастност |
||
зображення дрібних деталей зі збереженням інформації про крупні об’єкти. |
|
|||||||
Зазвичай перспективними є ті сучасні |
комп’ютерні програми, які |
|||||||
дозволяють на екрані монітора побачити одночасно різні зображення, чи одне і |
||||||||
те ж, – але на різних стадіях його математичного оброблення. |
|
|
||||||
Морфологія |
дріжджів. |
Дріжджі |
|
|
|
|
|
|
Термін “дріжджі” |
не |
має |
таксономічного |
|||||
значення. До |
цієї |
групи мікроорганізмів належать |
мікроскопічні одноклітинні |
|||||
вищі гриби, які розмножуються переважно брунькуванням або поділом. Таке визначення є недостатньо точним, оскільки окремі видидріжджів здатні в певній фазі розвитку утворювати міцелій, а деякі мікроскопічні міцеліальні
19

гриби в певних умовах культивування ростуть у дріжджоподібній формі. Проте
переважне |
їх існування у вигляді одноклітинних |
форм дає можливіст |
|||
розглядати дріжджі як окрему групу еукаріотних мікроорганізмів. Клітини |
|||||
дріжджів |
мають |
різноманітну |
форму: круглу, |
овальну |
(Trichosporon), |
яйцеподібну |
(Candida), циліндричну |
(Endomyces), |
трикутну (Trigonopsis), |
||
лимоноподібну (Nadsonia), грушоподібну (Schizoblastoporium), стрілоподібну
(Brettanomyces), серпоподібну (Selenotila).
Для деяких дріжджів форма клітин настільки характерна, що може бути використана для встановлення їх родової належності(наприклад, у Trigonopsis клітини трикутні). У представників роду Candida, навпаки, морфологія клітин не постійна, вона змінюється залежно від складу середовища таумов культивування, тому не може використовуватись як таксономічна ознака. Розміри дріжджових клітин також варіюють у широких межах, мкм: діаметр найдрібніших клітин становить 1,5–2,0, довжина – 3–5, діаметр великих клітин
– 8–10, їх довжина – 11–18, довжина витягнутих клітин може досягати 20–25.
Способи розмноження дріжджів. Дріжджі розмножуються безстатевим (вегетативне розмноження і утворення безстатевих спор) і статевим способом (таблиця).
Розмноження мікроорганізмів (органи розмноження)
Мікро- |
Способи розмноження |
|
|
|
|
|||
організми |
|
|
|
|
|
|
|
|
Безстатеве |
|
|
Статеве |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
Варіанти: |
Утворення статевих спор: |
|
|
|
|||
|
брунькування (найчастіше); |
ендогенні |
(аскоспори |
|
у |
|
||
Дріжджі |
поділ (рідко); |
Ascomycetes); |
|
|
|
|
|
|
|
утворення безстатевих спор |
екзогенні (споридії у |
|
|
|
|
||
|
(хламідоспори, балістоспори) |
Basidiomycetes) |
|
|
|
|
||
|
Варіанти: |
Утворення статевих спор: |
|
|
|
|||
Гриби |
фрагментація міцелію; |
Ооспори |
(утворюються |
|
при |
|||
|
брунькування; |
злитті жіночої гамети оогонія та |
||||||
|
утворення безстатевих спор: |
чоловічої |
|
антеридія), |
клас |
|||
|
а) екзогенні (конідії) |
Oomycetes; |
|
|
|
|
|
|
|
б)ендогенні (спорангіоспори) |
Зигоспори |
(утворюються |
|
при |
|||
|
|
злитті |
морфологічно |
однакових |
||||
|
|
жіночої та чоловічої гамет), клас |
||||||
|
|
Zygomycetes; |
|
|
|
|
|
|
|
|
Аскоспори |
(утворюються |
|
|
в |
||
|
|
асках), клас Ascomycetes; |
|
|
|
|
||
|
|
Базидіоспори (утворюються |
на |
|||||
|
|
спеціальних |
виростах – |
базидіях), |
||||
|
|
клас Basidiomycetes) |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
20
Розрізняють |
|
три |
типивегетативного |
|
розмноження |
дріжджів: |
|
||||||||||
брунькування, поділ |
і |
брунькування, що закінчується поділом. Спосіб |
|
||||||||||||||
вегетативного розмноження є важливим таксономічним критерієм для поділу |
|
||||||||||||||||
дріжджів родини Saccharomycetaceae на підродини. |
|
|
|
|
|
|
|
|
|||||||||
Для представників підродиниShizosaccharomycetoideae є характерним |
|
||||||||||||||||
розмноження |
поділом – подовження |
клітини |
з |
одного |
кінця |
з |
наступним |
||||||||||
утворенням поперечної перегородки без звуження. У процесі брунькування, що |
|
||||||||||||||||
закінчується поділом, або біполярного брунькування (підродина Nadsonioideae) |
|
||||||||||||||||
формування дочірніх клітин починається з утворення бруньки на вужчій основі, |
|
||||||||||||||||
ніж у Shizosaccharomycetoideae, і закінчується появою в основі бруньки |
|
||||||||||||||||
перегородки. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У процесі брунькування зрілі бруньки можуть не |
|
відділятися |
від |
||||||||||||||
материнської клітини і утворюють грона або ланцюжки клітин. Це призводить |
|
||||||||||||||||
до формування псевдоміцелію. Справжній міцелій утворюється |
лише |
у |
|||||||||||||||
дріжджів, здатних до розмноження поділом. Міцелій може розпадатися на |
|
||||||||||||||||
частини, в результаті чого формуються одноклітинніартроспори |
– оідії. |
|
|||||||||||||||
Утворення міцелію з пряжками характерне для базидіоміцетних дріжджів. |
|
|
|||||||||||||||
Утворення безстатевих спор. Ендоспори |
– |
вегетативні |
клітини, які |
|
|||||||||||||
формуються всередині клітини або гіфи. Їх можна спостерігати в старих |
|
||||||||||||||||
культурах дріжджів, вирощених на сусло-агарі, картопляному агарі, солодово- |
|
||||||||||||||||
дріжджовому |
агарі. |
Утворюються |
|
у |
дріжджівCandida, |
Trichosporon, |
|
||||||||||
Cryptococcus, |
Oosporidium. У деяких |
видів |
дріжджів(Candida |
albicans, |
C. |
|
|||||||||||
tropicalis, |
представників |
роду Metschnikowia, |
|
іноді |
у |
Trichosporon |
і |
|
|||||||||
Cryptococcus) |
формуються |
хламідоспори. |
Це |
товстостінні |
нестатевого |
|
|||||||||||
походження спори, що утворюються термінально або інтеркалярно в результаті |
|
||||||||||||||||
округлення |
клітин. Містять |
багато |
ліпідів. Утворення балістоспор – |
один |
із |
|
|||||||||||
способів |
безстатевого |
розмноження, що |
притаманний |
дріжджам |
родів |
||||||||||||
Sporobolomyces, Bullera, Sporidiobolus. Ці спори формуються на спеціальних |
|
||||||||||||||||
загострених виростах вегетативних клітин– стеригмах і при дозріванні |
|
||||||||||||||||
викидаються у повітря. Мають характерну форму – шароподібну, серпоподібну, |
|
||||||||||||||||
лимоноподібну, яйцеподібну. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Статеве розмноження дріжджів. За |
|
статевого |
|
розмноження |
в |
||||||||||||
результаті |
мейотичного |
поділу диплоїдного ядра дріжджів утворюються |
|||||||||||||||
гаплоїдні спори – аскоспори (ендогенні) та споридії (екзогенні). Дріжджі – |
|
||||||||||||||||
різностатеві організми, тому розрізняють гомоталічні (злиття потомків однієї |
|
||||||||||||||||
спори чи особин, які утворилися з однієї і тієї самої гаплоїдної клітини) та |
|
||||||||||||||||
гетероталічні (злиття, або |
кон’югація, між |
клітинами – |
потомками |
різних |
|
||||||||||||
гаплоїдних |
|
клітин). |
|
Аскоспори |
утворюються |
|
аскоміцетними |
дріжджами. |
|
||||||||
Найчастіше |
|
в аску |
(сумці) |
міститься від 1 до 4–8 спор (Saccharomyces, |
|
||||||||||||
Saccharomycoides), |
інколи |
кілька |
десятків(Lipomyces, |
Kluyveromyces). |
|
||||||||||||
Морфологічна різноманітність аскоспор є таксономічною ознакою.
21
|
|
Гриби |
|
|
Гриби – це |
еукаріотичні |
організми, серед |
яких |
зустрічаються |
одноклітинні, нитчасті та міцеліальні форми. Мікроскопічні міцеліальні гриби називаються також мікроміцетами, пліснявими грибами.
Вегетативне тіло гриба (талом) складається з ниток затовшки близько 5 мкм – гіфів. Сукупність гіфів грибного талома називається м і ц е л і є м. Міцелій буває субстратним, коли гіфи вростають у поживне середовище, повітряним – гіфи піднімаються над субстратом. Гіфи можуть не мати поперечних перегородок (утворюють несептований міцелій) і можуть бути розділені такими перегородками (септами) на клітини (утворюють септований
міцелій). Однак у цьому разі цитоплазма однієї клітини сполучається з цитоплазмою сусідньої клітини через пору, яка міститься у центрі перегородки.
До нижчих грибів (фікоміцетів) належать гриби, вегетативні тіла яких (навіть за сильного розгалуження гіфів) не мають перегородок і тому є багатоядерними. Такий талом називаютьценоцитним. До нижчих грибів належать хітридіоміцети, ооміцети, зигоміцети. До вищих грибів (еуміцетів) належать аскоміцети, базидіоміцети, дейтероміцети. Для вищих грибів є характерними гіфи, розділені поперечними перегородками. Слід зазначити, що
у сучасній філогенетичній класифікації грибів(Hibbett et al., 2007) за результатами молекулярно-біологічних та генетичних досліджень ооміцети виведені з царства грибів, а дейтероміцети не існують як окремий таксон, вони розміщені серед аскота базидіоміцетних грибів.
Гіфи грибів |
ростуть |
з |
подовженням |
кінчиків(апікальний ріст). |
У |
|||
більшості грибів будь-яка |
частина міцелію |
здатна |
до . |
ростуДля посіву |
||||
достатньо маленького кусочка міцелію, як утворюється новий талом. |
|
|||||||
Розмножуються |
гриби |
двома способами– |
статевим |
та безстатевим |
||||
(див. таблицю). |
|
|
|
|
|
|
|
|
Безстатеве розмноження |
грибів здійснюється зазвичай |
за допомогою |
||||||
спор, брунькуванням |
чи |
фрагментацією |
міцелію. |
Найпоширенішим |
і |
|||
найдиференційованішим є спороутворення (рис. 2.1). Безстатеві спори бувають |
|
|||||
екзогенними (конідії) та ендогенними (спорангіоспори). |
Утворення |
конідій |
||||
характерне для грибів родівPenicillium, |
Aspergillus, спорангіоспор |
– для |
|
|||
представників Mucor, Rhizopus. |
|
|
|
|
|
|
Органами статевого |
розмноження грибів |
є |
спори(зигоспори |
у |
||
зигоміцетів, аскоспори у аскоміцетів та базидіоспори у базидіоміцетів). |
|
|
||||
У природі гриби дуже розповсюджені. Спори грибів виявляються у будь- |
|
|||||
яких екосистемах, техногенних потоках |
і продуктах. Найбільша кількість |
|||||
грибів зустрічається у грунті. Вони беруть активну участь у біогеохімічному циклі перетворення вуглецю і належать як до зимогенної, так і автохтонної
мікрофлори. Серед великого різноманіття грибів є |
невелика група водних |
грибів і досить обширна група паразитичних |
, грибівякі спричиняють |
захворювання людини, тварин і рослин. |
|
22
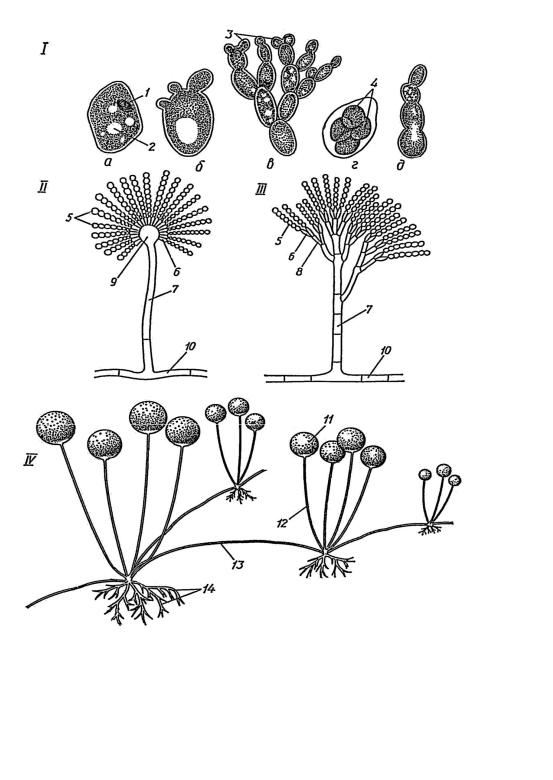
Рис. 2.1. Морфологія мікроскопічних грибів:
I – дріжджі; II – аспергіл; III – пеніцил; IV – ризопус; а – клітина в стані спокою; б, в – клітина під час брунькування; г – аскоспори; д – утворення нової особини; 1 – ядро; 2 – вакуоль; 3 – бруньки; 4 – аскоспори; 5 – конідії; 6 – стеригми; 7 – конідіофор; 8 – метули; 9 – булавоподібне розширення конідієносця; 10 – вегетативна гіфа; 11 – спорангій; 12 – спорангіофор; 13 – столон; 14 – ризоїди.
Гриби |
здатні |
виділяти |
у |
навколишнє |
середовище |
ферменти |
|||
абсорбційним |
|
шляхом |
поглинати |
поживні , |
продуктречовини |
||||
ферментативного |
гідролізу природних |
біополімерів |
та |
інших |
розчинних |
||||
речовин. Такий |
|
тип |
живлення |
визначає |
положення |
грунтових |
грибів як |
||
найбільшу екологічну групу, що бере участь у мінералізації органічних речовин в екосистемах.
23
|
|
|
|
|
|
Будова дріжджової і грибної клітини |
|
|
|
|
||||||||
Дріжджова |
і |
грибна |
клітина – це |
типова еукаріотична |
клітина, яка |
|
||||||||||||
складається з клітинної стінки, цитоплазми з цитоплазматичною мембраною та |
|
|||||||||||||||||
органелами (ендоплазматичний ретикулум, діктиосоми, лізосоми, мікротільця, |
|
|||||||||||||||||
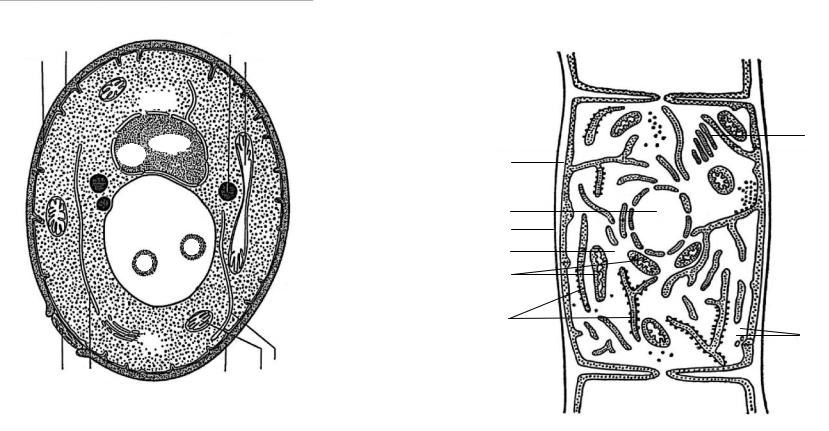
мітохондрії, рибосоми, включення, вакуолі, ядро) (рис. 2.2 |
і 2.3). Ядро |
чітко |
|
|||||||||||||||
відособлене і оточене мембраною. |
|
|
|
|
|
|
|
|
|
|
||||||||
Клітинна |
|
стінка |
грибівмістить |
близько 80–90 |
% |
полісахаридів, |
|
|||||||||||
зв’язаних з білками, ліпідами, поліфосфатами, пігментами. Вона складається з |
|
|||||||||||||||||
кількох шарів (зовнішнього та внутрішніх, або |
первинної та |
вторинної |
||||||||||||||||
клітинної |
стінки). |
|
Матричні |
(скелетні) структури |
(або |
первинна |
стінка) |
|
||||||||||
складаються з хітину та целюлози, зовнішній шар (вторинна стінка), – як |
|
|||||||||||||||||
правило, з |
глюканів |
з |
різними типами зв’язку у різних таксонів. грибів |
|||||||||||||||
Наприклад, |
целюлозо-хітиновий комплекс |
переважає |
у |
клітинних стінках |
||||||||||||||
багатьох видів зигоміцетів, целюлозно-глюкановий |
– |
у |
ооміцетів, хітозан- |
|
||||||||||||||
хітиновий – у деяких видів ооміцетів, хітино-глюкановий – у хитридіоміцетів, |
|
|||||||||||||||||
аскоміцетів, базидіота |
дейтероміцетів. У складі клітинних стінок грибів |
|||||||||||||||||
виявлені також полісахариди, які містять глюкуронову кислоту, а також |
|
|||||||||||||||||
гетерополісахариди, |
що |
містять |
манозу, |
галактозу, |
глюкозу, |
глюкуронову |
|
|||||||||||
кислоту. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Клітинна |
|
|
стінка |
дріжджів. Дріжджова |
|
клітина |
|
відділена |
від |
|||||||||
зовнішнього середовища клітинною стінкою завтовшки70–350 нм. Основним |
|
|||||||||||||||||
компонентом клітинної стінки дріжджів є полісахариди(до 60–70 % сухої |
|
|||||||||||||||||
маси). Крім полісахаридів, у складі клітинної стінки виявлено білки(6–13 %), |
|
|||||||||||||||||
ліпіди |
(2–9 |
%) |
та |
неорганічні |
поліфосфати. Основними |
структурними |
|
|||||||||||
одиницями полісахаридів є переважно глюкоза і маноза. Як приклад, на рис. 9.1 |
|
|||||||||||||||||
показана клітинна |
стінка |
хлібопекарських дріжджівSaccharomyces cerevisiae, |
|
|||||||||||||||
яка |
складається |
|
з |
фосфоманану, манану, глюкану |
та |
білків. Крім |
|
|||||||||||
гомополімерів, |
клітинні |
стінки дріжджів можуть містити ігетерополімери. |
|
|||||||||||||||
Так, |
галактоманани |
є |
складовими клітинних стінок у дріжджів роді |
|||||||||||||||
Trichosporon, Torulopsis. У деяких видів базидіоміцетних дріжджів виявлено |
|
|||||||||||||||||
ксиломанани. |
До |
|
|
складу |
клітинних |
|
стінок |
|
дріжджів |
|
входить |
тако |
||||||
амінополісахарид хітин. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Ядро оточене ядерною мембраною(двошарова перфорована мембрана). |
|
|||||||||||||||||
ДНК (носій генетичної інформації) розподілена між хромосомами. |
|
|
|
|||||||||||||||
Мітохондрії |
|
– |
сферичні |
чи |
паличкоподібні |
структури, оточені |
|
|||||||||||
двошаровою мембраною. Складки внутрішньої мембрани утворюють кристи. |
|
|||||||||||||||||
Внутрішня мембрана містить компоненти електрон-транспортного ланцюга та |
|
|||||||||||||||||
АТФ-синтазу. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ендоплазматичний |
ретикулум являє |
собою |
систему |
мембранних |
||||||||||||||
пластин, каналів, бульбашок і цистерн, оточених елементарною мембраною. Функції: забезпечення внутрішньоклітинного транспорту поживних речовин до місць проходження синтетичних реакцій, участь в обміні вуглеводів, синтезі ліпідів та інших важливих метаболічних процесах.
24
|
К Ст |
|
Ж |
|
||
ПМ |
|
|
|
|
|
Міт |
|
|
|
|
|
||
Цпл
Ядр Яч о
Вакуоль
П
П
25
|
|
|
|
Д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЕР |
|
Руб |
|
|
|
|
|
|
|
Міт |
|
|
|
ЕР |
|
||||||||
|
|
|
|
|
|
|
||||
|
|
|
|
К Ст |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.2. Схематичний поперечний розріз
дріж дж ової клітини:
Д – діктиосома; Ж – жирові включення; КСт – клітинна стінка; Міт – мітохондрія; П
– гранули поліфосфату; ПМ – плазматична мембрана; Руб – рубець, який залишився
після брунькування; Цпл – цитоплазма; ЕР –
ендоплазматичний ретикулум; Яч – ядречко
1
10
9 |
|
|
|
|
2 |
|
|
|
|
||
|
|
|
|
|
|
8
7
6
5
4
3
Рис. 2.3. Схема будови грибної клітини:
1 – апарат Гольдж і (діктиосоми); 2 – рибосоми; 3 – ломасоми; 4 – ендоплазматична сітка; 5 – мітохондрії; 6 – цитоплазма; 7 – клітинна стінка; 8 – ядро; 9 – ядерна оболонка; 10 – цитоплазматична мембрана
До мембранних систем клітини належитьапарат Гольджі – агреговані бульбашки або пластинки (діктиосоми) різних розмірів, які розміщуються біля
ядерної мембрани, перегородок гіфів, конідій. |
|
|
|
|
||||
Лізосоми – |
внутрішньоклітинні |
органели, оточені |
ліпопротеїдною |
|||||
мембраною. |
Вони |
містять |
набір |
|
ферментів, які |
гідролізують |
білки, |
|
полісахариди та нуклеїнові кислоти. |
|
|
|
|
|
|||
Мікротільця – умовна |
назва органел– пероксисом, |
гліоксисом |
та ін. |
|||||
Мікротільця містять більш як20 різних |
|
ферментів. |
Так, |
у пероксисомах |
||||
містяться |
каталаза |
та пероксидаза. Крім |
того, в |
мікротільцях містяться |
||||
ферменти b-окиснення жирних кислот, гліоксилатного циклу, дегідрогенази та
ін. |
|
|
|
У вакуолях |
містяться |
гідролітичні |
ферменти, поліфосфати, ліпіди, |
низькомолекулярні |
клітинні |
інтермедіати |
та іони металів. Ймовірно, що |
вакуоль діє як резервуар для зберігання поживних речовин і гідролітичних
ферментів. |
|
|
|
|
|
|
|
|
|
|
|
Включення |
– запасні |
речовини, якими |
у |
дріжджів |
є |
глікоген |
|||||
(Saccharomyces, Cryptococcus), поліфосфати (волютин) (Saccharomyces), жири у |
|
||||||||||
вигляді окремих крапель (Trichosporon) або однієї ліпідної вакуолі (Lipomyces). |
|
||||||||||
Основною запасною речовиною у грибів єглікоген, який розміщений у |
|
||||||||||
вигляді дрібних гранул по всій цитоплазмі. Поліфосфати |
– містяться у |
|
|||||||||
колоїдному стані у вакуолях. Їх вміст у клітині становить до22 % вмісту всіх |
|
||||||||||
мінеральних компонентів. Ліпіди та жирові речовини містяться у клітині у |
|
||||||||||
вигляді крапельок, які називаються ліпосомами. |
|
|
|
|
|
|
|||||
|
|
|
Завдання на виконання |
|
|
|
|
|
|||
1. Приготувати препарати «роздавлена крапля» дріжджів |
Saccharomyces |
|
|||||||||
cerevisiae, Saccharomycoides ludwigii, Shizosaccharomyces pombe, |
розглянути під |
|
|||||||||
мікроскопом, виявити |
клітини, які |
діляться, |
описати |
|
способи |
|
поділу, |
|
|||
замалювати. |
|
|
|
|
|
|
|
|
|
|
|
Препарат «роздавлена крапля» готується на знежиреному предметному |
|
||||||||||
склі, на яке наносять маленьку краплю водопровідної води. З дотриманням |
|
||||||||||
правил асептики бактеріологічною петлею у воду вносять невелику кількість |
|
||||||||||
культури дріжджів, розмішують і накривають накривним скельцем. Не слід |
|
||||||||||
вносити |
велику |
кількість |
культури, оскільки |
препарат |
буде |
|
густим |
і |
|||
малопридатним для спостереження. Не можна допускати утворення бульбашок повітря під накривним склом; за надлишку води її видаляють фільтрувальним папером. Мікроскопування здійснюють з сухою системою.
2.Приготувати препарати “роздавлена крапля” дріжджів Candida scottii, Rhodotorula glutinis, Trichosporon cutaneum, розглянути під мікроскопом,
замалювати клітини, що брунькуються, псевдоміцелій, бластоспори.
3.Приготувати на предметному склі препарати грибів Rhizopus nigricans, Aspergillus niger, Fusarium culmorum, Trichotecium roseum. Розглянути під мікроскопом, замалювати міцелій, спорангієносці, конідієносці та конідії.
26
Вивчення морфологічних особливостей міцеліальних грибів можна здійснювати безпосередньо на чашках Петрі за малого збільшення(10х). Для приготування препаратів грибів за допомогою препарувальної голки вирізають шматочок міцелію (0,5 мм2) і обережно поміщають його у краплю води на предметне скло. Зверху на міцелій кладуть накривне скельце. Якщо вода не повністю оточує досліджуваний міцелій, слід добавити її з крапельниці під накривне скельце до повного занурення міцелію. Надлишок води видаляється фільтрувальним папером.
За малого збільшення можна побачити конідієносці. Їхню детальну будову вивчають з об’єктивом40х. Спорангії за такого способу зазвичай руйнуються і видно лише скупчення спор. Для виявлення незруйнованих спорангіїв слід обережно взяти препарувальною голкою невелику кількість міцелію і другою голкою зняти його на сухе предметне .склоРозглядаючи препарат без накривного скельця за малого збільшення можна побачити спорангієносці і круглі темні кульки на їхніх кінцях − спорангії.
Контрольні запитання
1.У чому полягає суть скануючої зондової мікроскопії?
2.Які дослідження дає змогу проводити метод скануючої зондової мікроскопії?
3.Що таке «дріжджі»? На основі яких ознак дріжджі належать до грибів?
4.Як поділяються дріжджі за морфологією і розмірами клітин?
5.Охарактеризуйте вегетативне розмноження дріжджів.
6.Як здійснюється безстатеве розмноження дріжджів?
7.Охарактеризуйте статеве розмноження дріжджів.
8.Які сполуки входять до складу клітинної стінки дріжджів?
9.Які функції виконує капсула дріжджових клітин?
10.Охарактеризуйте функції інших структурних компонентів дріжджової
клітини.
11.Що таке таллом?
12.На основі яких ознак гриби поділяються на вищі та нижчі?
13.Які вегетативні способи розмноження грибів Ви знаєте?
14.Охарактеризуйте безстатевий спосіб розмноження грибів.
15.У чому полягає суть статевого способу розмноження грибів?
16.Які функції виконують структурні компоненти грибної клітини?
17.Як готується препарат «роздавлена крапля» ?
18.Як можна здійснювати дослідження морфології грибів?
19.Як можна виявити конідіє- і спорангієносці у грибів?
27
