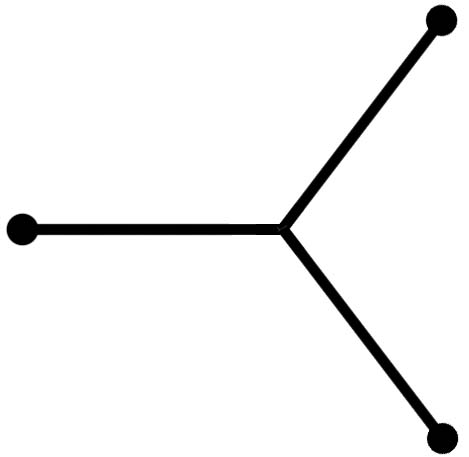
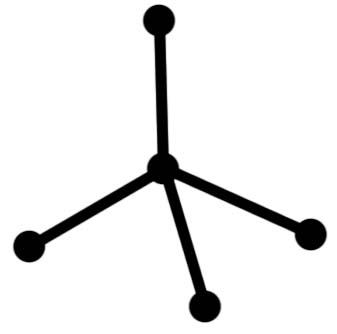
Типы гибридизации ао и структура молекул
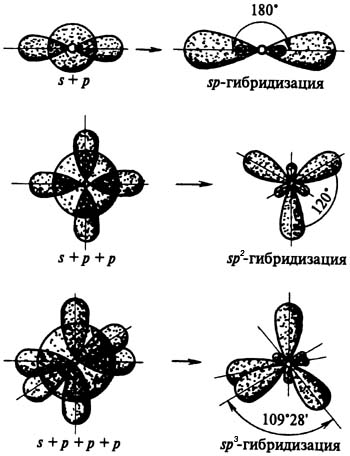
Орбитали, участвующие в гибридизации |
Тип гибридизации |
Структура молекулы |
Валентный угол |
s +p |
sp |
Линейная |
180о |
s+p+p |
sp2 |
плоский треугольник |
120о |
s+p+p+p |
sp3 |
тетраэдр |
109,3о |
Молекула ВеСl2
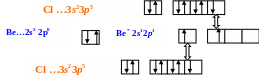
■ sp-гибридизация АО Ве , 180о
■ пространственная структура линейная.
![]()
Cl Be Cl
■ связь полярная св 0, т.к. ЭО Ве и Cl: 1,5 и 3,0
Cl Be Cl
■ мол = св = 0 молекула в целом неполярная.
Молекула ВН3
 В
2s1
2p2
В
2s1
2p2
H 1s H 1s H 1s
■ s-s перекрывание и два p-s перекрывания АО.
■
sp2–гибридизация
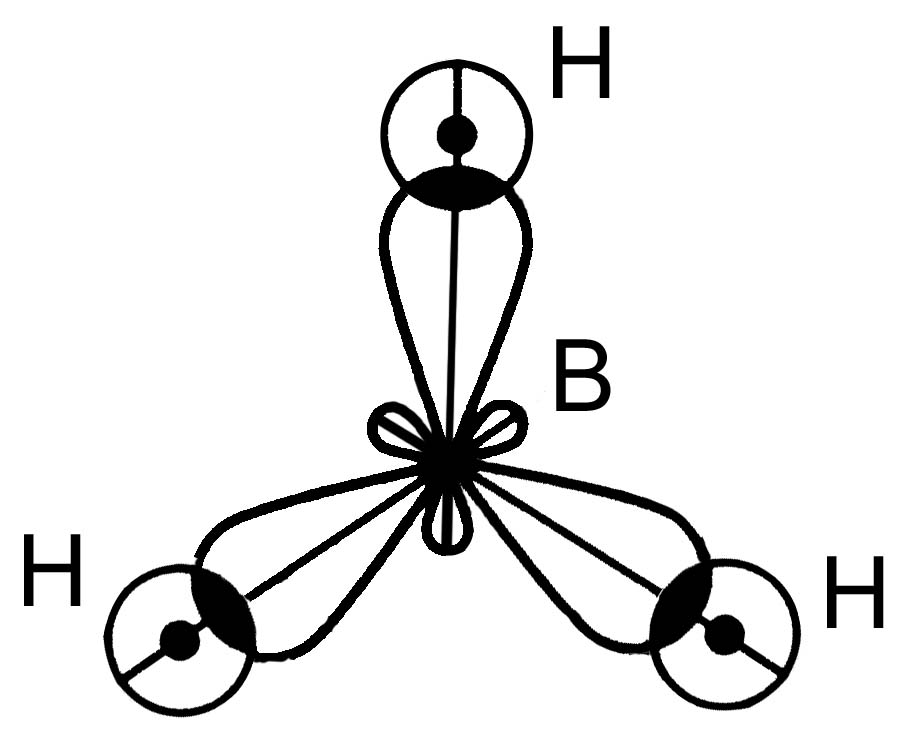
АО В
■ 3 - связи, 120 ,
■ связи полярные ЭО = (2.1-2.0) 0.
■ структура молекулы - плоский треугольник.
■ мол = св = 0 молекула ВН3 - неполярная.
Молекула SiCl4
Si 3s 3p Cl 3s 3p

Cl 3s 3p Cl 3s 3p Cl 3s 3p
■ 1 s-АО и 3 р-АО sp3- гибридизация АО
■ структура молекулы тетраэдр, 109,30
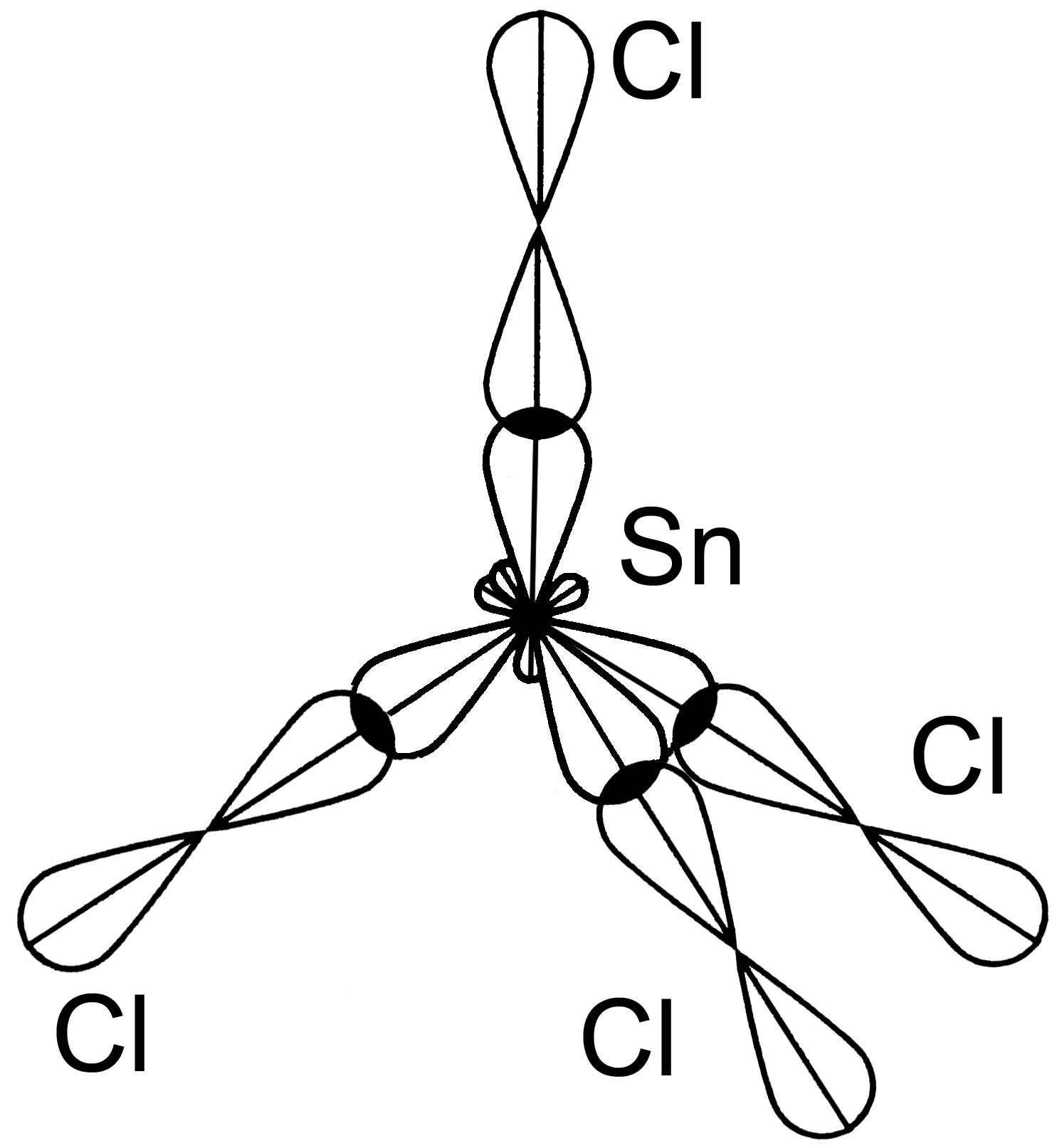
■ св= 0 - молекула в целом неполярная.
►Вывод:
▓ если
гибридные АО центрального атома
взаимодействуют
с
АО одинаковых
атомов,
то молекула
неполярная
(СН4,
ВF3). ▓
если гибридные
АО взаимодействуют с разными
атомами
(CH2Cl2,
ВF2Cl),
то молекулы
полярные,
т.
к. величины векторов электрических
моментов
диполей связей
отличаются.
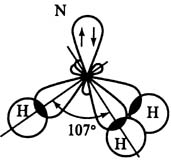
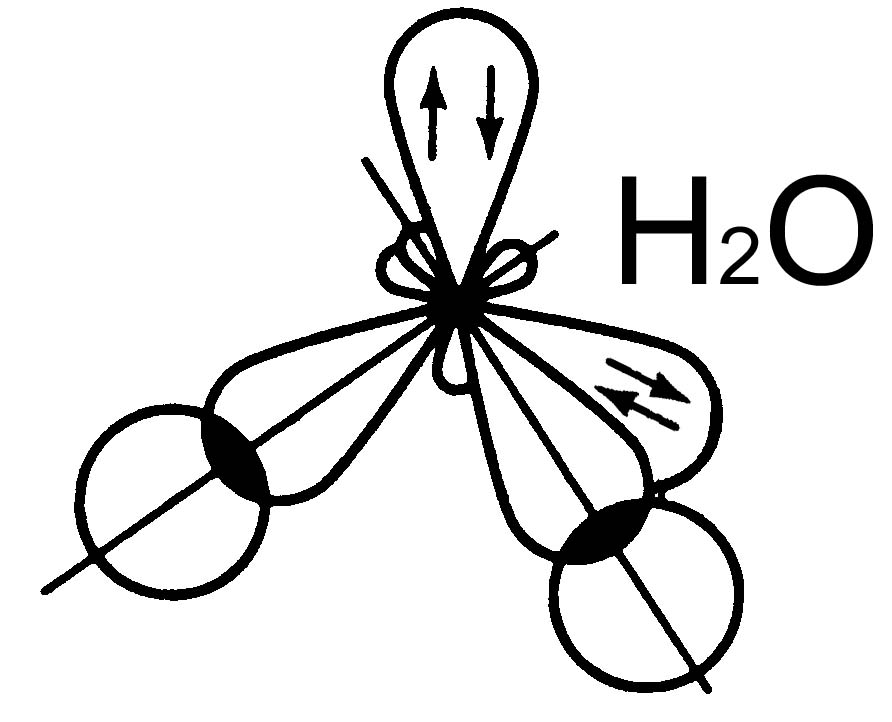
Молекулы NН3 и Н2О
N …2s22p3
O…2s22p4
…2s22p3
O…2s22p4

H 1s1 H 1s1 H1s1 Н 1s1 Н 1s1
Структура молекул – тетраэдр. Метод ВС не объясняет структуру молекул, определенную методом рентгеноструктурного анализа
sp3 – гибридизация АО азота «N» и кислорода «О».
В 1957 г. Р.Гиллеспи предложил модель отталкивания электронных пар валентной оболочки (ОВЭП)
● Модель предполагает, что электронные пары в валентной оболочке существуют в виде локализованных связывающих и неподеленных пар.
● Несвязывающие и σ- связывающие электронные пары рассматриваются как равноценные.
● В гибридизации могут участвовать вакантные АО, АО с неподеленными парами электронов и АО с неспаренными электронами.
● Неподеленные электронные пары (НП) влияют на величину валентных углов силы отталкивания между ними больше, чем между относительно закрепленными электронными парами образующими связь (связывающая электронная пара - СП).
● Уменьшение силы отталкивания электронных пар:
НП-НП НП-СП СП-СП
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о, а в молекуле Н2О две НП уменьшают его до 104,5о.
связь,
образованная в результате электростатического
взаимодействия ионов ■
предельный
случай полярной ковалентной связи
анион
А-,
катион К+
▬ насыщаемостью ▬
направленностью ▬
повышенной
электронной
плотностью в области
связывания
Ионная связь не обладает
: ▼ Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион.
▼ Сила взаимодействия ионов определяются величиной их заряда и расстоянием между ними по закону Кулона.
▼ Ион окружает себя наибольшим числом ионов противоположного заряда в определенном порядке, позволяющем занять минимально возможный объем с минимальной потенциальной энергией.
Ионные кристаллы - гигантские полимерные молекулы.
▼ Понятие валентности к ионной связи неприменимо.
Чисто ионная связь не существует - доля ионности связи ( Na+0.9Cl-0.9 )
▼ Ионные связи - прочные.
▼ Твердые кристаллические вещества ионного типа - тугоплавкие, высокопрочные, но хрупкие, растворяются в полярных растворителях (в Н2О).
Формулы (NаСl, СаF2, Аl2(SО4)3 ) - отражают лишь состав.