

Химическая
связь
- различные виды взаимодействий между
электронами и ядрами, приводящие к
соединению атомов в новые устойчивые
структуры: молекулы, ионы, радикалы,
кристаллические и другие вещества
Условия образования химической связи:


-











В основе классификации типов лежит разное распределение электронной плотности между ядрами
ПРАВИЛО
ОКТЕТА При
образовании химической связи атомы
приобретают такую же электронную
конфигурацию, как у благородных газов
(кроме Не) – на внешней оболочке восемь
электронов (октет)


Количество энергии,
выделяющееся при образовании химической
связи и характеризующее ее прочность. Молекула
СН4
Есв = 1640 : 4 = 410 кДж/моль Чем
больше энергия химической связи, тем
устойчивее молекулы

Межъядерное
расстояние взаимодействующих атомов. Она
зависит от размеров электронных оболочек
и степени их перекрывания.

Количество связей
между взаимодействующими атомами
молекула |
связь |
Есв, кДж /моль |
lсв, нм |
вывод |
F2 |
F – F |
159,0 |
0,142 |
Чем меньше lсв, тем больше Есв и устойчивее молекула |
H2 |
H – H |
436,0 |
0,074 |
|
О2 |
О О |
498,7 |
0,120 |
Чем выше кратность связи, тем больше Есв и устойчивее молекула |
N2 |
N N |
945,6 |
0,109 |
Связь
|
ЕСВ кДж/ моль |
lСВ нм |
|
Связь
|
ЕСВ кДж/моль |
lСВ нм |
H-F
H-Cl
H-Br H-I H-H H-S |
536
432
360 299 436 380 |
0.092
0.128
0.142 0.162 0.074 0.134 |
|
C-C
C=C
O=O -CC- CO NN |
348
614
495 839 1040 940 |
0.154
0.134
0.121 0.120 0.113 0.110 |

Угол между
воображаемыми прямыми, проходящими
через ядра химически связанных атомов
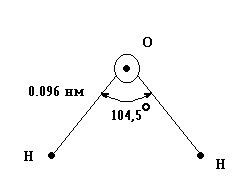 В
молекуле Н2О
длина связи Н-О
равна
0,096 нм, угол связи Н-О-Н
– 104,5, а энергия связи Есв
= 464 кДж/моль.
В
молекуле Н2О
длина связи Н-О
равна
0,096 нм, угол связи Н-О-Н
– 104,5, а энергия связи Есв
= 464 кДж/моль.
![]()
Химическая
связь, образованная в результате
обобществления валентных электронов
в области связывания (между ядрами
атомов)
«Ковалентная» - совместно действующая
Существует несколько квантово-механических подходов к описанию ковалентной связи: метод валентных связей (ВС), метод молекулярных орбиталей (МО )и др..

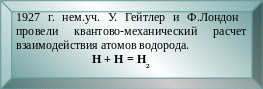
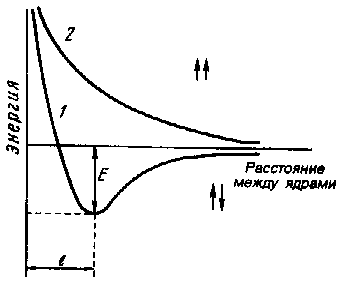
Зависимость
энергии системы
из 2-х атомов водорода с антипараллельными
(1)
и параллельными (2)
спинами
Е
– энергия связи
Из
уравнения Шредингера
Есист
=
f
(r
),
где r-
расстояния между ядрами атомов водорода. (кривая
1): • При
сближении двух атомов электроны с
антипараллельными спинами притягиваются
одновременно двумя протонами - Fпритяжения • Два
электрона отталкиваются друг от друга,
то же наблюдается и для двух протонов
- Fотталкивания Fпритяжения
Fотталкивания
Есист
- уменьшается
При
некотором расстоянии между ядрами (r
=
lсв)
Есист=
min
- система
наиболее устойчива
химическая связь
Н2
(кривая
2):
При
сближении атомов, у электронов которых
спины параллельны
Fпритяжения
Fотталкивания
Есист
- возрастает

◄ химическая
связь - результат перекрывания АО с
образованием связывающих электронных
пар (обобществление двух электронов);
◄
химическая
связь образуется только при взаимодействии
электронов с антипараллельными спинами
(по принципу Паули);
◄
связь
направлена в сторону максимального
перекрывания АО реагирующих атомов.
◄
характеристики
химической связи (энергия, длина,
полярность и др.) определяются типом
перекрывания АО;







► Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону.
► Донорно-акцепторный механизм - образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Ион аммония NН4+ (NН3 + Н+ NН4+)

►Дативные связи – образуются, когда АО, могут выступать одновременно в роли и донора и акцептора неподеленных пар электронов.
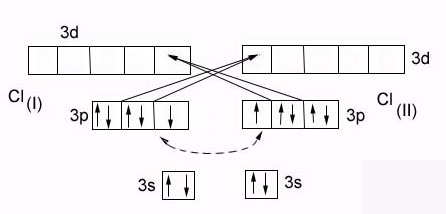 Образование
молекулы Cl2
Образование
молекулы Cl2
Энергия связи в молекуле Сl2 ( 243 кДж/моль) выше, чем в молекуле F2 (159 кДж/моль), несмотря на большую длину связи.









Молекула NaI
3s -АО атома Na перекрываются с 5p – АО атома иода, имеющими по одному неспаренному электрону:


s-p
-
сперекрывание
Механизм образования связи - обменный.
Валентный угол 180о, структура молекулы - линейная
связь, находящаяся
на воображаемой линии, соединяющей
ядра взаимодействующих атомов
Связь называется - - связь:
Молекула оксида углерода (II) СО
Между атомами углерода и кислорода образуются 3 связи:
■ две по обменному механизму и
■ одна по донорно-акцепторному механизму:
«O» - донор, «C»- акцептор.
3 ковалентные связи образуются за счет перекрывания 3-х р-АО каждого атома.
Структура молекулы – линейная.
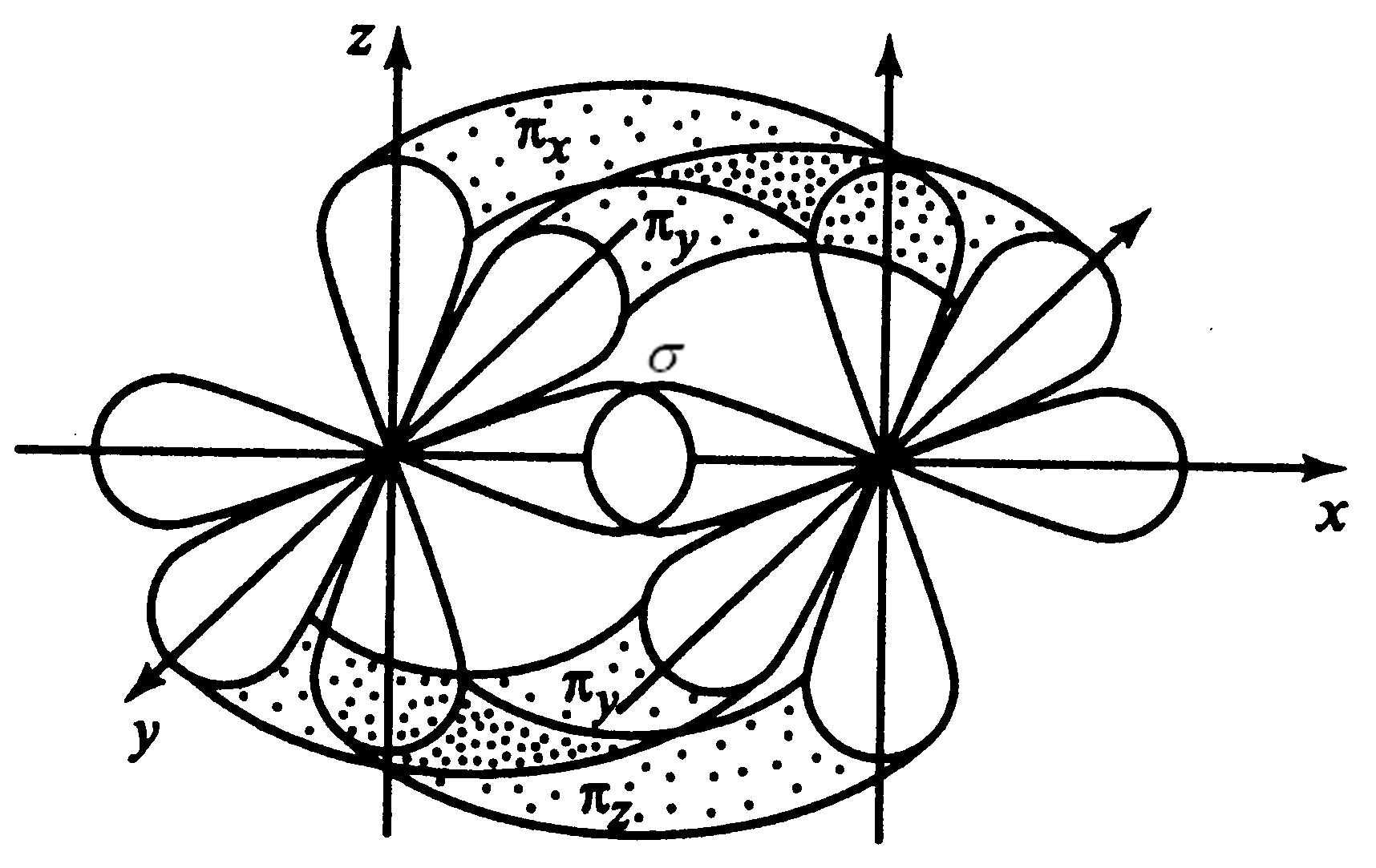
Одна связь - связь, а две другие - -связи:
связь, при которой
перекрывание АО находится под углом
к воображаемой линии, соединяющей ядра
взаимодействующих атомов
Связь называется - - связь:
Перекрывание АО при образовании -связей меньше (Есв-меньше), чем при -связях, поэтому -связи менее прочные.
Молекула Н2S
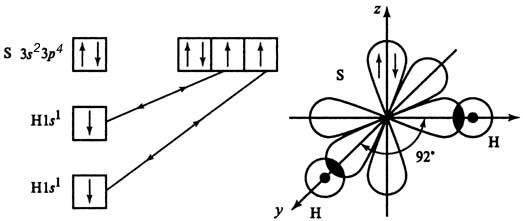
структура – угловая, валентный угол – 92о
▓ Почему валентный угол в ряду молекул:
H2S (92o), Н2Se (91o) и Н2Те (89о) изменяется?
S, Se и Te - электронные аналоги : S 3s23р4
Se 4s24p4
Te 5s25p4
Пространственная конфигурация всех молекул – угловая. Причина изменения валентного угла:
увеличение размера атома;
увеличеие расстояния между связывающими
электронными парами;
уменьшение силы отталкивания между ними;
уменьшение валентного угла.



