
- •Курс лекций
- •По физико-химическим методам анализа
- •Раздел: «электрохимия»
- •Содержание
- •Тема I: «кондуктометрический метод анализа» лекция 17 план:
- •I. Титрование по методу осаждения.
- •II. Титрование по методу нейтрализации.
- •Лекция 18 план:
- •Тема II: «потенциометрический метод анализа» лекция 19 план:
- •Лекция 20 план:
- •Лекция 21 план:
- •Тема III: «электрогравиметрический и кулонометрический методы анализа» лекция 22 план:
- •Химические процессы при электролизе:
- •Лекция 23 план:
- •Лекция 24 план:
- •Тема IV: «полярографический метод анализа» лекция 25 план:
- •Лекция 26 план:
- •Лекция 27 план:
- •1) Расчетный метод
- •2) Метод градуировочного графика
- •3) Метод стандартных растворов
- •4) Метод добавок
- •1 ) Восходящая кривая:
- •2 ) Нисходящая кривая:
- •3) Комбинированная кривая:
Тема IV: «полярографический метод анализа» лекция 25 план:
Полярографический метод анализа. Сущность, принципиальная схема установки. Катодная и анодная поляризация.
Электроды. Преимущества ртутного электрода. Техника безопасности при работе со ртутью.
Поляризационная кривая полярограмма – как графическое изображение процесса поляризации.
1.
П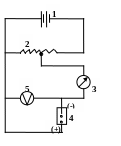 олярография
– это особый вид электролиза, где
создаются оптимальные условия для
концентрационной поляризации одного
из электродов.
олярография
– это особый вид электролиза, где
создаются оптимальные условия для
концентрационной поляризации одного
из электродов.
Метод разработан чешским ученым Ярославом Гайровским в 1922 году.
В
полярографии изучается кривая полярограмма
– зависимость силы тока, протекающего
через ячейку, от напряжения, приложенного
к электродам, находящимся в исследуемом
растворе ![]() .
.
Для получения поляризационных кривых применяется прибор, собранный по схеме:
1 – источник (аккумулятор)
2 – реостат (создает переменное сопротивление)
3 – гальванометр
4 – ячейка с двумя электродами
5 – вольтметр
Анализируемый раствор находится в ячейке (4), на дне которой имеется металлическая (донная) ртуть, чаще всего являющаяся анодом. Катодом служит ртутный капающий электрод. Он представляет собой капилляр, соединенный гибкой соединительной трубкой с резервуаром для ртути. Кончик капилляра погружен в анализируемый раствор. Через электролизер протекает постоянный ток, напряжение которого можно плавно изменять с помощью реохорда. Силу тока измеряют гальванометром. Скорость капания ртути должна быть равномерной и составлять 1 каплю за 3-5 секунд.
Поверхность ртути на дне электролизера в несколько тысяч раз больше поверхности капли капающей ртути, поэтому плотность тока на катоде и аноде различна. При прохождении небольших по величине токов потенциал донной ртути остается постоянным, то есть электрод не поляризуется.
![]()
Поверхность капельки ртути минимальна, поэтому она будет максимально поляризована, так как плотность тока наибольшая.
Поверхность донной ртути велика, поэтому она не поляризуется, так как нет тока.
Донную ртуть можно заменить на каломельный электрод. В полярографии его потенциал условно принят за нуль.
1) Капля ртути – катод
Донная ртуть – анод
Приложенное напряжение затрачивается на:
![]()
![]() – пренебрегаем, так как поверхность
большая и плотность тока мала.
– пренебрегаем, так как поверхность
большая и плотность тока мала.
IR – пренебрегаем, так как делаем анализ электролитов, которые обладают очень малым сопротивлением.
Следовательно, все напряжение тратится на поляризацию катода.
![]()
Такая поляризация называется катодной, а тип полярографии – катодная полярография. С ее помощью мы можем измерить концентрацию различных катионов.
2) Капля ртути – анод
Донная ртуть – катод
На капающую ртуть мы подаем положительное напряжение, а на анод – отрицательное.
Приложенное напряжение затрачивается на:
![]() - пренебрегаем, так как поверхность
большая, а сила тока мала.
- пренебрегаем, так как поверхность
большая, а сила тока мала.
IR – пренебрегаем, так как делаем анализ электролитов, которые обладают очень малым сопротивлением.
Следовательно, все напряжение тратится на поляризацию анода.
![]()
Такая поляризация называется анодной, а тип полярографии – анодная полярография. С ее помощью мы можем определить концентрацию различных анионов.
Пример: Катодная полярография.
Анализируемый раствор – ZnCl2.
Zn Cl2 = Zn2+ + 2Cl-
Zn2+ + 2 + Hg = Zn(Hg)
(амальгама Zn)
Процесс идет на капле ртути. Капля падает и сливается с донной ртутью, а у нее заряд «+» и с амальгамой ртути происходит разрушение Zn(Hg) - 2 = Zn2+ + Hg
Концентрация Zn2+ в растворе не изменяется.
2.
В качестве катодов чаще всего применяют капающую ртуть или твердые микроэлектроды.
Преимущества ртутного капающего электрода:
Поверхность ртути все время обновляется – это обеспечивает равномерное протекание электрохимических процессов.
Результаты хорошо воспроизводимы.
Благодаря большому перенапряжению на ртути на ней можно определить многие металлы, стоящие в ряду напряжения до водорода.
Капля ртути, падая на дно, меняет знак Cu(Hg) -
 = Cu2+
+ Hg
, катион меди уходит в раствор и его
концентрация в растворе все время
поддерживается постоянной. В результате
один и тот же опыт можно повторять много
раз.
= Cu2+
+ Hg
, катион меди уходит в раствор и его
концентрация в растворе все время
поддерживается постоянной. В результате
один и тот же опыт можно повторять много
раз.Капля ртути имеет форму шара, поэтому
 .
.Ртутный капающий электрод работает в
щелочной и нейтральной средах от +0,3 до -2В
кислой среде от +0,3 до -1В
Если
![]() ,
то ртуть окисляется; а если
,
то ртуть окисляется; а если ![]() ,
то выделяется водород.
,
то выделяется водород.
Недостатки:
Ртуть ядовита!!! Необходимо строго соблюдать правила техники безопасности при работе со ртутью!!!
Правила ТБ:
запрещается брать ртуть голыми руками
запрещается засасывать ртуть ртом
оставлять в незакрытом сосуде или в разлитом состоянии
прибор с ртутью должен стоять в специальном поддоне
пол в помещении, где есть ртуть должен быть покрыт линолеумом, причем концы должны быть загнуты; стены должны быть выкрашены масляной краской.
Твердые микроэлектроды изготавливаются из платины, золота, графита. Перенапряжение водорода на платине не велико, поэтому платиновый электрод используется только в положительной области потенциала от +1,1 до +0,3, то есть до начала выделения кислорода.
Достоинства твердых микроэлектродов:
Не ядовиты.
Недостатки твердых микроэлектродов:
Продукты электролиза осаждаются на поверхности электрода. Для восстановления его регенерируют, чаще всего механически – наждачной бумагой. Можно химически – азотной кислотой; или электрохимически – меняют полюса у электродов и проводят деполяризацию.
Твердые микроэлектроды не могут работать в отрицательной области потенциала.
Воспроизводимость результатов гораздо хуже, чем у ртутного капающего электрода.
3.
Непрерывно увеличивая внешнее напряжение, мы увеличиваем электрода.
Кривая
зависимости ![]() имеет вид прямой.
имеет вид прямой.
Е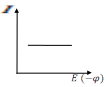 сли
в растворе есть ионы способные
восстанавливаться, то по достижении
потенциала выделения ионы начинают
разряжаться, через раствор проходит
электрический ток, вид кривой при этом
существенно измениться.
сли
в растворе есть ионы способные
восстанавливаться, то по достижении
потенциала выделения ионы начинают
разряжаться, через раствор проходит
электрический ток, вид кривой при этом
существенно измениться.
У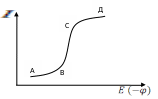 часток
АВ:
часток
АВ:
Ток очень мал и с увеличение напряженности практически не меняется, этот ток называется – остаточным током.
Остаточный
ток состоит из ![]()
![]()
![]() - фарадеев ток, возникает из-за присутствия
различных примесей, которые есть в
растворе и способны восстанавливаться.
- фарадеев ток, возникает из-за присутствия
различных примесей, которые есть в
растворе и способны восстанавливаться.
Примеси можно удалить или связать в комплексное соединение.
![]() - конденсаторный ток, обусловлен тем,
что при наложении потенциала недостаточного
для разряда ионов деполяризованные
ионы подходят к катоду, но не разряжаются,
а образуют двойной электрический слой.
- конденсаторный ток, обусловлен тем,
что при наложении потенциала недостаточного
для разряда ионов деполяризованные
ионы подходят к катоду, но не разряжаются,
а образуют двойной электрический слой.
Ток заряжения конденсатора является основной частью остаточного тока и дает небольшой уклон.
Конденсаторный ток убирают с помощью компенсаторов, то есть через гальванометр направляют ток противоположный емкостному току.
Участок ВС:
Приложенное напряжение превысило значение тока.
Сила тока очень быстро растет, и кривая круто идет вверх. Потенциал, при котором начинается восстановление ионов, называется – потенциалом восстановления, его значение зависит от природы иона и его концентрации.
Капля ртути покрывается амальгамой и падает на дно, а процесс электролиза продолжается на следующей капле. С увеличение напряжения и ионов получается больше.
Участок СД:
Сила тока достигла максимального значения и практически остается const. Этот ток называется – предельным током. Он складывается из миграционного тока и тока диффузии.
![]()
![]() - диффузионный ток, обусловлен вследствие
ионов диффузии. В результате восстановления
ионов у электродов концентрация их
уменьшается, и становиться равной 0
(концентрационная поляризация). Внутри
раствора концентрация ионов остается
const.
Разность концентрация обеспечивает
процесс диффузии.
- диффузионный ток, обусловлен вследствие
ионов диффузии. В результате восстановления
ионов у электродов концентрация их
уменьшается, и становиться равной 0
(концентрационная поляризация). Внутри
раствора концентрация ионов остается
const.
Разность концентрация обеспечивает
процесс диффузии.
![]() - миграционный ток обусловлен перемещением
ионов под действием электростатического
поля катода. Миграционный ток искажает
полярограмму, поэтому от него необходимо
избавиться. Для этого в анализируемый
раствор вводят раствор индифферентного
электролита достаточной концентрации
(раствор фон).
- миграционный ток обусловлен перемещением
ионов под действием электростатического
поля катода. Миграционный ток искажает
полярограмму, поэтому от него необходимо
избавиться. Для этого в анализируемый
раствор вводят раствор индифферентного
электролита достаточной концентрации
(раствор фон).
В качестве раствора фона применяют соли щелочных и щелочноземельных металлов, соли аммония, щелочи, кислоты; причем их концентрации должны быть в 100-1000 раз выше концентрации определяемого вещества.
Механизм действия раствора фона:
Катионы фонового раствора двигаются к катоду, но не могут разрядиться при данном потенциале, так как их потенциал более отрицательный. Ионы раствора фона располагаются у поверхности электрода, электрическое поле электрода экранируется этими ионами, и действие его не распространяется в глубину раствора. Количество восстанавливающихся ионов, перемещающихся под влиянием поля ничтожно мало по сравнению с количеством диффундирующих ионов. В результате миграционный ток уничтожается и предельный ток становиться равным диффузионному току.
Фон значительно увеличивает электрическую проводимость анализируемого раствора.
