
- •Курс лекций
- •По физико-химическим методам анализа
- •Раздел: «электрохимия»
- •Содержание
- •Тема I: «кондуктометрический метод анализа» лекция 17 план:
- •I. Титрование по методу осаждения.
- •II. Титрование по методу нейтрализации.
- •Лекция 18 план:
- •Тема II: «потенциометрический метод анализа» лекция 19 план:
- •Лекция 20 план:
- •Лекция 21 план:
- •Тема III: «электрогравиметрический и кулонометрический методы анализа» лекция 22 план:
- •Химические процессы при электролизе:
- •Лекция 23 план:
- •Лекция 24 план:
- •Тема IV: «полярографический метод анализа» лекция 25 план:
- •Лекция 26 план:
- •Лекция 27 план:
- •1) Расчетный метод
- •2) Метод градуировочного графика
- •3) Метод стандартных растворов
- •4) Метод добавок
- •1 ) Восходящая кривая:
- •2 ) Нисходящая кривая:
- •3) Комбинированная кривая:
Лекция 23 план:
Условия раздельного количественного разделения металлов. Изменение условий с целью увеличения разницы в потенциалах определяемых металлов. Воспрепятствование выделению водорода.
Применение ртутного электрода.
Условия выделения металла и качество осадка.
Ускоренный электролиз. Внутренний электролиз. Возможности и преимущества. Аппаратура, электроды.
1.
Последовательность выделения металлов при электролизе можно определить с помощью электродных потенциалов.
Выделение металлов считаю законченным, если его остаточная концентрация составляет 10-4 – 10-5% от исходной. Такому изменению концентрации соответствует смещение потенциала в отрицательную область на 0,2 – 0,4 В для однозарядных ионов и на 0,1 – 0,2 В для двухзарядных.
Например:
При электролизе 1М раствора CuSO4
остаточная концентрация ионов меди
составляет 10-4%
от исходной, то есть 10-6М,
тогда ![]() , потенциал сдвинулся в отрицательную
область на 0,18В.
, потенциал сдвинулся в отрицательную
область на 0,18В.
Если потенциалы выделения металлов близки, то разницу между ними можно увеличить, используя комплексообразование (чем прочнее комплекс, тем больше понижается электродный потенциал).
Иногда достаточного изменения потенциала разряда ионов можно достичь изменением температуры электролиза.
Например: При обычной температуре из водно-аммиачного раствора Zn и Ni осаждаются совместно, несмотря на значительную разницу в электродных потенциалах
(![]() ).
Это является следствием смещения
потенциала разряда никеля в отрицательную
область вследствие перенапряжения. При
повышении температуры до 90
перенапряжение резко снижается и
раздельное выделение металлов становиться
возможным.
).
Это является следствием смещения
потенциала разряда никеля в отрицательную
область вследствие перенапряжения. При
повышении температуры до 90
перенапряжение резко снижается и
раздельное выделение металлов становиться
возможным.
При электрогравиметрическом методе анализа следует воспрепятствовать разряду на катоде ионов водорода. Совместное выделение металла и водорода приведет к затягиванию электролиза и порче осадка. Выделение металла может сместиться выделением водорода или вообще не произойти. Выделению водорода можно воспрепятствовать, если резко снизить концентрацию его ионов в растворе, то есть вести осаждение металла из щелочной среды, а для того, чтобы не образовался нерастворимый гидроксид, вводят вещества, образующие с данным катионом хорошо растворимое комплексное соединение.
Таким образом, выделение электроотрицательных металлов ведут чаще всего из комплексных соединений, электролиз электроположительных металлов можно прекратить, когда потенциал электрода станет равным потенциалу выделения водорода.
Для разделения катионов наиболее удобен метод электролиза при контролируемом потенциале катода.
При электролизе растворов потенциал выделения металлов смещается в отрицательную область вследствие уменьшения его концентрации. При этом может начаться выделение второго металла. Для того чтобы потенциал катода оставался постоянным, напряжение между электродами в электролизе уменьшают с помощью реостата. Значение потенциала катода при этом восстанавливается. В настоящее время стабилизируют катодный потенциал автоматически с помощью потенциостатов.
2.
Электролиз на ртутном катоде применяется для удаления из раствора мешающих ионов, чтобы затем в нем определять малые концентрации других ионов.
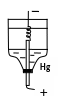 На
ртути велико перенапряжение водорода;
при комнатной температуре и плотности
тока 0,01 А/см2
оно составляет -1,04В. Благодаря этому
можно выделять металлы из кислых
растворов, к тому же многие металлы дают
с ртутью амальгамы, что облегчает их
выделение. Все металлы, ионы которых
разряжаются на ртути при потенциалах
еще более отрицательных, чем ионы
водорода, остаются в растворе. Не
осаждаются в этих условиях щелочные и
щелочноземельные металлы, алюминий и
другие. Таким образом, удается отделить
эти металлы от железа, хрома, цинка,
кадмия.
На
ртути велико перенапряжение водорода;
при комнатной температуре и плотности
тока 0,01 А/см2
оно составляет -1,04В. Благодаря этому
можно выделять металлы из кислых
растворов, к тому же многие металлы дают
с ртутью амальгамы, что облегчает их
выделение. Все металлы, ионы которых
разряжаются на ртути при потенциалах
еще более отрицательных, чем ионы
водорода, остаются в растворе. Не
осаждаются в этих условиях щелочные и
щелочноземельные металлы, алюминий и
другие. Таким образом, удается отделить
эти металлы от железа, хрома, цинка,
кадмия.
Используют различного типа ртутные катоды, чаще всего это ртуть, налитая в электролизер. Ртуть подключается к источнику тока с помощью платинового контакта, анодом служит платиновая спираль.
Пример: Определение титана в стали. Проводят электролиз исследуемого раствора 40 минут. Не прерывая тока, сливают ртуть и раствор. Железо, хром, никель и другие металлы осаждаются на катоде, а титан остается в растворе, где его и определяют.
3.
Качество осадка определяется в основном плотностью тока и концентрацией в электролите ионов определяемого металла.
Необходимо добиваться максимально чистого, плотного, мелкокристаллического осадка металла. Такой осадок легко промыть и высушить без потерь.
Влияние плотности тока:
Плотность
тока
– это отношение силы тока к плотности
поверхности электрода. ![]()
При низких плотностях тока электролиз длиться долго и образуются крупнокристаллические осадки, которые непрочно удерживаются на катоде.
При высоких плотностях тока может наступить концентрационная поляризация, быстро достигается потенциал разряда водорода. Водород, выделяясь совместно с металлом, разрыхляет осадок. Рыхлый осадок плохо сцепляется с электродом, легко окисляется.
Поэтому электролиз необходимо вести при средних плотностях тока (0,001 – 0,01)А/см2.
Влияние концентрации:
Если концентрация иона очень высокая, то идет бурное выделение металла и осадок падает с электрода.
4.
Ускоренным называется электролиз, при проведении которого, время необходимое на завершение выделения данного вещества, сокращается за счет увеличения плотности тока и силы проходящего через электролит тока.
Возможность увеличения плотности тока через ущерб для электровесового определения металлов связана с применением перемешивания и подогревом электролита. Перемешивание необходимо для выравнивания концентрации во всем объеме электролита, так как лимитирующей стадией электролиза является стадия диффузии вещества к электроду из глубины раствора, и скорость осаждения металла контролируется этим процессом. Для увеличения скорости движения ионов к катоду применяют и нагрев, обычно до 60-80 и очень редко – до кипения.
Внутренний электролиз:
Внутренним электролизом называют метод определения небольших количеств металлов за счет тока гальванического элемента.
В стакан с раствором электролита (CuSO4) электроды – платиновую сетку и алюминиевую спираль. Электроды соединяют накоротко. Получается гальванический элемент Pt│CuSO4│Al, при работе которого протекают следующие процессы:
К(-)
![]()
А(+)
![]()
В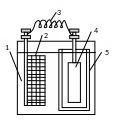 место
алюминия можно взять другие металлы
(цинк, свинец, железо) с более отрицательным
потенциалом выделения, чем у определяемого
элемента.
место
алюминия можно взять другие металлы
(цинк, свинец, железо) с более отрицательным
потенциалом выделения, чем у определяемого
элемента.
1 – стеклянный сосуд
2 – платиновый сетчатый катод
3 – соединительный проводник
4 – анод
5 – керамическая диафрагма
При наличии в растворе ионов нескольких металлов можно выделить каждый металл, подобрав соответствующие аноды.
Цементация – это явление выделения металла на аноде.
Для ее уменьшения необходимо:
хорошо зачищать контакты
вести электролиз из разбавленных растворов
использовать полупроницаемую перегородку
Применение:
для анализа
для выделения металлов
Преимущества:
простой
не требует внешнего источника тока
Внешний электролиз:
В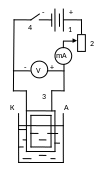 качестве источников постоянного тока
используют аккумуляторы и выпрямители
различных систем. Особенно часто
применяются полупроводниковые
выпрямители: селеновые, кремниевые,
германиевые. Амперметры и вольтметры
постоянного тока должны обладать
чувствительностью 10-1
А и 10-1
В и иметь шкалу приметно 10А и 10В.
качестве источников постоянного тока
используют аккумуляторы и выпрямители
различных систем. Особенно часто
применяются полупроводниковые
выпрямители: селеновые, кремниевые,
германиевые. Амперметры и вольтметры
постоянного тока должны обладать
чувствительностью 10-1
А и 10-1
В и иметь шкалу приметно 10А и 10В.
1 – источник постоянного тока
2 – реостат
3 – электроды
4 – переключатель
Электрод, на котором происходит осаждение определяемого металла, должен иметь возможно большую поверхность и возможно меньшую массу. В основном применяются платиновые сетчатые электроды. Анодом чаще всего служит платиновая проволока в виде спирали. Иногда используют сетчатый анод, особенно, если ведут определение металлов одновременно и на катоде и на аноде. Анод по размерам меньше катода и должен находиться в центре его.
Ряд металлов нельзя выделить на платине вследствие образования сплавов и интерметаллических соединений, вызывающих ее разрушение. Для определения таких металлов (цинк, висмут и другие) катод покрывают слоем меди или другого металла, не образующего сплава с платиной.
Последовательность действий:
Катод предварительно очищают, промывают, высушивают и взвешивают на аналитических весах
Электроды погружают в анализируемый раствор так, чтобы над раствором находилась примерно пятая часть высоты электрода, замыкают электрическую цепь и проводят электролиз при заданном напряжении и силе тока, время от времени проверяя полноту выделения определяемого металла
После завершения электролиза катод с осадком металла извлекают из электролита, промывают водой и отключают источник тока. Катод промывают, погружая в стакан со спиртом, высушивают, и определяют массу
