
- •Раздел I. Оптические методы анализа.
- •Тема 1. Фотометрические методы анализа.
- •1 Оптические методы анализа.
- •2 Электрохимический метод анализа.
- •Условия подчинения растворов закону б-л-б.
- •Тема 2. Нефелометрический и турбодиметрический методы анализа.
- •Тема 3. Люминесцентный метод анализа.
- •Закон Стокса – Ломмеля
- •Правило Левшина
- •Концентрационное тушение.
- •Температурное тушение.
- •Тушение посторонними примесями.
- •Сортовой анализ.
- •Люминесцентная микроскопия.
- •Химический люминесцентный анализ.
- •Качественный анализ одного вещества.
- •3.2.Прямой метод.
- •3.3.Метод добавок.
- •Тема 4. Поляриметрический метод анализа.
- •Зачернение
- •Канадский
- •Исландский шпат
- •2.1.Поляриметры с бикварцевыми пластинками.
- •2.2.Поляриметры с 1 и 2 дополнительными Николями.
- •Тема 5. Рефрактометрический метод анализа.
- •0 Среда 1 Среда 2
- •2 Среда 2
Физико-химические методы анализа.
Курс лекций.
Раздел I. Оптические методы анализа.
Тема 1. Фотометрические методы анализа.
Лекция №1.
План.
1.Химические, физические, физико-химические методы анализа. Их взаимосвязь.
2.Классификация физико-химических методов анализа.
3.Методы решения аналитической задачи.
4. Преимущества методов, их значение.
№1
Задачей аналитической химии является определение количества вещества в исследуемой системе наиболее быстрым, точным и рациональным методом. В зависимости от поставленной задачи (количественное или качественное определение) аналитическая химия делится на качественный или количественный анализ. Выбор метода определения является важной задачей аналитической химии. Все применяемые методы делятся на три группы: физические, химические и физико-химические методы.
Химические методы анализа основаны на химических реакциях определяемого компонента с реагентом, которые сопровождаются внешним эффектом (осадок, газ, изменение окраски).
Физические методы анализа основаны на изучении природы атомов (интенсивность света, радиоактивность). При этом химические реакции играют либо второстепенную роль.
Физико-химические методы анализа основаны на взаимосвязи между составом системы и ее физическими или физико-химическими свойствами.
Все методы тесно связаны. Трудно провести грань между физическим и физико-химическим методами.
№2
Физико-химические методы анализа созданы на основе трудов Ломоносова, Менделеева, Вант-Гоффа, Курнакова. В зависимости от используемых свойств различают следующие группы:
1 Оптические методы анализа.
1.1Фотометрический метод анализа - основан на определении оптических свойств системы – поглощения электромагнитных излучений в диапазонах длин волн 180-1200 (нм).
1.2 Нефелометрия и турбидиметрия – изучает свойства эмульсии и суспензии. Основана на рассеянии света частицами.
1.3 Люминесценция – основана на холодном свечении веществ.
1.4 Рефрактометрия – основана на определении преломления света, при переходе его из одной среды в другую.
1.5 Поляриметрический метод анализа – основан на вращении плоскости поляризации плоскополяризованного света растворами оптически активных веществ .
2 Электрохимический метод анализа.
2.1 Электрогравиметрический метод анализа основан на определении массы выделенного на электроде вещества при электролизе.
2.2 Кулонометрический метод анализа – основан на определении количества электричества, затраченного на реакцию с определяемым веществом.
2.3 Полярографический метод анализа – особый вид электролиза, где замеряют зависимость тока от приложенного напряжения.
2.4 Потенциометрический метод анализа – основан на измерении электродных потенциалов.
2.5 Кондуктометрический метод анализа – основан на измерении электропроводности растворов.
Наряду с фотометрическим и электрохимическим методами анализа к числу важнейших относится хроматография. Основой хроматографии всех видов является использование различий в характере разделения различных веществ между двумя фазами: подвижной и неподвижной.
Следует упомянуть о методах, которые являются новыми направлениями в физико-химических методах анализа и основаны на зависимости скорости реакции от концентрации реагирующих веществ. Они называются кинетическими методами анализа. Чувствительность этих методов высока. Кроме этого используют радиометрические методы и масс- спектрометрии.
№3
Применяются в ФХМА два основных методических приема: метод прямых измерений и метод титрования (косвенные измерения).
Прямые методы:
1. Метод градуировочного графика:
- приготовление стандартных растворов (систем), отличающихся друг от друга только содержанием определяемого вещества.
- количественная оценка (измерение величин) некоторого свойства системы для каждого из стандартных растворов.
- графическое выражение установленной
зависимости (построение калибровочного
графика) в координатах: концентрация
определяемого вещества (по оси абсцисс)
– численное выражение данного свойства
(по оси ординат).
графическое выражение установленной
зависимости (построение калибровочного
графика) в координатах: концентрация
определяемого вещества (по оси абсцисс)
– численное выражение данного свойства
(по оси ординат).
А


С
Рис. 1.1.1.
- измерение выбранного свойства для исследуемого раствора и определение его концентрации по калибровочному графику.
2. Метод молярного свойства или расчетный метод.
Иногда функциональная зависимость между численным значением, физико-химическими свойствами системы и содержанием анализируемого вещества может быть выражена не графиком, а формулой:
A =CLE
- измеряется интенсивность аналитического сигнала у нескольких стандартных растворов.
I =AC
- рассчитывается молярное свойство, т.е. интенсивность аналитического сигнала, пропорциональная 1 моль вещества – это коэффициент пропорциональности.
A =I/C
A – константа
I – интенсивность сигнала
C – концентрация
- в этих условиях замеряется интенсивность сигнала у анализируемой пробы.
Cx=Ix/A
3. Метод добавок.
- замеряется интенсивность аналитического сигнала анализируемой пробы
- в пробу вводится известный объем стандартного раствора и снова измеряется интенсивность сигнала, расчет ведется по формулам.
Этим
же методом можно пользоваться и в
графическо м
варианте.
м
варианте.
Косвенный метод (метод титрования).
В ходе титрования измеряется интенсивность аналитического сигнала I и строится кривая титрования в координатах I-V, где V-добавленного титранта в мг. Точка эквивалентности находится по кривой титрования, Виды кривых весьма разнообразны.
№4
Следует отметить преимущества инструментальных методов анализа:
- высокая чувствительность определяются примеси 10-8 – 10-9 (%)
- быстрота, с которой проводится определения
- малое количество пробы
- анализ без предварительного разделения веществ
- документальность
Лекция №2 Фотометрический метод анализа.
План:
Сущность фотометрического метода анализа и область применения.
Спектрофотометрический и фотометрический методы анализа.
Основные оптические свойства окрашенных сред.
Закон Бугера-Ламберта-Бера.
Прозрачность и оптическая плотность растворов.
Следствие из основного закона фотометрии.
Молярный коэффициент поглощения (погашения).
Цвет раствора, кривые светопоглощения.
Выбор оптимальных условий для фотометрических определений.
№1
Фотометрический метод анализа основан на избирательности поглощения растворами веществ ультрафиолетового, видимого и инфракрасного света.
Ультрафиолетовый свет λ=180-400 (нм)
Видимый свет λ =400-700 (нм)
Инфракрасный λ=700 -1100 (нм)
Иногда этот метод называют абсорбционной спектроскопией. Степень поглощения света зависит от концентрации растворенного вещества.
Для подтверждения изменения светового потока проведем следующий опыт:
1 пробирка 5 мл FeNH4(SO4)2 · 12 H2O + 5 мл род. NH4CNS
2 пробирка 10мл Fe NH4(SO4)2 ·12 H2O + 5мл род. NH4CNS
Доведем водой раствор в обеих пробирках до одного уровня. Сравниваем окраску в обеих пробирках.
ВЫВОД: раствор с меньшей концентрацией – светлее, следовательно, света абсорбирует меньше, раствор с большей концентрацией – темнее, следовательно, пропускает света меньше, абсорбирует больше. На сравнение интенсивности окраски или на сравнение светового потока, прошедшего через раствор, основывается фотометрический метод анализа.
Фотометрический метод анализа отличается высокой чувствительностью, избирательностью, простотой в выполнении.
Эти методы широко используются:
при контроле технологических процессов;
при анализе готовой продукции;
при анализе природных материалов;
охране окружающей среды (воздуха, почвы, воды).
№2
Метод абсорбционного анализа (фотометрия) подразделяется на спектрофотометрический и фотоэлектроколориметрический.
Спектрофотометрия основана на изменении степени поглощения монохроматического излучения (излучение определенной длины волны).
В фотоэлектроколориметрии и колориметрии используется немонохроматическое (полихроматическое) излучение, преимущественно в видимом участке спектра. В колориметрии о поглощении света судят визуальным сравнением интенсивности окраски, в спектрофотометрии и фотоэлектроколориметрии в качестве приемников энергии используют фотоэлементы.
№3
При фотометрических определениях определяемый компонент с помощью химических реакции в растворе переводят в окрашенное соединение (кроме спектрофотометрии, где можно анализировать неокрашенные соединения) и затем измеряют его оптическую плотность (абсорбционность). Очень важно правильно подобрать химическую реакцию и хорошо знать оптические свойства окрашенных растворов.
К основным оптическим характеристикам растворов окрашенных соединений в фотометрии относятся интенсивность окраски и цвет раствора.
Интенсивность окраски.
Wo
Wo
Wa
Wom
Wom
Wp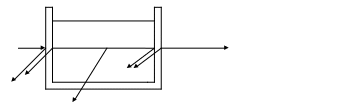







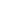














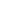

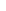










Рассмотрим видимую часть области спектра (400-700 нм). При прохождении через стеклянный сосуд с раствором излучение, мощностью W0 , ослабляется, часть светового пучка отражается на границе стекло – воздух и стекло – раствор (Wom); другая его часть рассеивается (Wp) присутствующими, взвешенными в растворе частицами, главным образом свет ослабляется за счет поглощения (абсорбции) световой энергии (Wa) раствора.
Справедливо уравнение:
Wo =Wa + Wom + Wp+ W (1)
Т.к. при определении пользуются одинаковыми кюветами, для которых Wom постоянна и мала и его можно пренебречь, при работе с истинными растворами достаточно чистых веществ потери мощности за счет рассеяния незначительны. Уравнение (1) запишется:
Wo = W + Wa (2)
Wa = Wo – W (3) , где Wo и W можно непосредственно измерить , а Wa – рассчитать.
Чем больше мощность адсорбируемого измерения, тем темнее раствор, т.е. он более интенсивно окрашен.
Цвет раствора.
Степень поглощения светового потока раствором неодинакова для световых потоков различных длин волн, составляющих белый свет. В результате этого выходящий свет часто бывает окрашен.
Цвет раствора, который воспринимается глазом, обусловлен светом той части падающего пучка света, которая прошла через раствор не поглощенного.
Кажущийся цвет раствора принято считать дополнительным к цвету поглощенного излучения.
Поглощенная часть λ (нм) |
Цвет поглощенной части |
Кажущийся цвет раствора |
400-450 |
Фиолетовый |
Желто-зеленый |
575-590 |
Желтый |
Синий |
625-750 |
Красный |
Сине-зеленый |
№4,5
Пусть анализируемый раствор налит в кювету слоем толщиной h . Направим на кювету монохроматическое излучение, мощностью Wo . Мысленно разобьем толщину кюветы на несколько равных участков и будем наблюдать изменения мощности светового потока.
ℓ



W0
W
W1
W2



W3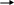



Рис. 1.1.3.
П усть в каждом участке мощность светового потока уменьшается в n раз, тогда
W1=W0\n
W2=W1\n =W0\n2
W3=W2\n = W0\n3 и т.д. W=W0\na (4)
Прологарифмируем уравнение (4)
lg W =lg W0\nª
lg W =lg W0 – lg nª
lg W –lg W0=-lg nª
lg W0 –lg W= lg nª
lg W0\W =a lg n
lg W0\W=A - оптическая плотность раствора или его абсорбционность.
lg n – величина постоянная для данного окрашенного соединения при прохождение света определенных длин волн , обозначим k.
W\W0=T – прозрачность или пропускание раствора.
Wa\W0 -поглощающая способность.
A=k*a -закон Бугера-Ламберта-Бера
Слои данного вещества одинаковой толщины при прочих равных условиях поглощают одинаковую долю падающего светового потока, или оптическая плотность раствора прямо пропорциональна толщине слоя.
Графическое выражение закона Бугера-Ламберта-Бера :
A=kℓ lgW0\W=kℓ
A
A
W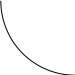
ℓ
ℓ
Позднее Бером было установлено, что поглощение света зависит от концентрации вещества
k=E*C , где
E-величина постоянная для растворов данного вещества при прохождении света с определенной длинной волн;
C-концентрация вещества.
Таким образом, A=E*C*L (6)
Оптическая плотность растворов при прочих равных условиях прямо пропорциональна концентрации вещества и толщине поглощаемого слоя
Такая формулировка известна как закон Бугера-Ламберта-Бера, или основного закона фотометрии. Графическое выражение закона Бугера-Ламберта-Бера:
A =f (C)

А

Рис. 1.1.6. С
№6
Из основного закона колориметрии вытекает важное в практическом смысле следствие.
Нальем в узкий стеклянный цилиндр с плоским дном раствор, какого- либо окрашенного вещества и будем наблюдать интенсивность окраски сверху при условии, что пучок света падает на раствор снизу, через дно цилиндра.
При толщине поглощающего слоя l1, концентрация вещества будет C1 и мощность выходящего потока света W1. Тогда, согласно закону Бугера-Ламберта-Бера
A1 =EC1L1
Затем с помощью растворителя увеличим объем раствора в два раза, до толщины слоя l2.
A2=EL2C2
При разбавлении концентрация вещества уменьшилась в два раза, т.е. C2=C1/C2, но число частиц во всем объеме раствора по пути проходящего света осталось тем же, поэтому доля во втором случае равна доле поглощенного света в первом случае, а тогда и оптические свойства будут равны:
A1=A2; откуда EL1C1=EL2C2
C1/C2=L2/L1 (7)
Из уравнения (7) следует:
при одинаковой интенсивности окраски двух растворов данного вещества их концентрации обратно пропорциональные толщинам поглощающих свет слоев.
№7
Если в уравнении А=ECL, С имеет размерность моль/л, L выражается в см, величина E является молярным коэффициентом погашения или молярным коэффициентом абсорбции и обозначается символом Eµ
Таким образом, молярный коэффициент поглощения - это оптическая плотность раствора при его концентрации 1моль в литре и толщине поглощающего слоя 1см.
Молярный коэффициент поглощения не зависит от концентрации раствора и является мерой чувствительности определений.
Разберем, что это значит на примере. Пусть мы имеем два раствора (окрашенные) меди: гексааммиакат меди с Eµ = 500, дитизонат меди Eµ=50000.При каких концентрациях меди реакциями с аммиаком и дитизоном можно получить одинаковые оптические плотности при одинаковой толщине слоя?
Согласно основному закону фотометрии для гексааммиакат меди:
A1=E1L1C1 =500 L1C1;
Для дитизоната меди:
A2=50000L2C2 ; но L1=L2 ; A1=A2 , отсюда
C2=500C1/50000= C1/100 , т.е. для получения одинаковой оптической плотности в случае применения дитизона требуется концентрация меди в 100 раз меньше, чем в случае использования аммиака, т.е. определение меди дитизонатом в 100 раз чувствительней, чем аммиаком.
ВЫВОД: чем больше молярный коэффициент поглощения, тем чувствительней определение.
Молярный коэффициент поглощения можно рассчитать из уравнения:
Eµ= A/CL
№8
Для характеристики цветовых растворов веществ строятся кривые светопоглощения. Кривая спектра поглощения:
A= f(λ)
А
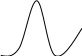

λ
Рис. 1.1.7.
Пользуясь кривыми светопоглощения, выбирают длину волны для измерения оптической плотности. Наибольшая величина молярного коэффициента поглощения, а, следовательно, и наибольшая чувствительность достигается при максимуме светопоглощения.
№9
Для того чтобы правильно подобрать окрашенное соединение, необходимо по справочнику выбрать такое соединение данного иона, при котором молярный коэффициент поглощения будет наибольшим.
Для правильного выбора светофильтра (λ) необходимо построить кривую светопоглощения (кривая абсорбции). По максимуму определить необходимую длину волны.
Выбираем толщину кювет такой, чтобы оптическая плотность уложилась в интервал 0,2-0,8.
Пример: пусть мы имеем соль Cu2+ и Ni2+ .Нам необходимо определить концентрацию ионов Cu2+. Для этого необходимо построить кривые светопоглощения для раствора Cu2+ и для раствора Ni2+.
и
А
λ
1
2
3
Ni2+
Cu2+

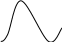




ррррРис. 1.1.8.
Максимум светопоглощения для меди наблюдается при светофильтре №2, при этом для соли Ni2+ наблюдается минимум светопоглощения, следовательно, соль Ni2+ не мешает определению меди.
ВЫВОД:
Для аналитических определений фотометрическим методам выбираем то окрашенное соединение данного иона, для которого молярный коэффициент поглощения - максимальная величина.
Измерения ведут при той длине волны, где наблюдается максимум светополощения на кривой светопоглощения для данного иона и минимума для мешающих ионов.
Лекция №3 Фотометрический метод анализа.
План:
Условия образования окрашенных соединений.
Качественное обнаружение отклонения от закона Б-Л-Б.
Количественное определение отклонений от закона Б-Л-Б.
Влияние прочности комплексных соединений на отклонения.
Влияние посторонних комплексообразующих ионов.
Влияние концентрации водородных ионов.
Влияние температуры и времени.
Экстракция в фотометрическом методе анализа.
Фотометрический анализ многокомпонентных растворов.
Определение высоких концентраций веществ методом дифференциальной фотометрии.
№1
При выводе закона Б-Л-Б предполагается, что частицы при разбавлении раствора остаются неизмененными, т.е. не взаимодействуют с молекулами растворителя и ионами других веществ, присутствующих в растворе.
В реальных условиях окрашенные вещества при разбавлении или при действии посторонних веществ, часто разрушаются. Вследствие этого нарушается прямо пропорциональная зависимость между концентрацией и оптической плотностью раствора – наблюдаются отклонения от закона Бугера-Ламберта-Бера.
1.1 Качественно эти отклонения можно обнаружить при построении графиков A=f(c) и A=f (ℓ).
А
+

-



Рис. 1.1.9. С
Отклонение от основного закона поглощения называется положительными или отрицательными в зависимости от расположения экспериментальной линии на графике выше или ниже теоретической прямой.
1.2. Для количественного определения отклонения от закона Б-Л-Б измеряют оптическую плотность исходного раствора A0 с концентрацией вещества C1 при толщине слоя ℓ1. Затем разбавляют исходный раствор в n раз и снова измеряют оптическую плотность An, раствора с концентрацией C2=C1/n при
толщине слоя nℓ1, если при разбавлении не увеличивается диссоциация
комплексного соединения, то A0=An, а дельта =0, т.е. закон Б-Л-Б выполняется, если A0 не равна An, то дельта =A0-An/A0, закон Б-Л-Б не выполняется, т.е. наблюдаются отклонения.
1.3. В первую очередь отклонения могут наблюдаться из-за непрочности комплексных соединений, т.к. практическое большинство окрашенных веществ – комплексные. Чем больше прочен комплекс, тем больше образуется окрашенных частиц и тем больше устойчивость. Если при разбавлении интенсивность окраски раствора уменьшается сильнее, чем следует ожидать, это свидетельствует о малой прочности окрашенного комплекса.
1.4. На результаты определения существенно влияют посторонние ионы, присутствующие в растворе. Особенно необходимо учитывать комплексообразующую способность посторонних ионов. Например: FeSCN2+ + F- =FeF2+ + SCN-
Прибавление уже небольших количеств фторида натрия к растворам тиоцианата железа заметно обесцвечивает растворы, т.к. ионы железа связываются в более прочный бесцветный фторидный комплекс. В присутствии фторид - ионов железо следует определить с применением других реагентов, например, салициловой кислоты, с которой железо образует более прочный комплекс.
1.5 Кислотность раствора, при которой осуществляется реакция, в фотометрическом анализе имеет большое значение.
а) рассмотрим окрашенные комплексы с анионами сильных кислот:
SCN- ; Cl- ; I-
Образование окрашенного комплекса идет по уравнению:
Fe3+ + SCN- = FeSCN2+
Рассмотрим влияние избытка (H+) на равновесии. Т.к. ион SCN- не связывается с H+ в молекулу кислоты, концентрация реагента в растворе не меняется, окрашенные комплексы не разрушаются. При увеличении pH раствора, т.е. при введении OH-, катионы металла связываются в малорастворимые гидроксиды или основные соли,
Fe3+ + 3OH- = Fe(OH)3
При этом происходит разрушение окрашенного комплекса.
ВЫВОД (1): Если комплексное соединение образовано анионами сильных кислот – работать необходимо в кислых средах.
б) Комплексы с анионами слабых кислот. К этой группе относятся большинство органических реагентов. В общем, виде такие кислоты можно изобразить следующим образом:
HR=H++R-
Полнота связывания определенного иона в комплексе зависит от концентрации реагента R- в растворе, Однако это концентрация невелика, т.к. кислота HR – слабая.
Увеличение концентрации R можно добиться повышения pH раствора, при этом:
H- + OH+ = H2O
и равновесие реакции:
HR=H++R-
сдвигается вправо.
Увеличение концентрации ионов H+ приведет к сдвигу равновесия вправо, что будет способствовать разрушению комплексного соединения.
ВЫВОД(2):Если комплексное соединение образовано анионами слабых кислот – работать необходимо в щелочных средах.
в) При использовании комплексов следует предусматривать возможность образования поочередно комплексов с различным числом координированных частиц реагента
[Cu(NH3)4] 2+ [Cu(NH3)6]2+
[Fe(SCN)] 2+ [Fe(SCN)2]+ [Fe(SCN)3] и т.д.
Реактив обладает индикаторными свойствами.
Среди реактивов, являющихся слабыми органическими кислотами, много соединений обладающих индикаторными свойствами. Такие реактивы способны изменять свою окраску с изменением концентрации ионов водорода.
Например: при pH >4,5 образует с ализарином соединения, растворы которых окрашены в красный цвет. Растворы ализарина при этом значении pH желтого цвета, но при pH >5,5 ализарин изменяет окраску на красно-фиолетовую, т.е. даже в отсутствии алюминия получается красная окраска раствора. Поэтому определение алюминия с ализарином рекомендуется проводить в интервале значений pH 4,5-5,0.
д) Температура и время
При стоянии растворы выцветают. Температура влияет по–разному, в зависимости от природы раствора.
