
- •51. Статистический и термодинамический методы исследования вещества.
- •52. Основные положения молскулярно-кинетичсской теории.
- •53. Максвелловский закон распределения молекул газа по их скоростям.
- •54. Больцмановский закон распосделсния молекул газа по их энергиям.
- •55. Закон равномерного распределения энергии по степеням свободы молекул газа.
- •56. Молекулярно-кинстическое толкование абсолютной температуры
- •57. Первое начало термодинамики.
- •58. Адиабатический процесс.
- •59. Политропические процессы
- •60. Второе начало термодинамики.
- •61. Изопроцессы. Запишите уравнения состояния идеального газа для этих процессов и начертите их графики в координатах р и V, р и t, t и V.
- •62. Дайте определение полной, молярной и удельной тсплоемкостей газа.
- •63Дайте определение равновесного и неравновесного состояния системы.
- •64. Дайте определение обратимого и необратимого процесса.
- •65. Дайте определение кругового процесса (цикла). Объясните принцип действия тепловых машин.
- •66. Начертите цикл Карно в координатах р и V
- •67. Дайте определение энтропии. Чему равно изменение энтропии для обратимых и необратимых процессов.
- •Энтропия и второе начало термодинамики
- •73. Приведите барометрическую формулу. Для чего она служит?
- •74. Получите формулу для средней длины свободного пробега молекул газа.
- •75. Какое явление переноса в идеальном газе описывается выражением
- •78. Получите выражения для молярных теплоемкостей всех изопроцессов в идеальном газе. 79Получите соотношение Манера
- •Соотношение Майера
- •Соотношение Майера
- •94. Начертите изотерму Ван-дер-Ваальса и сравните ее с экспериментальной изотермой реального газа.
- •95. Дайте определение критического состояния газа. Получите выражения для параметров критического состояния газа.
- •96. Получите формулу для внутренней энергия реального газа.
- •97. В чем заключается эффект Джоуля-Томсона?
- •98. Получите уравнение Клапейрона-Клаузиуса для фазового превращения реального газа.
- •99. Нарисуйте диаграмму равновесных давлений и температур для двухфазной системы "жидкость - пар".
- •100Нарисуйте обобщенную диаграмму состояний для трехфазной системы "твердое тело - жидкость - газ". Дайте определение тройной точки.
- •Фазовые превращения реального газа
- •Уравнение Клапейрона-Клаузиуса и фазовая диаграмма для превращения жг
- •Уравнение Клайперона-Клаузиуса и Рис. 6 фазовая диаграмма для превращения тж
- •Уравнение Клайперона-Клаузиуса и фазовая диаграмма для превращения тг. Тройная точка. Диаграмма состояния.
Уравнение Клапейрона-Клаузиуса и фазовая диаграмма для превращения жг
К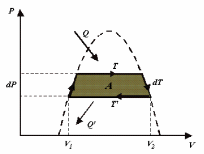 ак
уже указывалось, две любые фазы вещества
могут находиться в равновесии лишь при
определенном давлении, величина которого
зависит от температуры. Общий вид этой
зависимости можно получить, воспользовавшись
методом циклов Карно. Возьмем две близко
расположенные изотермы реального газа
при температурах Т
и Т
=Т – dT.
Построим на этих изотермах цикл Карно,
как показано на рис.4. По теореме Карно
имеем
ак
уже указывалось, две любые фазы вещества
могут находиться в равновесии лишь при
определенном давлении, величина которого
зависит от температуры. Общий вид этой
зависимости можно получить, воспользовавшись
методом циклов Карно. Возьмем две близко
расположенные изотермы реального газа
при температурах Т
и Т
=Т – dT.
Построим на этих изотермах цикл Карно,
как показано на рис.4. По теореме Карно
имеем
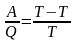 (1)
(1)
В случае элементарного цикла Карно
 .
.
Подставляя это в уравнение (1), получим
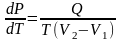 (2)
(2)
П
Рис. 4
редставим входящие в (2) величины следующим образомQ = ν r, V1 = ν Vж, V2 = ν Vг, где
r – теплота испарения 1 моля жидкости,
Vж – объем 1 моля жидкости,
Vг – объем 1 моля газа.
Тогда уравнение (2) примет вид:
 .
.
Оно называется уравнением Клайперона-Клаузиуса для фазового превращения ЖГ.
Фазовая диаграмма – это график, выражающий кривую Р = Р(Т), на которой две фазы находятся в равновесии. Уравнение Клайперона-Клаузиуса (3) определяет характер этой кривой.
Поскольку
(Vг─Vж)0,
то
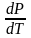 0,
т.е. повышение температуры приводит к
увеличению равновесного давления.
0,
т.е. повышение температуры приводит к
увеличению равновесного давления.
Возьмем вещество в виде жидкости и находящегося в равновесии с ней насыщенного пара и, не изменяя объема, станем отнимать от него тепло. Этот процесс будет с
Рис. 5
 опровождаться
понижением температуры вещества и
соответственно уменьшением давления.
Поэтому точка, изображающая состояние
вещества не диаграмме (Р,
Т),
перемещается вниз по кривой Р
= Р(Т).
Это продолжается до тех пор, пока не
будет достигнута температура кристаллизации
вещества, отвечающая равновесному
значению давления (рис. 5).
опровождаться
понижением температуры вещества и
соответственно уменьшением давления.
Поэтому точка, изображающая состояние
вещества не диаграмме (Р,
Т),
перемещается вниз по кривой Р
= Р(Т).
Это продолжается до тех пор, пока не
будет достигнута температура кристаллизации
вещества, отвечающая равновесному
значению давления (рис. 5).
Обозначим эту температуру Ттр. Все время, пока идет процесс кристаллизации, температура и давление остаются неизменными. Отводимая при этом теплота представляет собой теплоту, выделяющуюся при кристаллизации. Температура Ттр и соответствующее равновесное давление Ртр – единственные значения температуры и давления, при которых могут находится в равновесии три фазы вещества: твердая, жидкая и газообразная. Соответствующая точка на диаграмме Р(Т) называется тройной точкой А.
Уравнение Клайперона-Клаузиуса и Рис. 6 фазовая диаграмма для превращения тж
Уравнение Клайперона-Клаузиуса в этом случае имеет вид аналогичный уравнению (3)
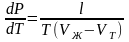 (4)
(4)
где l – теплота плавления 1 моля твердого тела,
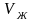 объем
1 моля жидкости,
объем
1 моля жидкости,
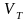 объем
1 моля твердого тела.
объем
1 моля твердого тела.
Р = Р(Т) – фазовая диаграмма, т.е. условие равновесия фаз. Обычно VжVт, и поэтому 0, но для некоторых веществ (например, вода, чугун) VжVт, и тогда 0. вид фазовых диаграмм, для обоих случаев показан на рис.6а и рис.6б.
Уравнение Клайперона-Клаузиуса и фазовая диаграмма для превращения тг. Тройная точка. Диаграмма состояния.
Возьмем вещество, которое находится в состоянии, когда три фазы вещества находятся в равновесии, т.е. в состоянии, заданным тройной точкой А. Будем продолжать отнимать от вещества теплоту. По окончании процесса кристаллизации в равновесии будут находиться твердая и газообразная фазы. И если и дальше продолжать отнимать теплоту, то температура снова начнет понижаться. Соответственно уменьшается давление паров, находящихся в равновесии с кристаллической фазой. Точка, изображающая состояние вещества будет перемещаться вниз по фазовой диаграмме ТГ.
Уравнение Клайперона-Клаузиуса для фазового превращения ТГ имеет вид
 (5)
(5)
где r – теплота сублимации 1 моля твердого тела,
Vт объем 1 моля твердого тела,
Vг объем 1 моля газа (пара).
Поскольку Vг Vт, то 0, т.е. фазовая диаграмма имеет вид возрастающей кривой. Далее в этом случае Vг Vт, и можно положить Vг Vт Vг=V.
Из
уравнения состояния идеального газа
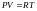
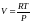 .
.
Тогда
уравнение (5) примет вид
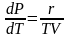 или
или
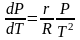 .
(6)
.
(6)
Это
уравнение с разделяющими переменными: .
(7)
.
(7)
Решение
уравнения (7) имеет вид: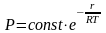 ,
,
или
учитывая, что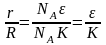 ,
,
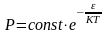 ,
(8)
,
(8)
где энергия связи отдельно атома с кристаллом.
В
Рис. 7
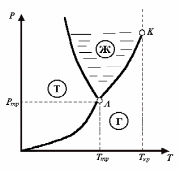 ид
фазовой диаграммы Р=Р(Т)
для
превращения ТГ
приведен на рис. 7. Как видно из рис. 7,
все три фазовые диаграммы сходятся в
одной точке (тройной точке А)
и разбивают координатную плоскость на
три области: область твердой фазы,
область жидких состояний и область
газообразных состояний вещества. Любая
точка в одной из этих областей изображает
соответствующее однофазное состояние
вещества. Всякая точка, лежащая на одной
из разграничивающих области кривых,
изображает состояние равновесия двух
соответствующих фаз вещества. Тройная
точка изображает состояние равновесия
всех трех фаз. Таким образом, каждая
точка на диаграмме изображает определенное
равновесное состояние вещества. Поэтому
ее называют диаграммой состояния.
ид
фазовой диаграммы Р=Р(Т)
для
превращения ТГ
приведен на рис. 7. Как видно из рис. 7,
все три фазовые диаграммы сходятся в
одной точке (тройной точке А)
и разбивают координатную плоскость на
три области: область твердой фазы,
область жидких состояний и область
газообразных состояний вещества. Любая
точка в одной из этих областей изображает
соответствующее однофазное состояние
вещества. Всякая точка, лежащая на одной
из разграничивающих области кривых,
изображает состояние равновесия двух
соответствующих фаз вещества. Тройная
точка изображает состояние равновесия
всех трех фаз. Таким образом, каждая
точка на диаграмме изображает определенное
равновесное состояние вещества. Поэтому
ее называют диаграммой состояния.
Д
Рис. 8
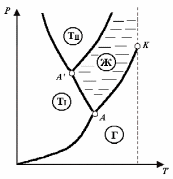 ля
вещества с несколькими кристаллическими
модификациями диаграмма состояния
имеет более сложный характер. На рис. 8
изображена диаграмма для случая, когда
число различных кристаллических
модификаций равно двум. В этом случае
имеются две тройные точки. В точке А
в равновесии находятся жидкость, газ и
первая кристаллическая модификация
вещества, в точке А
находятся в равновесии жидкость и обе
кристаллические модификации.
ля
вещества с несколькими кристаллическими
модификациями диаграмма состояния
имеет более сложный характер. На рис. 8
изображена диаграмма для случая, когда
число различных кристаллических
модификаций равно двум. В этом случае
имеются две тройные точки. В точке А
в равновесии находятся жидкость, газ и
первая кристаллическая модификация
вещества, в точке А
находятся в равновесии жидкость и обе
кристаллические модификации.
Диаграмма состояния для каждого конкретного вещества строится на основе экспериментальных данных. Зная диаграмму состояния, можно предсказать, в каком состоянии будет находиться вещество при различных условиях (при различных значениях Р и Т), а также какие превращения будет претерпевать вещество при различных процессах.
