
- •51. Статистический и термодинамический методы исследования вещества.
- •52. Основные положения молскулярно-кинетичсской теории.
- •53. Максвелловский закон распределения молекул газа по их скоростям.
- •54. Больцмановский закон распосделсния молекул газа по их энергиям.
- •55. Закон равномерного распределения энергии по степеням свободы молекул газа.
- •56. Молекулярно-кинстическое толкование абсолютной температуры
- •57. Первое начало термодинамики.
- •58. Адиабатический процесс.
- •59. Политропические процессы
- •60. Второе начало термодинамики.
- •61. Изопроцессы. Запишите уравнения состояния идеального газа для этих процессов и начертите их графики в координатах р и V, р и t, t и V.
- •62. Дайте определение полной, молярной и удельной тсплоемкостей газа.
- •63Дайте определение равновесного и неравновесного состояния системы.
- •64. Дайте определение обратимого и необратимого процесса.
- •65. Дайте определение кругового процесса (цикла). Объясните принцип действия тепловых машин.
- •66. Начертите цикл Карно в координатах р и V
- •67. Дайте определение энтропии. Чему равно изменение энтропии для обратимых и необратимых процессов.
- •Энтропия и второе начало термодинамики
- •73. Приведите барометрическую формулу. Для чего она служит?
- •74. Получите формулу для средней длины свободного пробега молекул газа.
- •75. Какое явление переноса в идеальном газе описывается выражением
- •78. Получите выражения для молярных теплоемкостей всех изопроцессов в идеальном газе. 79Получите соотношение Манера
- •Соотношение Майера
- •Соотношение Майера
- •94. Начертите изотерму Ван-дер-Ваальса и сравните ее с экспериментальной изотермой реального газа.
- •95. Дайте определение критического состояния газа. Получите выражения для параметров критического состояния газа.
- •96. Получите формулу для внутренней энергия реального газа.
- •97. В чем заключается эффект Джоуля-Томсона?
- •98. Получите уравнение Клапейрона-Клаузиуса для фазового превращения реального газа.
- •99. Нарисуйте диаграмму равновесных давлений и температур для двухфазной системы "жидкость - пар".
- •100Нарисуйте обобщенную диаграмму состояний для трехфазной системы "твердое тело - жидкость - газ". Дайте определение тройной точки.
- •Фазовые превращения реального газа
- •Уравнение Клапейрона-Клаузиуса и фазовая диаграмма для превращения жг
- •Уравнение Клайперона-Клаузиуса и Рис. 6 фазовая диаграмма для превращения тж
- •Уравнение Клайперона-Клаузиуса и фазовая диаграмма для превращения тг. Тройная точка. Диаграмма состояния.
96. Получите формулу для внутренней энергия реального газа.
Внутренняя энергия реального газа должна включать в себя, кроме кинетической энергии молекул, энергию взаимодействия между молекулами. Для нахождения внутренней энергии реального газа воспользуемся тем обстоятельством, что работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия:
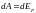 .
.
Силы
взаимного притяжения между молекулами
учтены в уравнении (3) с помощью добавки
к давлению
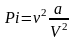 .
Соответственно работа против сил
взаимодействия между молекулами может
быть представлена в виде
.
Соответственно работа против сил
взаимодействия между молекулами может
быть представлена в виде
 .
Таким образом
.
Таким образом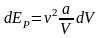 .
.
Интегрирование
этого выражения дает, что .
.
Внутренняя энергия реального газа U зависит как от объема, так и от температуры. Следовательно, выражение для U имеет вид:
 Это
выражение в пределе, при стремление
объема к бесконечности, должно переходить
в выражение
Это
выражение в пределе, при стремление
объема к бесконечности, должно переходить
в выражение
 для внутренней энергии идеального газа.
Следовательно,
для внутренней энергии идеального газа.
Следовательно,
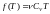 .
.
Итак,
внутренняя энергия реального газа
определяется формулой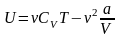 .
.
97. В чем заключается эффект Джоуля-Томсона?
Различают дифференциальный и интегральный эффекты Джоуля-Томсона. В технике для получения низких температур применяется интегральный эффект Джоуля-Томсона, но рассмотрение мы начнем с дифференциального эффекта или опытов Джоуля-Томсона (1852-1862 гг.). В этих опытах бралась цилиндрическая трубка, окруженная теплоизолирующим материалом. В середине трубки между двумя сетками MN и M1N1 (рис.2) помещалась пробка из плотной ваты или очесов шелка. Исследуемый газ под действием разности давлений медленно протекал через пробку. В этих условиях в каждый момент времени газ по обе стороны пробки находился в термодинамически равновесных состояниях. Давления газа по разные стороны пробки P1 и P2 поддерживались постоянными. При стационарном течении по одну сторону пробки устанавливалась постоянная температура газа Т1, по другую - постоянная температура Т2. Эти температуры и измерялись в опыте. Изменение температуры газа при стационарном течении газа через пробку и называется эффектом Джоуля-Томсона.
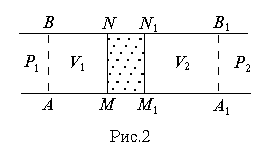
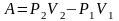 .
Применим к выделенной порции газа первое
начало термодинамики. Теплоты газ не
получал, так как стенки трубки
теплоизолированы, физическое состояние
пробки и ее внутренняя энергия остались
неизменными. Поэтому, обозначая внутреннюю
энергию выделенной массы газа U
, можно написать
.
Применим к выделенной порции газа первое
начало термодинамики. Теплоты газ не
получал, так как стенки трубки
теплоизолированы, физическое состояние
пробки и ее внутренняя энергия остались
неизменными. Поэтому, обозначая внутреннюю
энергию выделенной массы газа U
, можно написать
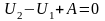 ,
или (12)
,
или (12)
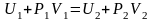 .
.
По
определению величина
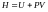 есть термодинамическая функция газа,
энтальпия.
Поэтому последнее равенство означает,
что в опыте Джоуля-Томсона энтальпия
газа не меняется, т.е.
есть термодинамическая функция газа,
энтальпия.
Поэтому последнее равенство означает,
что в опыте Джоуля-Томсона энтальпия
газа не меняется, т.е.
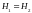 .
.
Это соотношение является основным в теории эффекта Джоуля-Томсона. Пусть по разные стороны пробки поддерживается малая разность давлений P. Соответствующая ей разность температур T измеряется в опыте. Течение газа предполагается установившимся. Задача теории состоит в том, чтобы, зная P и уравнение состояния газа, вычислить T. Поскольку в опыте Джоуля-Томсона энтальпия H не меняется то, рассматривая ее как функцию температуры и давления, можно написать
 .
(13)
.
(13)
