
- •51. Статистический и термодинамический методы исследования вещества.
- •52. Основные положения молскулярно-кинетичсской теории.
- •53. Максвелловский закон распределения молекул газа по их скоростям.
- •54. Больцмановский закон распосделсния молекул газа по их энергиям.
- •55. Закон равномерного распределения энергии по степеням свободы молекул газа.
- •56. Молекулярно-кинстическое толкование абсолютной температуры
- •57. Первое начало термодинамики.
- •58. Адиабатический процесс.
- •59. Политропические процессы
- •60. Второе начало термодинамики.
- •61. Изопроцессы. Запишите уравнения состояния идеального газа для этих процессов и начертите их графики в координатах р и V, р и t, t и V.
- •62. Дайте определение полной, молярной и удельной тсплоемкостей газа.
- •63Дайте определение равновесного и неравновесного состояния системы.
- •64. Дайте определение обратимого и необратимого процесса.
- •65. Дайте определение кругового процесса (цикла). Объясните принцип действия тепловых машин.
- •66. Начертите цикл Карно в координатах р и V
- •67. Дайте определение энтропии. Чему равно изменение энтропии для обратимых и необратимых процессов.
- •Энтропия и второе начало термодинамики
- •73. Приведите барометрическую формулу. Для чего она служит?
- •74. Получите формулу для средней длины свободного пробега молекул газа.
- •75. Какое явление переноса в идеальном газе описывается выражением
- •78. Получите выражения для молярных теплоемкостей всех изопроцессов в идеальном газе. 79Получите соотношение Манера
- •Соотношение Майера
- •Соотношение Майера
- •94. Начертите изотерму Ван-дер-Ваальса и сравните ее с экспериментальной изотермой реального газа.
- •95. Дайте определение критического состояния газа. Получите выражения для параметров критического состояния газа.
- •96. Получите формулу для внутренней энергия реального газа.
- •97. В чем заключается эффект Джоуля-Томсона?
- •98. Получите уравнение Клапейрона-Клаузиуса для фазового превращения реального газа.
- •99. Нарисуйте диаграмму равновесных давлений и температур для двухфазной системы "жидкость - пар".
- •100Нарисуйте обобщенную диаграмму состояний для трехфазной системы "твердое тело - жидкость - газ". Дайте определение тройной точки.
- •Фазовые превращения реального газа
- •Уравнение Клапейрона-Клаузиуса и фазовая диаграмма для превращения жг
- •Уравнение Клайперона-Клаузиуса и Рис. 6 фазовая диаграмма для превращения тж
- •Уравнение Клайперона-Клаузиуса и фазовая диаграмма для превращения тг. Тройная точка. Диаграмма состояния.
54. Больцмановский закон распосделсния молекул газа по их энергиям.
Если газ находится во внешнем силовом поле, то частицы газа обладают потенциальной энергией п . Рассмотрим распределение молекул идеального газа по высоте в однородном гравитационном поле. В этом случае для газа имеет место барометрическая формула:
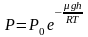 ,где
,где
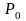 - давление газа на поверхности Земли,
- давление газа на поверхности Земли,
 - давление газа на высоте h.
- давление газа на высоте h.
С
учетом того, что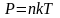 ,
,
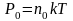 ,
,
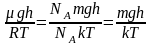 ,
,
получим
распределение молекул по высоте в
однородном гравитационном поле:
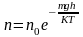 .
.
Больцман показал, что полученное распределение применимо к идеальному газу, находящемуся в любом силовом поле:
распределение
Больцмана молекул по их потенциальным
энергиям -
-
Если идеальный газ находится в силовом поле, то реализуются, вообще говоря, оба распределения: распределение Максвелла молекул по их кинетическим энергиям и распределение Больцмана молекул по их потенциальным энергиям.
Для этого надо объединить оба распределения:
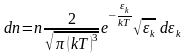 -
распределение Максвелла,
-
распределение Максвелла,
- распределение Больцмана,
В результате получим
распределение
Максвелла-Больцмана. -
-
55. Закон равномерного распределения энергии по степеням свободы молекул газа.
Внутренняя энергия идеального газа равна числу молекул газа, умноженному на среднюю кинетическую энергию одной молекулы.
U = N < >
При подсчете средней энергии молекулы пользуемся законом равномерного распределения энергии по степеням свободы молекул:
На
каждую степень свободы молекулы
приходится в среднем одинаковая
кинетическая энергия равная
 (k-постоянная
Больцмана).
(k-постоянная
Больцмана).
Числом степеней свободы i системы называется количество независимых величин, с помощью которых может быть задано положение системы.
Тогда средняя кинетическая энергия молекул равна:
Средняя кинетическая энергия молекул газа
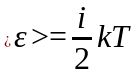 -
-
где i = iпост+ iвращ+ iколеб - общее число степеней свободы молекул.
Среднюю энергию молекулы можно представить в виде:
< > = < пост> + < вращ > + < колеб > .
При низких температурах ( Т < 1000К ) i = iпост+ iвращ .
56. Молекулярно-кинстическое толкование абсолютной температуры
57. Первое начало термодинамики.
Количество теплоты, сообщённое газу, идёт на приращение внутренней энергии газа и на совершение газом работы над внешними телами.

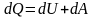 -
первое
начало термодинамики.
-
первое
начало термодинамики.
Определим физические величины, входящие в этот закон.
а)
Внутренняя
энергия
идеального газа равна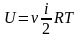 ,где
,где
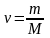 - количество вещества,
i
– число степеней свободы молекул газа.
- количество вещества,
i
– число степеней свободы молекул газа.
Тогда
изменение внутренней энергии газа
равно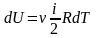 - изменение
внутренней энергии газа.
- изменение
внутренней энергии газа.
б)
Вычислим теперь работу,
совершаемую
газом при изменении объёма. Для этого
рассмотрим газ, находящийся в цилиндре
под поршнем, который может свободно
перемещаться. При нагревании давление
газа P
, будет оставаться постоянным, и, как
видно из рисунка, работа, которую
совершает газ, будет равна: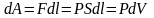 ,
,
