
- •11. Расчет высоты массообменных аппаратов с непрерывным контактом фаз. Высота и число единиц переноса.
- •12. Расчет высоты массообменных аппаратов с дискретным контактом фаз. Теоретическая и действительная ступень контакта.
- •15 Влияние температуры и давления на процесс абсорбции
- •16 Методы десорбции
- •21 Насадки для массообменных колонн. Их характеристика и выбор
- •25 Абсорбер с плоскопараллельной насадкой
- •37. Флегмовое число. Определение его минимального и оптимального значения.
- •39. Перегонка с дефлигмацией. Многократная перегонка.
- •45. Сушильные агенты. Выбор сушильного агента и режима сушки.
- •49.Простой сушильный вариант теоретической и реальной сушилок
- •50. Сушильный вариант с рециркуляцией сушильного агента
- •51.Сушильный вариант с промежуточным подогревом (по зонам).
- •52. Сушка топочными газами.
- •55 Барабанная сушилка
- •56 Камерная сушилка
- •57.Ленточные сушилки
- •58,Сушулки кипящего слоя
- •59 Пневматические сушилки.
- •60.Распылительные сушилки.
- •64. Расчет адсорберов
- •68. Экстракция. Основные понятия
- •69.Равновесие в системе
- •70.Принципиальные схемы проведения экстрагирования.
- •71. Типовые конструкции экстракторов. Роторно-дисковый экстрактор.
69.Равновесие в системе
По правилу фаз Гиббса С=К-Ф + n.
При проведении процесса жидкостной экстракции обычно температура не изменяется, а давление на равновесие в системе жидкость-жидкость практически не оказывает влияния. Поэтому для экстракции величина n = 0. Тогда для трехкомпонентной системы жидкость-распределяемое вещество-жидкость С = 1 (К = 3, Ф = 2, п = 0), и в ней можно изменять концентрацию одной из фаз без нарушения равновесия. При этом у* = f{x} т. е. данной концентрации распределяемого вещества х в одной фазе в состоянии равновесия соответствует определенная концентрация у* вещества в другой фазе. Эта связь следует так называемому закону распределения: отношение равновесных концентраций распределяемого между двумя жидкими фазами вещества при постоянной температуре есть величина постоянная:
m = у*/х или у* = mх,
где
у*
и
х-
равновесные
концентрации распределяемого вещества,
соответственно в экстракте и рафинате
в относительных единицах; т
- коэффициент
распределения.
 Следовательно,
в координатах у
–
х
при
постоянных температуре и давлении
получим обычную плоскую фазовую
диаграмму, причем линия равновесия
должна быть прямой, выходящей из начала
координат. Однако величина т
является
постоянной только при практически
полной взаимной нерастворимости
участвующих и процессе фаз, что довольно
редко встречается в реальных условиях.
Обычно значение т
зависит
от концентрации распределяемого
вещества, даже если температура при
этом постоянна. Причиной отклонения
закона распределения от прямолинейности
Следовательно,
в координатах у
–
х
при
постоянных температуре и давлении
получим обычную плоскую фазовую
диаграмму, причем линия равновесия
должна быть прямой, выходящей из начала
координат. Однако величина т
является
постоянной только при практически
полной взаимной нерастворимости
участвующих и процессе фаз, что довольно
редко встречается в реальных условиях.
Обычно значение т
зависит
от концентрации распределяемого
вещества, даже если температура при
этом постоянна. Причиной отклонения
закона распределения от прямолинейности
может быть ассоциация или диссоциация растворенного вещества в одной или обеих фазах. Если же при этом изменяется также и температура, то величина т может меняться еще сильней.
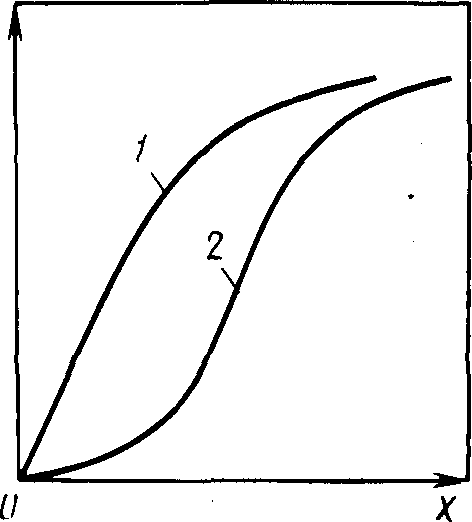
Изотермы экстракции. Линии равновесия на диаграмме у – х при постоянной температуре называют изотермами экстракции (рис. 1). Если известны изотермы для разных температур, то становится
Рис. 1. Типичные изотермы экстракции неэлектролитов (1) и электролитов (2)
Рис. 2. Обозначение концентраций на треугольной диаграмме
Р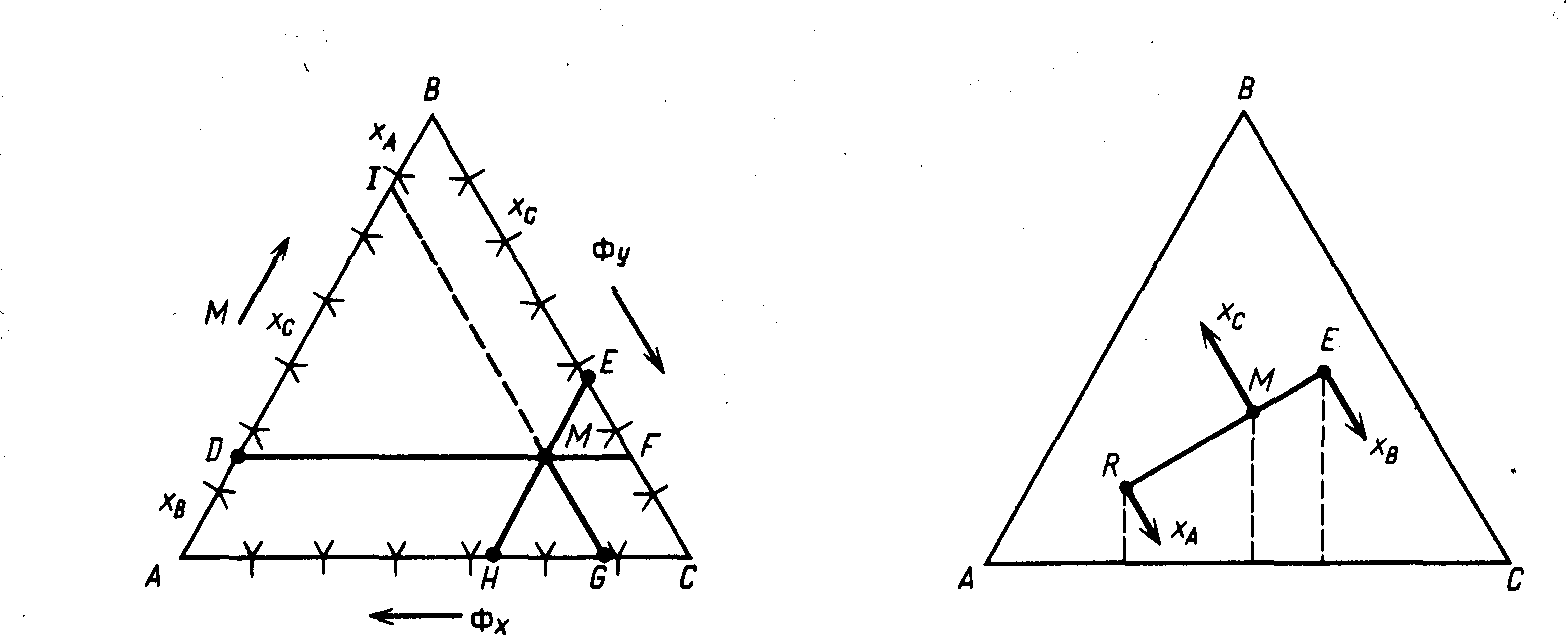 ис.
3. Применение правила рычага на треугольной
диаграмме
ис.
3. Применение правила рычага на треугольной
диаграмме
возможным выбор оптимальной температуры экстрагирования. Может оказаться, например, что наиболее экономичным будет проведение процесса экстракции при нагревании.
Треугольные диаграммы. Отметим, что часто фазы, участвующие в процессе жидкостной экстракции, частично растворимы друг в друге. В таких случаях экстракт помимо экстрагента и растворенного вещества содержит еще некоторое количество растворителя из исходного раствора, а рафинат помимо первоначального растворителя и некоторого количества растворенного вещества - определенное количество экстрагента. Оба раствора состоят из трех компонентов. Составы этих фаз удобно представлять в треугольной системе координат (рис. 2).
Вершины Л, В и С обозначают чистые компоненты. Стороны А В, ВС и С А соответствуют составам двухкомпонентных растворов. На каждой стороне нанесена шкала в молярных или массовых процентах (от 0 до 100%). Точки на площади треугольника соответствуют составам трехкомпонентных растворов, причем концентрация того или иного компонента раствора определяется длиной отрезков, проведенных параллельно каждой из сторон треугольника до пересечения с другими (например, для точки М концентрации раствора характеризуются точками D, Е, Я и на рис. 2 составляют 18% компонента А, 25% компонента В и 57% компонента Q. Действительно, сумма отрезков ME + МD + МН равна стороне треугольника, например АВ, так как MD — ID, ME — IB, MH - AD, а сумма отрезков AD + ID + IB == АВ, т.е. их сумма составляет 100%. Таким образом, любая точка внутри треугольника выражает состав трехкомпонентной системы, а точки на его сторонах - составы двухкомпонентных систем.
С помощью треугольных диаграмм, используя правило рычага, можно достаточно просто определить не только состав, но и количество (массу) фаз (рис. 3). Средний состав смеси, образующейся при смешении двух трехкомпонентных смесей (например, состава RnE) лежит на отрезке прямой, соединяющей эти точки (например, состава М). Эта точка М по правилу рычага разделяет полученный отрезок на отрезки, обратно пропорциональные количествам (массам) исходных смесей. При разделении М кг смеси
R + E=M,
а по правилу рычага
Е/R = RM/(ЕМ) 18.2
где Е и R - количества экстракта и рафината соответственно, кг.
Выражение (18.2) позволяет найти положение точки М, если известны количества растворов R и Е.
При расчете процесса экстракции, так же как и любого другого массообменного процесса, необходимо знание равновесных концентраций, которые для трехкомпонентных систем жидкость-жидкость можно представить на треугольной диаграмме. На рис. 18-5 вершина А соответствует растворителю в исходном растворе, вершина Д-растворенному веществу, вершина С-экстрагенту. На такой диаграмме при данной температуре рассмотрим систему, состоящую из компонентов А, В и С, причем компоненты А и В, В я С неограниченно растворимы друг в друге, а компоненты А и С-ограниченно растворимы. При наличии в системе определенных количеств компонентов А и С может образоваться двухфазная жидкая система.
Если к растворам компонентов А и С, составы которых на рис. 18-5 изображаются точками G^ и G2, добавить третий компонент Ву то составы трехкомпонентных расслаивающихся растворов будут соответствовать точкам Dx и D2. Хорда, соединяющая точки DA и D2, соответствует растворам, находящимся и равновесии друг с другом. При дальнейшем добавлении компонента В получим расслаивающиеся системы, характеризующиеся точками Ev и Е2, и т.д. Эти точки постепенно сближаются, поскольку добавление компонента В в систему улучшает взаимную растворимость компонентов А и С. Наконец, после прибавления еще некоторого количества компонента В взаимная растворимость компонентов А и С настолько возрастает, что образуется однофазный раствор, характеризуемый точкой К. Эту точку называют критической. Соединяя точки Dv Ex и т.д., получают
Р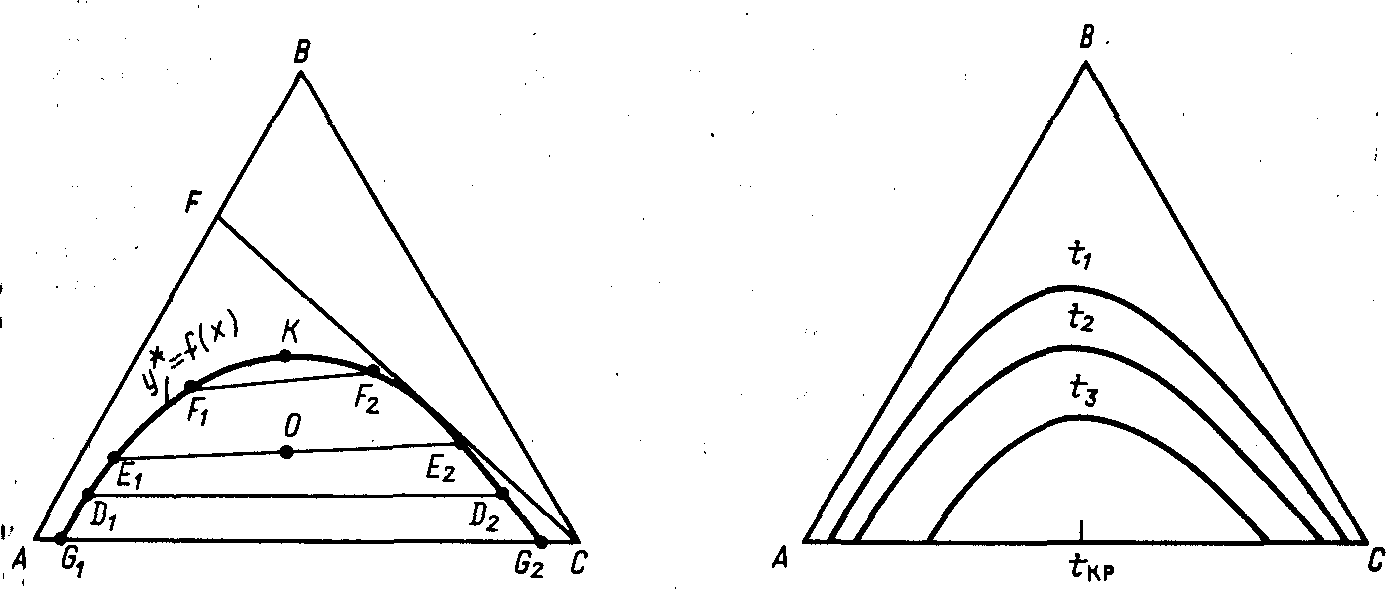 ис.
18-5. Равновесная кривая на треугольной
диаграмме
ис.
18-5. Равновесная кривая на треугольной
диаграмме
Р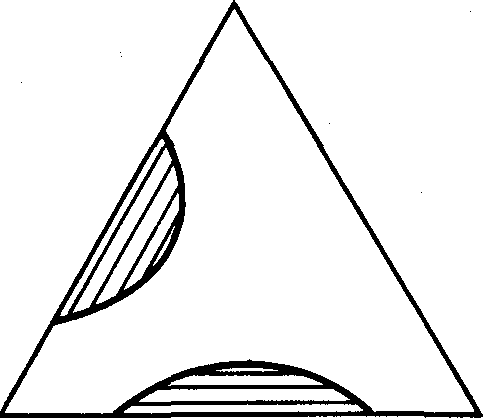
 ис.
18-6. Влияние температуры на положение
бинодальных кривых
ис.
18-6. Влияние температуры на положение
бинодальных кривых
Рис. 18-7. Типы треугольных диаграмм с двумя (а) и одной (б) зонами ограниченной растворимости
равновесную, или бинодальную, кривую, выше которой система однофазна и для процесса экстрагирования интереса не представляет.
Хорды, соединяющие точки Di и D2, Ex и Е2 и т.д. на бинодальной кривой, называют конодами, которые непараллельны друг другу, так как компонент В неравномерно распределяется между компонентами A и С. Любая точка, например точка 0 на рис. 18-5, лежащая внутри площади, ограниченной равновесной кривой, соответствует двухфазной системе, составы которой Е1 и Е2 выражены концами хорды, проходящей через точку О. На участках AGX и CG2 на стороне АС образуются однородные (гомогенные) растворы компонентов А и С На участке GlG2 любая смесь компонентов А и С расслаивается на два однородных двухкомпонентных насыщенных раствора {А и С). С помощью треугольной диаграммы и кривой равновесия (рис. 18-5) можно определить предельную концентрацию компонента В в исходном растворе, не превышая которую можно экстрагировать этот компонент. Проведем из точки С касательную к равновесной кривой. Она пересечет сторону АВ треугольника, отражающую состав исходного раствора в точке. S. Эта точка определяет предельную концентрацию исходного (экстрагируемого) раствора при данной температуре. Действительно, при увеличении отрезка AS линия CS пройдет через области диаграммы, соответствующие однофазной системе, что исключает экстракцию. При этом расход экстрагента (на диаграмме рис. 18-5-компонента С) максимален.
Поскольку растворимость зависит от температуры, то с изменением температуры будет менять свое положение и бинодальная кривая. Обычно взаимная растворимость с повышением температуры увеличивается, поэтому область существования гетерогенных систем уменьшается и при достаточно высоких температурах эта область может вообще исчезнуть. Температуру, соответствующую полному взаимному растворению компонентов системы и образованию таким образом гомогенного раствора, называют критической (рис. 18-6).
Кроме рассмотренной на рис. 18-5 типовой треугольной диаграммы, возможны также их другие типы (рис. 18-7): например, с двумя зонами ограниченной растворимости (рис. 18-7, я), которые могут слиться в одну зону ограниченной растворимости (рис. 18-7,6), и др
МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССА ЭКСТРАКЦИИ
Если участвующие в процессе экстракции фазы практически нерастворимы, то материальный баланс процесса описывается общим уравнением При однократном взаимодействии фаз (периодическая экстракция) материальный баланс процесса по потокам принимает вид уравнения (15.7):
Gн + Lн = Gк + Lк
или в принятых в данном разделе обозначениях
F + S = E+R, (18.4)
где F, S - количества исходного раствора и экстрагента соответственно, кг.
Уравнение (18.4) может быть использовано и для непрерывного процесса при условии, что все входящие в него величины выражаются в единицах расхода, например в кг/с. Поэтому для анализа и расчета процесса экстракции в условиях взаимной нерастворимости фаз можно использовать известный метод графического построения равновесной и рабочей линии на фазовой диаграмме у — х, с помощью которого определяют движущую силу процесса и высоту экстрактора (например, через ЧТТ или ЧЕП).
О днако
чаще участвующие в жидкостной экстракции
фазы обладают частичной взаимной
растворимостью. Поэтому количества
потоков по высоте экстрактора будут
изменяться, а значит отношение L/G
в
уравнении (15.9) не будет постоянным. Тогда
очевидно, что на диаграмме у
— х рабочая
линия будет криволинейной. Поскольку
в этом случае система является как
минимум трехкомпонентной, то для анализа
таких систем целесообразно воспользоваться
треугольной диаграммой для построения
не только равновесных, но и рабочих
концентрационных зависимостей.
днако
чаще участвующие в жидкостной экстракции
фазы обладают частичной взаимной
растворимостью. Поэтому количества
потоков по высоте экстрактора будут
изменяться, а значит отношение L/G
в
уравнении (15.9) не будет постоянным. Тогда
очевидно, что на диаграмме у
— х рабочая
линия будет криволинейной. Поскольку
в этом случае система является как
минимум трехкомпонентной, то для анализа
таких систем целесообразно воспользоваться
треугольной диаграммой для построения
не только равновесных, но и рабочих
концентрационных зависимостей.
Рис 18-8. К выводу уравнения материального баланса жидкостной экстракции
Для этого перепишем уравнение (18.4) следующим образом:
F + S = M = R + E. . (18.4а)
Выражение (18.4а) позволяет представить материальный баланс на треугольной диаграмме (рис. 18-8), например, как процесс смешения потоков F + S = М и затем разделения этой тройной смеси состава М на потоки R + Е. По правилу рычага
F/S = SM/(FM) (18.5)
можно при заданной величине F найти необходимое для процесса количество экстрагента S. Соотношение между величинами получаемых при этом потоков экстракта Е и рафината R находят по выражению *(18.2).
Материальный баланс компонентов А и В в потоках, например экстракта Е и рафината R, с учетом рис. 18-3 выразится так:
RxAR + ExAE = MxAM (18.6)
RxBR + ЕхВЕ = МхВМ' 18.7
Так как сумма концентраций всех трех компонентов А, В и С равна 100% (см. рис. 18-3), то материальный баланс по экстракту (т.е. по компоненту С) не нужен.
Из выражений (18.6) и (18.7), исключая величину М, получим
Е (xАЕ - xAm) = R(xAM - xAr) (18.8)
Е (ХВЕ - ХВМ) = R(XBM - XBR) (18.9)
Разделив уравнение (18.8) на (18.9), получим выражение
(ХAE – ХBE)/(ХBE – ХBM) = (ХAM - ХAR)/(ХBM – ХBR) (18.10)
которое является уравнением прямой линии.
Уравнения (18.2), (18.4) —(18.9) позволяют определить количество и состав любого потока, если заданы количества и составы трех остальных потоков.
