
- •11. Расчет высоты массообменных аппаратов с непрерывным контактом фаз. Высота и число единиц переноса.
- •12. Расчет высоты массообменных аппаратов с дискретным контактом фаз. Теоретическая и действительная ступень контакта.
- •15 Влияние температуры и давления на процесс абсорбции
- •16 Методы десорбции
- •21 Насадки для массообменных колонн. Их характеристика и выбор
- •25 Абсорбер с плоскопараллельной насадкой
- •37. Флегмовое число. Определение его минимального и оптимального значения.
- •39. Перегонка с дефлигмацией. Многократная перегонка.
- •45. Сушильные агенты. Выбор сушильного агента и режима сушки.
- •49.Простой сушильный вариант теоретической и реальной сушилок
- •50. Сушильный вариант с рециркуляцией сушильного агента
- •51.Сушильный вариант с промежуточным подогревом (по зонам).
- •52. Сушка топочными газами.
- •55 Барабанная сушилка
- •56 Камерная сушилка
- •57.Ленточные сушилки
- •58,Сушулки кипящего слоя
- •59 Пневматические сушилки.
- •60.Распылительные сушилки.
- •64. Расчет адсорберов
- •68. Экстракция. Основные понятия
- •69.Равновесие в системе
- •70.Принципиальные схемы проведения экстрагирования.
- •71. Типовые конструкции экстракторов. Роторно-дисковый экстрактор.
1.Массообменные процессы и аппараты. В химической технологии широко распространены и имеют важное значение процессы массопередачи, характеризуемые переходом одного или нескольких веществ из одной фазы в другую. Путем переноса одного или более компонентов из фазы в фазу можно разделять как гетерогенные, так и гомогенные системы (газовые смеси, жидкие растворы и др.), причем наиболее часто процессы массопередачи используют для разделения гомогенных систем.В промышленности применяются в основном следующие процессы массопередачи между газовой (паровой) и жидкой, между газовой и твердой, между твердой и жидкой, а также между двумя жидкими фазами:1.Абсорбция – поглощение газа жидкостью, т. е. процесс разделения, характеризуемый переходом вещества из газовой фазы в жидкую. Обратный процесс выделения газа из жидкости называется десорбцией.2.Экстракция (в системе жидкость – жидкость)– извлечение вещества, растворенного в жидкости, другой жидкостью, практически не смешивающейся или частично смешивающейся с первой. При этом извлекаемый компонент исходного раствора переходит из одной жидкой фазы в другую.3. Ректификация – разделение гомогенных жидких смесей путем многократного взаимного обмена компонентами между жидкой и паровой фазами, движущимися обычно противотоком друг к другу.4. Адсорбция – поглощение компонента газа, пара или раствора твердым пористым поглотителем, т. е. процесс разделения, характеризуемый переходом вещества из газовой (паровой) или жидкой фазы в твердую. Обратный процесс – десорбция проводится после адсорбции и часто используется для регенерации поглощенного вещества из поглотителя.
Разновидностью адсорбции является ионный обмен – процесс разделения, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы растворов электролитов. 5. Сушка – удаление влаги из твердых материалов главным образом путем ее испарения. В этом процессе влага переходит из твердой фазы в газовую или паровую. 6. Кристаллизация – выделение твердой фазы в виде кристаллов из растворов или расплавов. Кристаллизация характеризуется переходом вещества из жидкой фазы в твердую вследствие изменения его растворимости. 7. Растворение и экстракция (в системе твердое тело – жидкость). Растворение характеризуется переходом твердой фазы в жидкую (растворитель) и представляет собой, таким образом, процесс, обратный кристаллизации. Избирательное растворение, предназначенное для извлечения того или иного компонента из твердого пористого материала, называется экстракцией из твердого, или выщелачиванием. Подобно теплопередаче массопередача представляет собой сложный процесс, включающий перенос вещества (массы) в пределах одной фазы, перенос через поверхность раздела фаз и его перенос в пределах другой фазы. Как известно, при теплопередаче обменивающиеся теплом среды в большинстве случаев разделены твердой стенкой, в то время как массопередача происходит обычно через границу раздела соприкасающихся фаз. Перенос вещества из фазы к границе раздела фаз или в обратном направлении, т. е. в пределах одной из фаз, называется массоотдачей. Процессы массопередачи можно разделить на две группы. К одной группе относятся процессы (абсорбция, экстракция и др.), в которых участвуют минимально три вещества: одно образует первую фазу, другое – вторую фазу, а третье представляет собой распределяемое между фазами вещество. Вещества, составляющие каждую из фаз, являются лишь носителями распределяемого вещества и сами не переходят из фазы в фазу. Так, например, при поглощении аммиака водой из его смеси с воздухом вода и воздух служат носителями распределяемого вещества – аммиака. К другой группе относятся процессы (например, ректификация), в которых вещества, составляющие две фазы, обмениваясь компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества. Распределяемое вещество внутри каждой фазы переносится путем диффузии, поэтому процессы массопередачи называются также диффузионными процессами. Для диффузионных процессов, по аналогии с процессами переноса тепла, принимают, что количество переносимого вещества пропорционально поверхности раздела фаз и движущей силе. Движущая сила характеризуется степенью отклонения системы от состояния динамического равновесия, выражаемой наиболее точно разностью химических потенциалов распределяемого вещества. Диффундирующее в пределах фазы вещество перемещается от точки с большей к точке с меньшей концентрацией, и в расчетах движущую силу процессов массопереноса выражают приближенно через разность концентраций, подобно тому, как в процессах теплопереноса ее выражают разностью температур. Процессы массопередачи избирательны в тех случаях, когда поглотитель извлекает только один компонент (или несколько компонентов) исходной смеси и практически не извлекает остальных ее компонентов. Эти процессы большей частью обратимы, т. е. могут протекать в противоположных направлениях в зависимости от температуры, давления и других условий их проведения. При этом направление перехода вещества из фазы в фазу определяется концентрациями распределяемого вещества в фазах и условиями равновесия.
2.Равновесие при массопередаче.Правило фаз. Знание равновесия в процессах массопередачи позволяет установить пределы, до которых могут протекать эти процессы. В основе равновесия лежит известное правило фаз:
Ф+С=К+2 где Ф – число фаз; С – число степеней свободы, т е. число независимых переменных, значения которых можно произвольно изменять без нарушения числа или вида (состава) фаз в системе; К – число компонентов системы. Правило фаз указывает число параметров, которое можно менять произвольно (в известных пределах) при расчете равновесия в процессах массообмена. Фазовое равновесие. Линия равновесия. Рассмотрим в качестве примера процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой, т. е. в виду отсутствия равновесия переходит из газовой фазы Фу, где его концентрация равна у, в жидкую фазу Фх, имеющую начальную концентрацию х = 0. С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью, пропорциоиальной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равны друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу.
При
равновесии достигается определенная
зависимость между предельными, или
равновесными, концентрациями
распределяемого вещества в фазах для
данных температуры и давления, при
которых осуществляется процесс
массопередачи. В условиях равновесия
некоторому значению
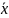 отвечает
строго определенная равновесная
концентрация в другой фазе, которую
обозначим через
отвечает
строго определенная равновесная
концентрация в другой фазе, которую
обозначим через
 .
Соответственно
концентрации
.
Соответственно
концентрации
 отвечает
равновесная концентрация
отвечает
равновесная концентрация
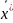 .
В
самом общем виде связь между концентрациями
распределяемого вещества в фазах при
равновесии выражается зависимостью:
.
В
самом общем виде связь между концентрациями
распределяемого вещества в фазах при
равновесии выражается зависимостью:
 (Х,8)
(Х,8)
или
 (X,
9)
(X,
9)
Любая из этих зависимостей изображается графически линией равновесия, которая либо является кривой, как показано на рис. Х-1, либо в частном случае - прямой линией.
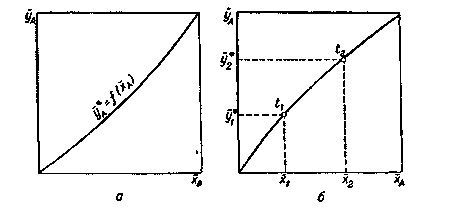
На рис. Х-1а показана равновесная кривая для системы с компонентами-носителями, выражающая зависимость равновесной концентрации, например в газовой фазе, от концентрации жидкой фазы при Р = const и t= const. На рис. Х-1,б приведен пример равновесной кривой для процесса ректификации, построенной при Р – const. Каждая точка кривой, как показано на рисунке, соответствует разным температурам (t1,t2 и т.д.). Отношение концентраций фаз при равновесии называется коэффициентом распределения:
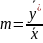 (X,
10)
(X,
10)
Коэффициент
распределения выражает тангенс угла
наклона линии равновесия и для кривой
линии равновесия является величиной
переменной. Конкретный вид законов
равновесного распределения, выражающих
зависимости (X,
8) и (X,
9), различен для разных процессов
массопередачи. Так, например, в процессе
абсорбции при низких концентрациях
распределяемого вещества в исходном
растворе равновесие описывается законом
Генри ( ,где
yA*—равновесная
концентрация извлекаемого компонента
в газовой фазе, кгА/кг(А+В);m
- коэффициент распределения;x
- концентрация газа в растворе, кмольА/кмоль
(А+В).), для идеальных растворов в процессах
ректификации - законом Рауля (рк
=
Рк
х,
где
рк
-парциальное
давление данного компонента в парах
над жидкостью, выраженное в долях
от общего давления; Рк–упругость
паров чистого данного компонента при
данной температуре; х–молекулярная
доля данного компонента в жидкости) и
т. д. Зная линию равновесия для конкретного
процесса и рабочие, т. е. неравновесные
концентрации фаз в соответствующих
точках, можно определить направление
и движущую силу массопередачи в любой
точке аппарата. На основе этих данных
может быть рассчитана средняя движущая
сила, а по ней – скорость процесса
массопередачи.
,где
yA*—равновесная
концентрация извлекаемого компонента
в газовой фазе, кгА/кг(А+В);m
- коэффициент распределения;x
- концентрация газа в растворе, кмольА/кмоль
(А+В).), для идеальных растворов в процессах
ректификации - законом Рауля (рк
=
Рк
х,
где
рк
-парциальное
давление данного компонента в парах
над жидкостью, выраженное в долях
от общего давления; Рк–упругость
паров чистого данного компонента при
данной температуре; х–молекулярная
доля данного компонента в жидкости) и
т. д. Зная линию равновесия для конкретного
процесса и рабочие, т. е. неравновесные
концентрации фаз в соответствующих
точках, можно определить направление
и движущую силу массопередачи в любой
точке аппарата. На основе этих данных
может быть рассчитана средняя движущая
сила, а по ней – скорость процесса
массопередачи.
3.Материальный
баланс. Рабочая линия.
Рабочие концентрации распределяемого
вещества не равны равновесным, и в
действующих аппаратах никогда не
достигают равновесных значений.
Зависимость между рабочими концентрациями,
распределяемого вещества в фазах
 изображается
линией, которая носит название рабочей
линии процесса. Вид функции
,
или
уравнение рабочей линии в его общем
виде, является одинаковым для всех
массообменных процессов и получается
из их материальных балансов.
изображается
линией, которая носит название рабочей
линии процесса. Вид функции
,
или
уравнение рабочей линии в его общем
виде, является одинаковым для всех
массообменных процессов и получается
из их материальных балансов.
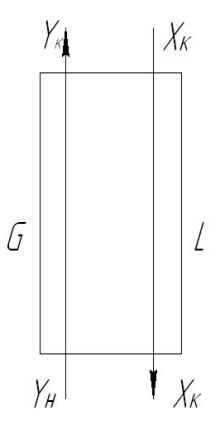
Р ассмотрим
схему массообменного аппарата, работающего
в режиме идеального вытеснения при
противотоке фаз (рис. Х-2). Пусть в процессе
массопередачи из фазы в фазу, например
из газовой фазы в жидкую, переходит
только одни распределяемый компонент
(скажем, аммиак). Сверху в аппарат
поступает Lн
кг/сек
одной
фазы (жидкой), содержащей хн
вес.
долей распределяемого компонента, а
снизу из аппарата удаляется LK
кг/сек той
же фазы, содержащей хк
вес.
долей распределяемого компонента.
Снизу в аппарат поступает Gн
кг/сек другой
фазы (газовой) концентрацией ун
и
сверху удаляется GK
кг/сек этой
фазы, имеющей концентрацию yк
вес. долей распределяемого компонента.
ассмотрим
схему массообменного аппарата, работающего
в режиме идеального вытеснения при
противотоке фаз (рис. Х-2). Пусть в процессе
массопередачи из фазы в фазу, например
из газовой фазы в жидкую, переходит
только одни распределяемый компонент
(скажем, аммиак). Сверху в аппарат
поступает Lн
кг/сек
одной
фазы (жидкой), содержащей хн
вес.
долей распределяемого компонента, а
снизу из аппарата удаляется LK
кг/сек той
же фазы, содержащей хк
вес.
долей распределяемого компонента.
Снизу в аппарат поступает Gн
кг/сек другой
фазы (газовой) концентрацией ун
и
сверху удаляется GK
кг/сек этой
фазы, имеющей концентрацию yк
вес. долей распределяемого компонента.
Тогда материальный баланс по всему веществу
Gн + Lн= Gк + Lк
и материальный баланс по распределяемому компоненту
 .
.
Теперь напишем уравнения материального баланса для части аппарата от его нижнего конца до некоторого произвольного сечения, для которого расходы фаз составляют G и L кг/сек, а их текущие концентрации равны у и х соответственно.
Материальный баланс по всему веществу Gн + L= G + Lк и материальный баланс по распределяемому компоненту
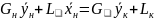 .
.
Решая это уравнение относительно у, получим:
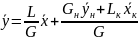 (X,
11)
(X,
11)
Уравнение (X, 11) представляет собой уравнение рабочей линии, выражающее связь между рабочими концентрациями распределяемого компонента в фазах для произвольного сечения аппарата.
Расходы фаз постоянны по высоте аппарата, например в процессах ректификации, когда числа молей компонентов, которыми обмениваются фазы, равны. В других случаях, если концентрации фаз мало изменяются по высоте аппарата, то расходы фаз по его высоте можно с достаточной для практических целей точностью считать постоянными, т. е. принять L == const и G = const. При этом LK = L, GH = G и уравнение (X, 11) приводится к виду
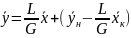 (X,
11а)
(X,
11а)
Вводя
обозначения,
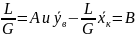 находим
находим
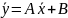 (X,
116)
(X,
116)
Выражения (X, 11а) и (X, 11б) являются уравнениями рабочей линии, которыми обычно пользуются при расчетах массообменных процессов.
Таким образом, рабочая линия представляет собой прямую, которая наклонена к горизонту под углом, тангенс которого равен А, и отсекает на оси ординат отрезок, равный В. Рабочая линия для всего аппарата ограничена точками с координатами хн и ук (верхний конец аппарата, рис. Х-2) и ун и хк (нижний конец аппарата).
4.Перенос
вещества молекулярной диффузией. Закон
Фика.
Молекулярной диффузией называется
перенос распределяемого вещества,
обусловленный беспорядочным движением
самих молекул. Молекулярная диффузия
описывается первым законом Фика, согласно
которому количество
вещества dМ
продиффундировавшего за время dτ
через элементарную поверхность dF
(нормальную к направлению диффузии),
пропорционально градиенту концентрации
 этого
вещества:
этого
вещества:
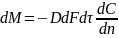
или

Из выражения (X, 12а) следует, что удельный поток вещества, переносимого молекулярной диффузией через единицу поверхности (F = 1) в единицу времени (τ = 1), или скорость молекулярной диффузии, составляет:
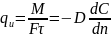
Коэффициент пропорциональности D в выражении закона Фика называется коэффициентом молекулярной диффузии, или просто коэффициентом диффузии. Знак минус перед правой частью первого закона Фика указывает на то, что молекулярная диффузия всегда протекает в направлении уменьшения концентрации распределяемого компонента.
Согласно
уравнению (X,
12), коэффициент диффузии выражается
следующим образом:
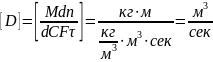 , откуда (до сокращения одноименных
величин) вытекает физический смысл D.
Коэффициент диффузии показывает, какое
количество вещества диффундирует в
единицу времени через единицу поверхности
при градиенте концентрации, равном
единице.
, откуда (до сокращения одноименных
величин) вытекает физический смысл D.
Коэффициент диффузии показывает, какое
количество вещества диффундирует в
единицу времени через единицу поверхности
при градиенте концентрации, равном
единице.
Коэффициент молекулярной диффузии представляет собой физическую константу, характеризующую способность данного вещества проникать вследствие диффузии в неподвижную среду. Величина D таким образом не зависит от гидродинамических условий, в которых протекает процесс.
Значения коэффициента диффузии D являются функцией свойств распределяемого вещества, свойств среды, через которую оно диффундирует, температуры и давления. Обычно величины D возрастают с увеличением температуры и понижением давления (для газов). В каждом конкретном случае значение D определяют по опытным данным или по теоретическим и полуэмпирическим уравнениям с учетом температуры и давления, при которых протекает процесс диффузии.
5.
Конвективная диффузия.
Ур-е переноса в-ва конв. дифузией. Ур-е
переноса в-ва конв. дифузией. В движущей
среде массоперенос осущ-ся как за счет
молекул-ой диф-ии так и за счет конвективного
переноса. Концентрация распред-го в-ва
в элементарном объеме изменяется не
только за счет хаот-го движ молекул но
и за счет макродвижений турбулентных
пульсаций в самой среде, т к среда
перемещается в направлении всех 3-х осей
х,у,z.
Со скоростямиWx,Wy,Wz,
то изменение концентрации распред-го
в-ва необходимо выражать субстациональной
прозв-й учитывающей изменение величины
во времени и изменение связанное с
перемещением в простр-ве.
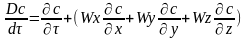 Если в Ур-ии молекулярной диффузии
заменить локальное изменение концентр-ии
на полное, то получим ДУ конвективного
массопереноса:
Если в Ур-ии молекулярной диффузии
заменить локальное изменение концентр-ии
на полное, то получим ДУ конвективного
массопереноса:
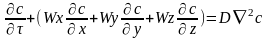 Данное Ур-е выражает распределение
концентрации в-ва движущейся в стационарной
среде, при неустан-ся процессе массообмена.
Данное Ур-е выражает распределение
концентрации в-ва движущейся в стационарной
среде, при неустан-ся процессе массообмена.
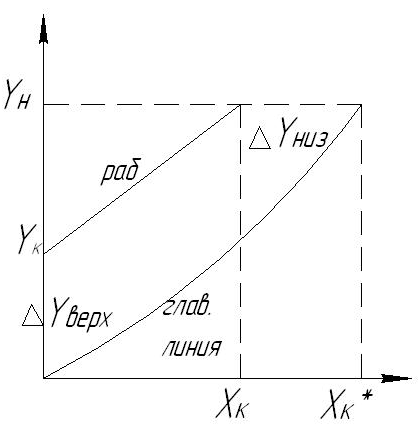
Возникновение массооб процесса, его направление и предел перехода в-ва из 1-й фазы во 2-ю зависит от степени отклонения с-мыот равновесия. По направлении переноса массы в с-ме можно судить о взаимном положении рабочей и равновесной линий. Рассм 2 случая:
1.
рабочая линия располагается выше
равновесной. Концентрация Х соот-ет,
что рабочая меньше равновесной, а у У
наоборот. При этом
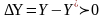 ,
,
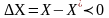 -
распределенный компопнент переходит
из 2-х(абсорбция)
-
распределенный компопнент переходит
из 2-х(абсорбция)
2 .
Рабочая линия распологается ниже
равновестной.
.
Рабочая линия распологается ниже
равновестной.
При
стремлении с-мы к состоянию равновесия
распр-й компонент переходит из жидкой
фазы в газовую(десорбция) Движущей силой
процесса масообмена условно называют
разность между рабочей и равнов
концентрациями переходного компонента
в данной фазе. Знак
 и
и
 указывает
на направление переноса массы.
указывает
на направление переноса массы.
6.
Механизм переноса тепла при конвективном
теплообмене.
Уравнение массоотдачи Для описания
механизма массопереноса множество
упращенных теор-их моделей. В основу
большинства из них положены 1 и те же
допущения: 1. Сопр-я массопереносу
складыв-ся из сопрот-й каждой из фаз и
сопр-я на границе раздела фаз. Допуская,
что сопр-е на пов-ти раздела фаз =0
принимаем, что процесс массопереноса
в каждой из фаз происходит независимо
друг от друга и общее сопр-ие рассматривают
как сумму всех сопрот-й. 2. На пов-ти
раздела фаз равновесие устан-ся почти
мгновенно и равновесная конценирация
на пов-ти отличается от соот-ей концентрации
в ядре потока. Ур-е массоотдачи : з-н
массоотдачи гласит: кол-во в-ва перенесённог
от пов-ти раздела фаз в воспринимающую
среду пропорц-но разности концентрации
у пов-ти фаз и потока восприним-ей фазы,
пов-ти фазового контакта и времени:
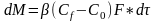 Коэф-т
Коэф-т
 хар-ет такое кол-во в-ва переходит от
границы раздела фаз в ядро потока через
пл-дь пов-ти 1
хар-ет такое кол-во в-ва переходит от
границы раздела фаз в ядро потока через
пл-дь пов-ти 1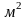 в течении 1 сек при разности концентрации=1.
При расчете конкретного процесса
массопереноса обычно принимают, что
коэф-т массоотдачи сохраняет свое
значение вдоль пов-ти контакта. Тогда
предыдущее Ур-е можно переписать:
в течении 1 сек при разности концентрации=1.
При расчете конкретного процесса
массопереноса обычно принимают, что
коэф-т массоотдачи сохраняет свое
значение вдоль пов-ти контакта. Тогда
предыдущее Ур-е можно переписать:
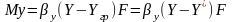 (G);
(G);
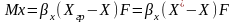 Входящие в Ур-е разности концентраций
выражают собой движущую силу процесса
в фазах G
и L.
Входящие в Ур-е разности концентраций
выражают собой движущую силу процесса
в фазах G
и L.
7.
критериеи диф-го подобия Nu,
Pe,Pr
При выборе условий и критериев диф-го
подобия исходят из ДУ молекулярного и
конвективного массопереноса в-ва. В
свою очередь сходство ДУ массо и тепло
переноса дает основание пологать, что
критерий диф-го и теплового подобия
имеет одинаковый вид. В этом легко
убедиться, анализируя условия массообмена
у границы разделе фаз. Кол-во распред-го
в-ва, переносимого от пов-ти контакта в
ядро потока можно выразить с помощью
Ур-я массоотдачи
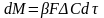 в свою очереть массоперенос в пограничном
слое, где приобладает молекул-я диф-я,
описывается Ур-ем Фика:
в свою очереть массоперенос в пограничном
слое, где приобладает молекул-я диф-я,
описывается Ур-ем Фика:
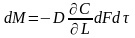 .
Приравниваем правые части Ур-ий, получим
выражение, хар-е граничные условия при
массопереноса
.
Приравниваем правые части Ур-ий, получим
выражение, хар-е граничные условия при
массопереноса
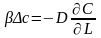 . Это выражение явл-ся з-ном сохранения
в-ва. Переходя к конкретным хар-ым
величинам и отбрасывая знаки мат-их
операторов будем иметь:
. Это выражение явл-ся з-ном сохранения
в-ва. Переходя к конкретным хар-ым
величинам и отбрасывая знаки мат-их
операторов будем иметь:
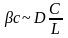 Разделив левую часть на правую получим
безразмерный комплекс
Разделив левую часть на правую получим
безразмерный комплекс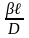 , который в подобных системах идентичен
и назван диффузионным числом Нуссельта
(Nu’)
, который в подобных системах идентичен
и назван диффузионным числом Нуссельта
(Nu’)
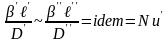 -
диф-е число Нуссельта.Диф-й критерий
Нуссельта хар-ет соотношение хар-го
размера в толщине пограничного слоя.
Для установления диф-го подобия в ядре
потока, за исходную позицию берут ДУ
конвективного массообмена. Для кратности
изложения запишем одномерное, нестац-е
Ур-е диффузии:
-
диф-е число Нуссельта.Диф-й критерий
Нуссельта хар-ет соотношение хар-го
размера в толщине пограничного слоя.
Для установления диф-го подобия в ядре
потока, за исходную позицию берут ДУ
конвективного массообмена. Для кратности
изложения запишем одномерное, нестац-е
Ур-е диффузии:
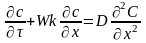 Проводя замену членов ДУ конечной
величины отбросив при этом знаки
математ-их операторов получим:
Проводя замену членов ДУ конечной
величины отбросив при этом знаки
математ-их операторов получим:
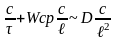 .
Разделив правую часть Ур-я на 1-е слогаемое
в левой части получим безразмерный
комплекс
.
Разделив правую часть Ур-я на 1-е слогаемое
в левой части получим безразмерный
комплекс
 ,
который для подобных процессов идентичный,
и назван диф-ым числом Фурье:
,
который для подобных процессов идентичный,
и назван диф-ым числом Фурье:
 -
идентичное число Фурье. Число Фурье
хар-ет подобие нестационарных процессов.
Поделив 2-е слагаемое предыдущего
выражения на правую часть, получим
безразмерный комплекс
-
идентичное число Фурье. Число Фурье
хар-ет подобие нестационарных процессов.
Поделив 2-е слагаемое предыдущего
выражения на правую часть, получим
безразмерный комплекс
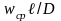 ,
который для диф-ых процессов идентичен
и назван диф-ым критерием Пекле:
,
который для диф-ых процессов идентичен
и назван диф-ым критерием Пекле:
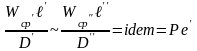 -
диф-е число Пекле. Число Пекле хар-ет
соотношение массовых потоков за счет
конвекции и диффузии. Если умножить
числитель и знаменатель в числе Пекле
на отношение
-
диф-е число Пекле. Число Пекле хар-ет
соотношение массовых потоков за счет
конвекции и диффузии. Если умножить
числитель и знаменатель в числе Пекле
на отношение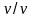 ,
то получим:
,
то получим:
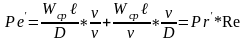 ,
где
,
где
 -
число Прандля диф-е, хар-ие физ-е св-ва
в-в в фазах и указывет на соотношение
между толщинами гидродинамического и
диф-ых слоев.Полученные из ДУ числа
подобия позволяют записать критериальное
Ур-е в неявной форме:
-
число Прандля диф-е, хар-ие физ-е св-ва
в-в в фазах и указывет на соотношение
между толщинами гидродинамического и
диф-ых слоев.Полученные из ДУ числа
подобия позволяют записать критериальное
Ур-е в неявной форме:
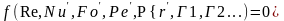 .
Из всех чисел диф-го подобия, включающих
первоначальные величины в число Nu
входит величина
,
которая сама зависит от нескольких
переменных и явл-ся искомой. Следовательно
критерий Nu
явл-ся определенным критерием, а
остальные- определяющие. В связи с этим
критериальные Ур-я представляют в таком
виде:
.
Из всех чисел диф-го подобия, включающих
первоначальные величины в число Nu
входит величина
,
которая сама зависит от нескольких
переменных и явл-ся искомой. Следовательно
критерий Nu
явл-ся определенным критерием, а
остальные- определяющие. В связи с этим
критериальные Ур-я представляют в таком
виде:
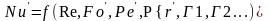 .
.
8
Массопередача Основное Ур-е массопередачи.
Средняя движущая сила массопередачи
Всоот-ии с общими кинет-ми законами
химико-технолог-х прочесов основной
з-н массопередачи можно сфор-ть следующим
образом. Скорость процесса массопередачи
проп-на движущей силе и обратно проп-на
сопротивлению.
 R-
сопротивление процессу массопереноса.
Если вместо R
взять обратную величину, хар-ю скорость
процесса 1\R=K
то предыдущее Ур-е примет вид:
R-
сопротивление процессу массопереноса.
Если вместо R
взять обратную величину, хар-ю скорость
процесса 1\R=K
то предыдущее Ур-е примет вид:
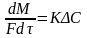 или
или
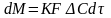 Отношение кол-ва распред-го в-ва между
фазами к 1 времени для всей пов-ти контакта
фаз Ур-е массопередачи примет вид:
Отношение кол-ва распред-го в-ва между
фазами к 1 времени для всей пов-ти контакта
фаз Ур-е массопередачи примет вид:
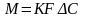 Согласно основному Ур-ю массопередачи
кол-во в-ва М переходящее из фазы в фазу
за 1 времени проп-но пов-ти контакта фаз
и движущей силе процесса. Коэф-т К
выражает собой кол-во в-ва переходящее
из 1-й фазы во 2-ю за 1 времени через 1
пов-ти контакта фаз при движущей силе
=1:
Согласно основному Ур-ю массопередачи
кол-во в-ва М переходящее из фазы в фазу
за 1 времени проп-но пов-ти контакта фаз
и движущей силе процесса. Коэф-т К
выражает собой кол-во в-ва переходящее
из 1-й фазы во 2-ю за 1 времени через 1
пов-ти контакта фаз при движущей силе
=1:
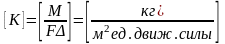 Движ-я сила процесса может быть выражена
в любых единицах.
Движ-я сила процесса может быть выражена
в любых единицах.
9.
связь между коэф-ми массопередачи и
массоотдачи.
Зав-ть К от
установим рассматривая массоперенос
распр-го в-ва из фазы G
в фазу L
на упрощенной модели. Рассмотрим случай,
когда равновесная линия прямая т е
описывается Ур-ем
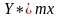 , m-
тангес угла наклона линии равновесия
к горизонтали. За 1 времени из фазы G
к выделенному элементу пов-ти dF
переносится кол-во в-ва равное:
, m-
тангес угла наклона линии равновесия
к горизонтали. За 1 времени из фазы G
к выделенному элементу пов-ти dF
переносится кол-во в-ва равное:
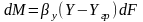 за это время от элемент-й пов-ти dF
в фазу L
переносится кол-во в-ва:
за это время от элемент-й пов-ти dF
в фазу L
переносится кол-во в-ва:
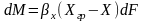 тогда для всей пов-ти контакта фаз можно
записать:
тогда для всей пов-ти контакта фаз можно
записать:
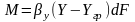 ;
;
 При линейной зав-ти между равновесными
концентрациями распред-го в-ва в фазах:
При линейной зав-ти между равновесными
концентрациями распред-го в-ва в фазах:
 либо по аналогии
либо по аналогии
 , где
, где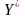 -
концентрация распредел-го в-ва в фазе
G
равновесна с конц-й в фазе L.
Из последних 2-х Ур-й выразим концентрацию
в фазе L
через конц-ю в фазе G:
-
концентрация распредел-го в-ва в фазе
G
равновесна с конц-й в фазе L.
Из последних 2-х Ур-й выразим концентрацию
в фазе L
через конц-ю в фазе G:
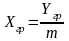 ;
; Подставим в Ур-е массотдачи:
Подставим в Ур-е массотдачи:
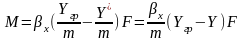 Выразив движущие силы по фазам:
Выразив движущие силы по фазам:
 ;
;
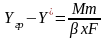 сложив левые и правые части Ур-я получим
движ-ую силу процесса в целом
сложив левые и правые части Ур-я получим
движ-ую силу процесса в целом
 ,
,
 Отсюда получаем зав-ти между коэф-ми
массоотдачи и массопередачи:
Отсюда получаем зав-ти между коэф-ми
массоотдачи и массопередачи:
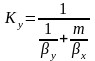 ;
;
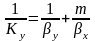
 -
общее сопротивление массопереносу,
-
общее сопротивление массопереносу,
 -
диф-е сопр-е газовой фазы,
-
диф-е сопр-е газовой фазы,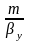 -
диф-е сопр-е жидкой фазы, т е по правтлу
адитивности общее диф-е сопр-е массопереноса
= сумме диф-ых сопр-й газовой и жидкой
фаз. При выражении коэф-та массопередач
концентрации фазы L
по аналогии можно получить
-
диф-е сопр-е жидкой фазы, т е по правтлу
адитивности общее диф-е сопр-е массопереноса
= сумме диф-ых сопр-й газовой и жидкой
фаз. При выражении коэф-та массопередач
концентрации фазы L
по аналогии можно получить
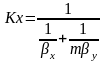 ;
;

m- коэф-т распределения .
10. Последовательность расчета массообменного аппарата. Определение поперечного сечения и высоты (длины) аппарата.
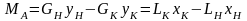 ,
,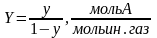
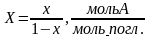
 ,
,
,
,

 ,
,
 ,
,
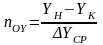 ,
,

 ,
,
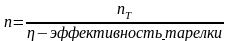
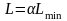 ,
,
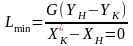
11. Расчет высоты массообменных аппаратов с непрерывным контактом фаз. Высота и число единиц переноса.
В случаях, когда пов-ть контакта фаз постоянно деформируется, ее размер установить почти нельзя, использовать основное ур-е массопередачи трудно
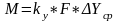
В
этом случае

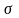 -
удельная пов-ть насадки аппарата,
(м2/м3),
-
удельная пов-ть насадки аппарата,
(м2/м3),
S – площадь поперечного сечения аппарата,
H – высота контактной зоны аппарата.
 =
=
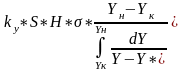
или согласно мат балансу по распределяемому компоненту M=G(Yн-Yк) получим

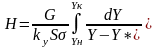 -
модифицированное ур-е массопередачи.
-
модифицированное ур-е массопередачи.
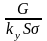 =hоу-
участок по высоте аппарата, соответствующей
1 единице переноса(ВЕП).
=hоу-
участок по высоте аппарата, соответствующей
1 единице переноса(ВЕП).
 =nоу-
число единиц переноса (ЧЕП).
=nоу-
число единиц переноса (ЧЕП).
аналогично для жидкой фазы.
 =hох
=hох
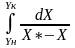 =nох
=nох
ВЕП имеет смысл величины обратной массопередаче, ЧЕП – обратной силе процесса.
12. Расчет высоты массообменных аппаратов с дискретным контактом фаз. Теоретическая и действительная ступень контакта.
Очевидно, число единиц переноса, соответствующее одной ступени изменения концентрации, тус или тхс, найдем как

При заданных величинах начальной и конечной концентрации распределяемого между фазами компонента число ступеней изменения концентрации Nс в случае линейной равновесной зависимости может быть определено аналитически. Число ступеней вычисляется как частное от деления числа единиц переноса mу, определяемого при заданных рабочих концентрациях, на число единиц переноса одной ступени тус
Nс= mу/ тус
Для перехода от числа ступеней к высоте насадки насадочных колонн можно написать уравнение
H= hус Nс
где hус—высота насадки, эквивалентная одной ступени изменения концентрации.
hус = hy тус
=hоу- участок по высоте аппарата, соответствующей 1 единице переноса(ВЕП).
=mоу- число единиц переноса (ЧЕП).
аналогично для жидкой фазы.
=hох =mох
ВЕП имеет смысл величины обратной массопередаче, ЧЕП – обратной силе процесса.
15 Влияние температуры и давления на процесс абсорбции
закон Генри
у*А=(Е/Р)*хА
может быть представлен в форме
у*А=mx
где m=Е/Р=tgα – коэффициент распределения, или константа фазового равновесия.
m зависит от темп-ры и давления системы.
С ↑Р, m↓,следоват. угол наклона равновесн. линии ↓ и растворимость поглощаемого газа↑.
(р2 ›р1)
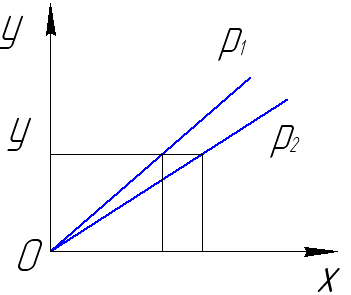
С ↑темп-ры константа фазового равновесия ↑,т.е. линия равновесия ↑,а растворимость ↓.

Для интенсификации процесса абс-ю надо проводить при повыш. давлении и понижен. темпер.,т.к. растворимость газов при этом ↑.
16 Методы десорбции
Десорбцию, или отгонку, т. е. выделение растворенного газа из раствора, проводят одним из следующих способов:
1) в токе инертного газа,
2) выпариванием раствора,
3) в вакууме.
Применяется также комбинирование этих способов.
Отгонка в токе инертного газа (собственно десорбция) является процессом, обратным абсорбции. При соприкосновении раствора с инертным газом растворенный газ переходит в газовую фазу, так как парциальное давление газа над раствором выше, чем в газовой смеси. Процесс ведут в насадочных или барботажных колоннах, раствор подается в колонну сверху, инертный газ – снизу; из нижней части колонны отводится регенерированный раствор, из верхней – выделенный из раствора газ в смеси с инертным газом. В качестве инертного газа применяют большей частью воздух. При этом выделенный из раствора газообразный компонент получается не в частом виде, а в виде смеси с воздухом. Поэтому данный способ отгонки применяется в тех случаях, когда извлеченный из газов компонент (например, вредная примесь) не используется или может быть использован при невысокой концентрации. Отгонка с инертным газом применяется также при обогащении газов, т. е. для получения более концентрированной газовой смеси, чем исходная смесь, из которой данный компонент извлекают путем абсорбции. При десорбции нерастворимых в воде газов в качестве инертного газа применяют водяной пар. Смесь выделенного компонента с водяным паром по выходе из колонны направляется в конденсатор, в котором водяной пар конденсируется, а выделяемый компонент получается в чистом виде. Если компонент имеет достаточно высокую температуру кипения (например, бензол), он конденсируется вместе с водяным паром и отделение его от воды производится путем отстаивания.I Отгонка путем выпаривания раствора производится при помощи обогрева глухим паром. При этом из раствора удаляется не только выделяемый компонент, но испаряется также часть растворителя. Для разделения компонента и паров растворителя прибегают к ректификации. Таким образом, по схеме процесса и применяемой аппаратуре этот способ отгонки не отличается от ректификации . Отгонка в вакууме обычно комбинируется с отгонкой путем выпаривания и применяется в тех случаях, когда при атмосферном давлении невозможно достаточно полное выделение компонента из поглотителя. При отгонке в вакууме газообразный компонент, выделяемый на установке, отсасывается вакуум-насосом.
