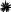- •Порядок оказания помощи при острых отравлениях
- •Классификация ядов
- •Факторы, влияющие на развитие отравления
- •Определение рН среды
- •Медь, цинк, кадмий
- •Мышьяк, ртуть
- •Метод Стаса-Отто
- •Папаверин
- •Алкалоиды производные тропана
- •1. Фосфид цинка Zn3p2
- •2. Ртуть, изол-е деструктивным м-м и м-м мокрого озоления. Какой лучше?
- •3. Подозрение на отравление ртутью.
- •4. Отравление парами ртури.
- •6. Парень, нюхавший момент.
- •9. Металлические яды.
- •28. Маковая соломка и таблетки «Седальгин»
Метод Стаса-Отто
50,0-100,0 биоматериала измельчают и заливают абсолютным этанолом, подкисляя щавелевой или винно-каменной кислотой до рН=2-3. Перемешиваем и проверяем значение рН, настаиваем при комнатной температуре в течение суток при периодическом перемешивании и проверяем значение рН. Жидкую фазу сливаем, операцию повторяем 2-3 раза (в течение 2-3 суток), затем биоматериал помещаем на фильтр и промываем спиртом; спиртовые вытяжки объединяют и упаривают на водяной бане при 40-50°С до густоты сиропа. Сиропообразную жидкость обрабатывают этанолом до прекращения выпадения осадка, жидкость фильтруют, снова упаривают до густоты сиропа и вновь осаждают белки. Остаток обрабатывают 20-25 мл воды, осадок отфильтровывают, проводят экстракцию хлороформа (203 порции), получают кислое хлороформное извлечение. Водную фазу подщелачивают 25% раствором NH4OH до рН=9-10, извлекают хлороформом (2-3) порции, получают щелочное хлороформное извлечение.
1. Для подкисления используют органические кислоты для избежания гидролиза сложноэфирных, амидных и других связей.
2. Для подщелачивания берут только NH4OH т.к. при использовании NaOH будут образовываться феноляты, ХР в воде.
Достоинства метода:
1. Данный метод является общим, им можно извлечь большую группу ТВ.
2. Извлечение получается чистым, можно работать с несвежим биоматериалом.
3. Этанол является универсальным растворителем и извлекает большое количество ТВ.
Недостатки:
1. Метод чрезвычайно длительный (7-10 рабочих дней).
2. Большое количество осаждений молекул приводит к потере ТВ.
3. Этанол является дорогостоящими растворителем.
Метод Васильевой.
50-100,0 биоматериала измельчают и заливают водой, подкисляя щавелевой или винно-каменной кислотой и настаивают при комнатной температуре в течение 1 часа, перемешивают, проверяют значение рН, вытяжку фильтруют, центрифугируют и экстрагируют хлороформом (трижды) – осторожно, во избежание эмульгирования с водой. Водную фазу подщелачивают 20% NaOH и трижды экстрагируют хлороформом.
Достоинства:
1. Быстро (в течение 1 рабочего дня).
2. Дешево.
3. Почти отсутствуют потери ТВ из-за многократной очистки вытяжки.
Недостатки:
1. Вода является не универсальным растворителем. Извлечение содержит большое количество балластных веществ, возможно образование эмульсии на этапе экстракции. Нельзя использовать с несвежим биоматериалом.
Частные методы изолирования:
Применяют при целенаправленно исследовании биоматериала.
На производные барбитуровой кислоты – метод Валова.
Биоматериал измельчают (50-100,0) и заливают 80 мл воды + 20 мл 10%NaOH, настаивают 0,5 часа при периодическом перемешивании. Извлечение сливают, центрифугируют, к центрифугату добавляют 120 мл 10% раствора вольфрамата натрия и 1М H2SO4 до рН=2 (образуется вольфрамовая кислота, осаждает белки). Нагревают и кипятят 20 минут, центрифугируют, центрифугат переносят в делительную воронку и проводят извлечение эфиром. К эфирному слою добавляют 50 мл 10%NaOH, водную фазу отделяют, добавляют 25%H2SO4 до рН=2 и вновь извлекают эфиром (метод реэкстракции). Настаивание производят в щелочной воде, т.к. барбитураты образуют соли.
Достоинства:
1.Хороший выход извлечения барбитуровой кислоты.
2. Недорого, недлительно.
3. Вытяжка получается чистой
Недостатки:
1. Частный метод (для других ТВ большие потери).
Метод Поповой.
50-100,0 биоматериала измельчают, прибавляют 80 мл 0,01М H2SO4 до рН=2-3, перемешивают, проверяют рН, настаивают 2 часа, водную вытяжку сливают, процедуру повторяют 2 раза, водные вытяжки объединяют и центрифугируют, очищают от примесей гель-хроматографией. Колонка «Сефадекс», «Д25». Элюат – концентрируют хлороформом.
Достоинства:
1. Частный метод.
2. Чистая вытяжка.
Недостатки:
1. Дороже, т.к. необходима чистка для колонки хроматографа.
На алкалоид – метод Кроморенко.
50-100,0 биоматериала измельчают и заливают 0,02М раствором H2SO4 до рН=2,5 (гидролиз алкалоидов не происходит, а извлечение лучше), настаивают 2 часа при периодическом перемешивании, проверяют рН,, водный слой процеживают. Операцию проводят 2 раза. Водную вытяжку объединяют, центрифугируют, добавляют сульфат аммония до насыщения (высаливание α-белков), центрифугируют, и извлекают эфиром 2-3 раза. К водной фазе прибавляют небольшими порциями раствор NaOH 20% (водная фаза содержит (NH4)2SO4 + NaOH NH4OH, которым и происходит подщелачивание) до рН=9-10 и экстрагируют эфиром или хлороформом.
Достоинства:
1. Частный метод ля алкалоидов, для синтетических веществ основного характера.
2. Быстро.
3. Вытяжка получается чистая.
Недостатки:
1. Для веществ кислого характере – плохо. Для некоторых групп алкалоидов – плохое извлечение.
Кофеин рН=4-5
Теофиллин рН=4-7
Промедол рН=7-8,5
Скополамин рН=8-10
Атропин рН=9-12
Хинин рН=10
На производные фенотиазина – метод Соломатина.
Биоматериал измельчают и заливают абсолютным этанолом, подкисляют щавелевой кислотой до рН=2-3 (оксалаты фенотиазина ХР в этаноле), настаивают 2 часа, вытяжку сливают, операцию повторяют 3 раза, обхединенную вытяжку упаривают на водяной бане до густоты сиропа. белки осаждаются абсолютным этанолом (смотри метод Стаса-Отто), спиртовую вытяжку упаривают досуха и растворяют в воде. Нагревают до 40-50°С, осадок отфильтровывают и проводят экстракцию эфиром 2 раза при рН=2-3. Возможно определение веществ кислого характера. Водную фазу подщелачивают до рН=13, и извлекают эфиром 2-3 раза. Эфирное извлечение обрабатывают водой, подкисляют 0,5М H2SO4, часть водной вытяжки хранят или используют для СФМ, частично вновь экстрагируют эфиром из щелочной среды и исследуют химическими методами.
(Производные фенотиазина в сухом виде быстро окисляются, поэтому их хранят в сернокислой среде).
Изолирование веществ из биожидкостей.
Проводят прямую жидкость-жидкость экстракцию.
К биожидкости (кровь, моча, промывные воды) с определенным значение рН (2-3 или 9-10) и затем экстрагируют органическим растворителем (хлороформ, эфир). В качестве очистки для крови используют высаливание (NH4)2SO4 или вольфраматом Na + H2SO4.
В моче – проводят реэкстракцию.
Если вещество подвергается метаболизму и в моче находится в виде глюкуронидов или сульфатов, проводят кислотный (производные 1,4-бензодиазепина) или ферментный (морфин) гидролиз. Или выполняют восстановление дитионитом натрия N-оксидов (морфин).
В качестве биожидкости может быть использована желчь.
Метод Груцхарди. Для бензонала, наксерона.
Производное пиримидина,
1,4-бензодиазепины
Сибазон - Sibazonum
(Диазепам, Седуксен, Валиум)
7-хлор-5-фенил-1-метил-1,2-дигидро-3Н-1,4-бенздиазепин-2-он. ЛФ - табл., растворы
![]()
Нитразепам - Nitrazepamum
7-нитро-5-фенил-3Н-1,4-бенздиазпин-2-он
Соединение окрашено - за счет нитрогруппы.
![]()
Оксазепам - Oxazepamum
(Тазепам, Назепам)
7-хлор-5-фенил-3-гидрокси-1,2-дигидро-3Н-1,4-бенздиазепин-2-он. ЛФ - табл.
![]()
Феназепам - Phenazepamum
7-бром-5-(о-хлорфенил)-3Н-1,2-дигидро-1,4-бенздиазепин-2-он.
![]() ЛФ
- табл., 0,1% р-р для инъекций.
ЛФ
- табл., 0,1% р-р для инъекций.
![]()
В большинстве препаратов присутствует амидная связь кислотные свойства.
Наличие азометиновой связи в положении 4 - 5.
Фенильный радикал - азометиновая связь
ковалентно связанный галоген или нитрогруппа в 7 положении.
Tox знач-е: транквилизаторы, снотворные, д/леч-я алкоголизма, пр/судорожные. Отравление: передозировка, суицид, в соч-ии с наркотиками. Стадии отр-я: 1. сонливость, слюнотеч-е, 2. ум-е сухожильных рефлексов, 3. глубокая кома, шок, 4. посткоматозное сост-е, различн осложнения. ПДП: форсированный диурез, гемодиализ, в/в ССС.
Изолирование: Стаса-Отто или Васильевой. М.б. в кислом и щелочном CHCl3 извл-ях.
Анализ: 1. по продуктам метаболизма: а) б/м настаивают с подкисленной водой или спиртом, экстрагируют CHCl3, к водному слою доб-т NH4OH до pH=9-10, снова экстр-т CHCl3. CHCl3 объед-т, выпаривают досуха, сух-й ост-к подвергают гидролизу H2SO4 или HCl. б) б/ж + HCl или H2SO4 (г-з) до бензофенонов.
Идентификация: 1. ТСХ по продуктам метаболизма (см выше) или по нативной мол-ле: детекция р-вом Драгендорфа. Система: толуол:ацетон:аммиак
1.
сух остаток + 1-3 кап HClк
– желтое окрашивание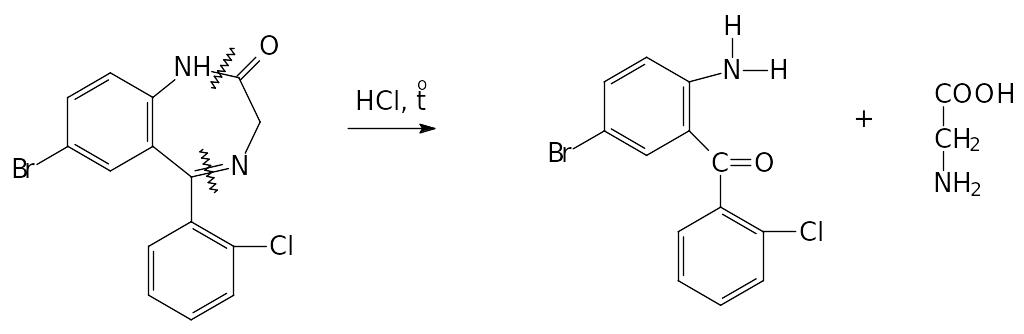
Возможно получение азокрасителя (р-я Братона-Маршала):
![]()
Применяется как реакция подлинности. СФМ в виде области спектра (азокраситель).
К.О.: 1. после ТСХ с пластинки элюируют ацетонитрилом, испаряют, к сух-у ост-ку гептан и иссл-т м-дом ГЖХ и кач-но и кол-но. 2. ВЖХ – УФ детекция. 3. УФ спектроскопия в EtOH. 4. ФКМ по р-ии Братона-Маршала.
5. Анализ по нативной мол-ле: изол-е общее (Стас-Отто, Васильева), экстр-т CHCl3, pH=10, очистка м-м ТСХ, элюируют с пластинки и вновь наносят на пластинку со свидетелями. Обр-т HClр, в термостат, + р-р NaNO3 в HCl, удал-м изб NaNO2 cульфонатом аммония, обр-м α-нафтилэтиленамином – в местах локализации – окраш-е
Производные пурина.
Coffeinum
![]()
Theophyllinum
![]()
Theobrominum
![]()
Теофиллин и теобромин за счет незамещенного водорода при N проявляют свойства кислот – амфотерные соединения. М.б. в кислом и щелочном CHCl3 извл-ии.
1. Групповая реакция – мурексидная проба – к сух ост-ку в фарф ч доб Br2 aq, нагреваем досуха, обр-м парами аммиака – пурп-фиол-е окр-е.
Кофеин:
Р-р в CHCl3 – испаряем – кр-лы в виде %
Теофиллин:
В фарф ч-ке к сух ост-ку 30% NaOH, нагреваем, охл-м, доб 1 мл воды (р-р А). в др фарф ч стрептоцид + HCl + NaNO2 (р-р Б). р-р Б приливают к р-ру А – красное окр-е.
теобромин:
1. Кобальтовые соли. Препарат + 0,1M NaOH, отфильтровывают, добавляют CoCl3 (Co(NO3)3).
Теофиллин белый с розовым оттенком
Теобромин фиолетовый раствор серо-голубой
Теофиллин в присутствии NH4OH + CoCl3 фиолетовый раствор.
Теобромин не взаимодействует.
2. Серебряные соли. Препарат растворяют в смеси H2O и NaOH, добавляют раствор NH4OH и AgNO3. Теобромин: образуется густая, желатинообразная масса, которая разжижается при нагревании и густеет при охлаждении. Теофиллин: белый осадок.
3. ИК спектр
Теофиллин – НеГФ:
1. Азокраситель (см. выше).
2. Со щелочным раствором нитропруссида натрия зеленое окрашивание.
Применение: Кофеин – стимулятор ЦНС, кардиотонический. Теофиллин и теобромин – сосудорасширяющее, бронхорасширяющее, диуретическое, спазмолитик.
Пр-е фенантренизохинолина: морфин, кодеин. Заменители морфина. Опий.
![]()
Опиаты – прир-е или синт-е в-ва с морфиноподобными св-ми, вл-т на ЦНС, гладкую муск-ру.
Морфин служит стандартом д/других Alk, сод в опии.
Опиаты выз-т эйфорию, при длит-м прим-ии требуется все большая доза д/дост-я эф-та. Выз-т физич и психич зав-ть → в мед практике прим-е огран-но.
Картина отр-я: сужение зрачков, кома, умен-е дых-я, ↓ t тела и АД. ЛД морфина 200мг, кодеина 0,8г.
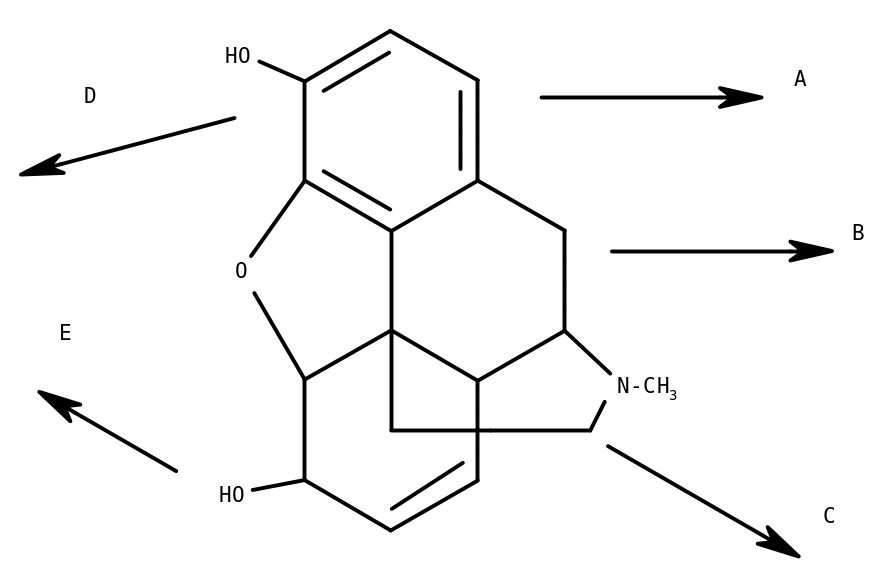
П/помощь: пром-е жел-ка, солевое слаб-е, форсир-й диурез, гемосорбция, гемодиализ. в/в атропин, иск-я вент-я легких, согревание тела.
Метаболизм: А – Метилирование; B – N-демитилирование, с окислением и обр-ем N→O; С, D – конъюгаты с глюкуроновой к-той и H2SO4,
Изол-е: из б/м м-д Кромаренко или общие Стаса-Отто и Васильевой. Очистка извл-я: колоночная хр-я. Из б/ж (кровь, моча) – в колбу + HCl – нагр-м (гидролиз) – охл-м - + дитионитNa (Na2S2O4) (восстановление N оксидов) – идентификация, далее доб-т NH4OH до pH 9-10 и экстр-т х/ф.
Идент-я: 1. ТСХ 2. УФ спектроскопия в 0,1н щелочи и к-те. 3. Групповая р-я – р-я Пиллагри: сух ост-к + конц H2SO4 и HCl – нагр-м до выд-я SO3, к ост-ку воду и по каплям NaHCO3 до щелочной р-ии, несколько капель р-ра J2 и эфир.

При отравлении опиатами эф слой розовый а водный – зеленый. 4. + р-в Марки – фиол-е окр-е. 5. Морфин + FeCl3 – голуб окр-е.
К.О.: 1. экстракционная ФК 2. по р-ии с FeCl3 (ФЭК или ФКМ в ВО) 3. ВЖХ 4. ГЖХ
Героин. 6-ацетоксиморфин. Иссл-ся как морфин
Кодеин. Изол-е как у морфина.
Идент-я: 1. ТСХ как опий 2. Р-я Пеллагри 3. УФ 4. ИК 5. ГЖХ 6. ВЖХ 7. осадки с общеAlk р-вами.
К.О. Экстракционная ФКМ: Ind – тропеолин 00, при вз-ии соед-я с Ind обр-ся ионный ассоциат, кот экстр-т х/ф или бензолом, х/ф слой отд-т → Dx (ФЭК) по калибр-му гр-ку.
Этилморфин (Дионин).
![]()
![]()
Получ-ся синт-м путем из морфина, токсичнее морфина. Изол-е, идент-я как у кодеина, отличается с пом-ю ТСХ, ВЖХ, ГЖХ.
Опий. Смесь Alk, получ-х из мака снотворного, в кот-х сод-ся морфин, кодеин, наркотин, папаверин + др Alk. Все Alk сущ-т в виде солей миконовой к-ты, H2SO4, молочной, т.о. в опии сод-ся миконин. Прим-ся в виде порошка, экстрактов, настоек – болеут-ее ср-во. При отр-ии наруш-я дых-я, непробудный сон. п/помощь – как морфин. Идент-я: 1. док-во суммы Alk и миконовой к-ты.
Сумму Alk док-т двумерной хроматографией. 1-е свидетели: спирт:диоксан:бензол:NH3, 2-е свидетели: этилацетат: метанол:NH3. Детекция – р-в Марки или р-в Фреде.
Док-во миконовой к-ты: ее изол-т подкисл-м спиртом, затем изв-е упаривают и к ост-ку доб-т горячую воду – фильр-т от балластных в-в + MgCl2 – фильтр-т + FeCl3 – набл-т кроваво-кр-е окр-е.
Миконин из-т подкисл-м спиртом, извлечение упар-т до небольшого V + бензол – экстр-я – бензол испаряют, к сух ост-ку + H2SO4 конц – зел-е окр-е, в теч 2-х суток- красное. Наличие миконовй к-ты, миконина позволяет отличить, чем было отр-е – опием или омнопоном.

ПРОМЕДОЛ. г/х зам-ль морфина
![]() .
Изол-е: мед-д Стаса-Отто или Васильевой,
Кромаренко. (pH
= 7-8,5). М.б. как в кислом, так и в щелочном
х/ф извл-ии. Идент-я: 1. ТСХ на пластинке
Силуфол с-ма р-лей метанол:х/ф, детекция:
р-в Марки (кр-фиол окр-е) 2. СФМ 3. ГЖХ 4.
ВЖХ. К.О. 1. экстр-я ФКМ с любым Ind,
дающим ионные ассоциаты 2. СФМ по р-ии с
р-вом Марки в ВО.
.
Изол-е: мед-д Стаса-Отто или Васильевой,
Кромаренко. (pH
= 7-8,5). М.б. как в кислом, так и в щелочном
х/ф извл-ии. Идент-я: 1. ТСХ на пластинке
Силуфол с-ма р-лей метанол:х/ф, детекция:
р-в Марки (кр-фиол окр-е) 2. СФМ 3. ГЖХ 4.
ВЖХ. К.О. 1. экстр-я ФКМ с любым Ind,
дающим ионные ассоциаты 2. СФМ по р-ии с
р-вом Марки в ВО.
ПАПАВЕРИН. ДИМЕДРОЛ ХИНИН
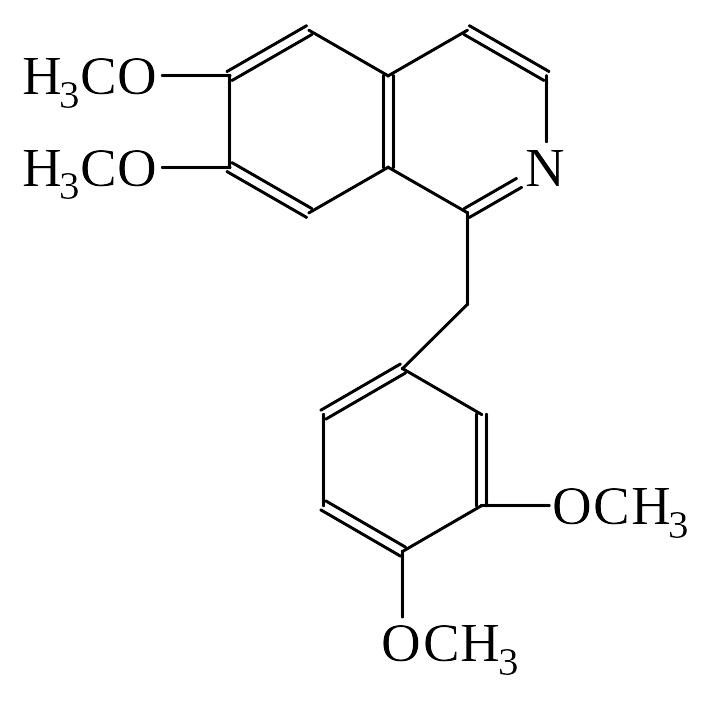
Tox знч-е: спазмолитик, оказ-т сосудорасшир-е д-е. Исп при бронх-й астме и с др ЛП.
Мет-м: ____________________________.
Изол-е: част-й – Кромаренко, общ – Стас-Отто и Васильевой. Слаб-е основание – м.б как в кислом, так и в щелочном извл-ии.
Идент-я: 1. ТСХ (х/ф:ацетон:диэтиламин), детекция – р-в Марки или Драгендорфа 2. УФ спектроскопия 3. цв р-ии с р-вами Марки, Фреде, Драгендорфа. 4. с общеAlk р-вами 5. микрокрист-я р-я с CdCl2 – кр-лы в форме квадратов, наложенных др на др.
К.О. Экстр-я ФКМ с люб Ind, дающим ионные ассоциаты.
ГЖХ, ВЖХ.
ДИМЕДРОЛ
![]()
β-диметил-аминоэтилового эфира
tox значение – п/гист-й преп-т д/леч-я крапивницы, разл-х форм аллергии, как снотворное и седативное – в форме табл, пор, амп-л. Отравление: сухость во рту, головкр-е, сонл-ть, зрачки расширены, тахикардия, ↓АД, при больших дозах возбужд-е, галлюц-я, судороги, кома.
П/помощь: пром-е жел-ка, форсир диурез, гемосорбция, при возб-ии – аминазин в/м, судороги – диазепам в/м.
Метаболизм: роисх-т в печени, всас-ся в кровь быстро, метабол-т до бензгидрола и N-диметила аминоэтанола.
Объекты иссл-я: печень, гол мозг, сод-е жел-ка, кровь, моча.
Изол-е: б/м – м-д Стаса-Отто, рН = 10; моча, кровь – прямая экстр-я х/ф рН=10. х/ф слой отд-т + р-р HCl (димедрол в виде соли в водный слой). х/ф отбр-т. К водному слою + р-р NaOH до рН = 10 и вновь х/ф.
Идент-я: 1. ТСХ – идент-я и очистка. х/ф:ацетон:NH3. Детекция: кH2SO4 – желтое пятно димедрола и бензгидрола (метаболит) или коричн – обраб-м парами J2 или р-вом Драгендорфа. 2. с общеАlk р-вами: р-в Драгендорфа, Майера (желт), Вагнера (кр-коричн). 3. р-в Марки (желт со временем перех-й в шоколадн); с кH2SO4 (лимонно-желт, исчез при доб воды); р-в Фреде (ярко-желт, перех в кр-оранж); 4. Микрокрист-е р-ии 5. УФ-спектроскопия этанол:HCl в ВО 6. ГЖХ - ДИП 7. ВЖХ – по абсолют и относит расстоянию и времени удерж-я.
К.О.: 1. УФ-спектроскопия с РСО 2. По р-ии с H2SO4, далее по калибровочному гр-ку 3. ВЖХ.
ХИНИН
талейохинная проба – в лекциях
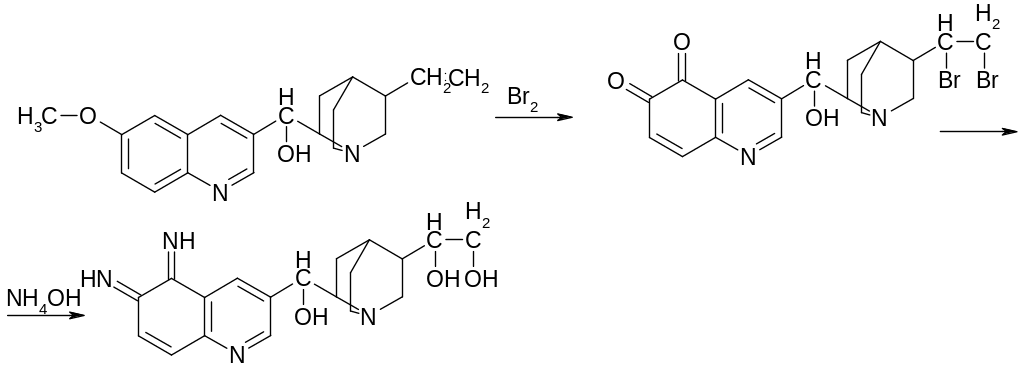
2. микрокрист-я р-я – (с роданидом аммония)