
- •Порядок оказания помощи при острых отравлениях
- •Классификация ядов
- •Факторы, влияющие на развитие отравления
- •Определение рН среды
- •Медь, цинк, кадмий
- •Мышьяк, ртуть
- •Метод Стаса-Отто
- •Папаверин
- •Алкалоиды производные тропана
- •1. Фосфид цинка Zn3p2
- •2. Ртуть, изол-е деструктивным м-м и м-м мокрого озоления. Какой лучше?
- •3. Подозрение на отравление ртутью.
- •4. Отравление парами ртури.
- •6. Парень, нюхавший момент.
- •9. Металлические яды.
- •28. Маковая соломка и таблетки «Седальгин»
Определение рН среды
Для исследования используют б/ж или водную вытяжку из б/м. Для получения водн вытяжки небольшое кол-во б/измельчают, встряхивают с небольшим колич-вом воды. Надосадочную жидкость сливают и исследуют.
Универсальные индикаторн бумажки:
- Красная лакмусовая бумажка (КЛБ)
- Синяя лакмусовая бумажка (СЛБ)
Если при исследовании б/ж СЛБ покраснела, то реакция среды кислая. Затем проводят исследования с красной бумажкой Конго. Если б.Конго синеет, о значит в объекте орг или минеральные кислоты введенные извне. Для определения хар-ра кислоты б/ж разбавляют в 5 раз и вновь наносят на б.Конго. При отравлении мин кислотой б.Конго Синеет, если орг к-та – цвет не изменяется.
Если при нанесении б/ж на КЛБ она синеет, то среда щелочная. Она м.б. обусловлена наличием едкой щелочи, карбонатной щелочи, аммиака.
- отличие едкой и карбонатной щелочи:
к 1мл б/ж + 1-2к р-ра ф/ф роз окраш-е + по каплям BaCl2. При наличии едкой щелочи розовая окраска сохраняется: 2NaOH + BaCl2 Ba(OH)2 + 2 NaCl
При наличии карбонатной щелочи окраска ф/ф исчезает и появляется осадок:
Na2CO3 + BaCl2 2NaCl + BaCO3↓
- определение аммиака:
часть б/ж после обработки BaCl2 наносят на КЛБ, бумажка синеет. Оставляют на воздухе на 20 минут. Если при этом бумажка приобрела розовое окрашивание – аммиак.
ЛЕТУЧИЕ ЯДЫ
1. Синильная кислота и ее соли. 2. Хлорированные углеводороды (CHCl3, CCl4, дихлорэтан). 3. Фенолы и крезолы. 4. Спирты: С1-С5.
5. Альдегиды и кетоны. 6. Карбоновые кислоты алифатического ряда.
7. Нитро и аминопроизводные алифатического ряда. 8. Гликоли (этиленгликоль).
Основной метод изолирования: метод дистилляции.
Для веществ, не смешивающихся с водой, для веществ, образующих азеотропную смесь, для веществ, смешивающихся с водой, для твердых веществ (хлорофос).
Температура кипения определяемого вещества всегда ниже, т.к. общее давление равняется сумме парциального давления определяемого вещества и воды.
Плюсы: Можно изолировать вещества органической и неорганической природы, одновременно с изолированием идет очистка органического вещества, можно использовать действующие вещества с высокой температурой плавления или те, которые при температуре разлагаются.
Минусы: Длительность, большой объем дистиллята, необходима аппаратура.
Способы дистилляции:
1) Макродистилляция. На анализ достаточно более 50,0 биологического объекта.
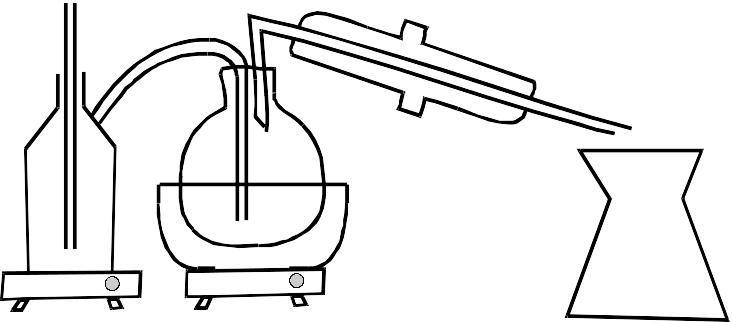
2) Макродистилляция с селективным уносчиком для получения азеотропной смеси. Для HCN используется N2, для этиленгликоля – бензол.
3) Микродистилляция. Если у нас имеется небольшое количество биологического объекта. Перегонка осуществляется с использованием дефлегматора (нет паровика).
4) Метод фракционной перегонки – происходит разделение яда по фракциям, которые анализируются отдельно.
5) метод паро-воздушной дистилляции. Для спиртов (метод Карандаева), для HCN (метод Герасимова).
К биологической жидкости добавляют K2CO3 чтобы из нее произошло высаливание спиртов. Бюкс помещают в термостат с 50-60°С. Спирт возгоняется, взаимодействует с реактивами – если есть зеленое окрашивание, значит, было отравление спиртом.
6) Суховоздушная дистилляция. Используют ГЖХ. Метод надежен, универсален, быстр. В пенициллиновый флакон помещают 1-2 мл биожидкости, закрывают пробкой, плотно укупоривая (алюминиевый колпачок), помещают в термостат. Шприцом отбирают газовую фазу и вводят в инжектор хроматографа.
7) Прямой ввод объекта в хроматограф с использованием предколонки, чтобы избавить от белков.
Условия дистилляции.
Четкий контроль рН среды. Чтобы провести дистилляцию, биоматериал подкисляют щавелевой или винно-каменной кислотой до рН=2.
Нельзя подкислять минеральными кислотами, т.к. можно потерять или переоткрыть яд.
HCN
![]() HCOONH4
HCOONH4
Ph-OSO3H Ph-OH + H2SO4
Не подкисляем, когда определяем свободную уксусную кислоту (промывные воды желудка).
Подкисляем H2SO4 и H3PO4 при определении общей уксусной кислоты (свободной и связанной с белками).
Подщелачиваем для веществ основного характера (никотин, анабазин, пахикарпин).
Подкислять необходимо, чтобы разрушить связь ТВ с белками.
Особенности изолирования некоторых летучих ядов.
Фенол и спирты C3-C5 – необходима пробоподготовка.
Реакции на фенол: с бромной водой и FeCl3. Мешают органические спирты и кислоты. К дистилляту добавляют NaHCO3, с которым кислоты образуют соли. Потом добавляют эфир, и фенол со спиртами экстрагируется в эфир. Эфир упаривают, с ним улетают спирты. К остатку добавляют воду и проводят качественные реакции.
Высшие спирты. Качественные реакции: реакция окисления, образования алкилацетатов, Комаровского (с салициловым альдегидом, ванилином, п-диметиламинобензальдегидом). Во всех реакциях используется к.H2SO4. Чтобы не разводить к.H2SO4 водой, к дистилляту добавляют эфир, проводят экстракцию, эфир испаряют и с остатком проводят качественные реакции.
Синильная кислота и ее соли, Метиловый спирт.
1. Токсикологическое значение: Используют в металлургии для выделения драгоценных металлов из руды, в производстве ювелирных изделий.
2. Действие на организм: LD50HCN – 1мг/кг, NaCN – 3мг/кг, амигдалин – 16 мг/кг. Отравление происходит быстро, потеря сознание, изгиб дугой, через 5 минут – смерть. Блокирует цитохромоксидазу и около 160 других ферментов.
3. Первая помощь: вдыхание амилнитрита, внутривенно раствор NaNO3. При этом образуется метгемоглабин, у которого сродство к CN выше, чем у цитохромоксидазы.
Внутрь – раствор Na2S2O3, при этом цианиды превращаются в роданиды.
Промывание желудка, стимуляция диуреза.
При вскрытии органы вишневого цвета, кровь алокрасная, ощущается запах миндаля.
На исследование отправляют отделы кишечника, печень, кровь, мочу и вещ. доки.
4. Сохраняемость в биологических объектах: начинают с вещ. доков, т.к. цианиды – не устойчивые соединения.
NaCN + CO2 + H2O HCN + NaHCO3
Температура кипения HCN = 26°C.
5. Метаболизм: HCN связывается –CHO группами сахаров:
R-CHO + HCN RCH(OH)CN.
С аминокислотами:
R-CH(NH2)-COOH + HCN [R-CH(NH3+)COOH]CN-
Под действием фермента роданазы переходит в роданиды:
CN-
![]() SCN-
SCN-
6. Изолирование:
а) Макродистилляция с селективным уносчиком (N2), синильную кислоту собирают в щелочной раствор.
б) Микродистилляция (из крови и мочи).
в) Паро-воздушная дистилляция (метод Герасимова).
7. Идентификация:
а) Образование берлинской лазури (голубое или зеленоватое окрашивание):
2NaCN + FeSO4 Na2SO4 + Fe(CN)2
4NaCN + Fe(CN)2 Na2[Fe(CN)6]
Na2[Fe(CN)6]
+ FeCl3
![]() NaFe[Fe(CN)6]•3NaCl
NaFe[Fe(CN)6]•3NaCl
При небольших количествах, окраска проявляется через 2 суток.
б) С пиридинбензидиновым раствором.
![]()
Для усиления окрашивания:
![]()
![]()
8. Количественное определение.
а) Материал свежий – аргентометрия по Фольгарду. Индикатор FeNH4(SO4)2.
б) Начались гнилостные процессы – гравиметрия.
HCN, H2S + 3AgNO3 AgCN↓, Ag2S↓ + 3HNO3
Осадок отфильтровывают, отделяют и промывают раствором NH4OH
Ag(NH3)CN переходит в раствор, а Ag2S остается на фильтре. К полученному раствору добавляют HNO3, AgCN снова выпадает в осадок, его промывают, высушивают, взвешивают.
в) С пиридинбензидиновым раствором (вторая реакция идентификации).
Метиловый спирт.
Прозрачная жидкость, легко смешивается с водой и органическими растворителями. Трудно отличимая от этанола.
1. Токсикологическое значение: используют как растворитель, для получения формальдегида, муравьиной кислоты, пластмасс.
2. Действие на организм. Токсическая доза – 7-8 мл. Смертельно – 30-100 мл. Отравление происходит при попадании внутрь, вдыхании с воздухом, попадании через кожу.
Стадии отравления:
а) Наркотическая (эйфория, аналогично этанолу).
б) Развитие ацидоза (за счет накопления HCOOH).
в) Поражение ЦНС, потеря зрения, остановка дыхания, отек головного мозга.
3. Первая помощь. Промывание желудка; внутрь / внутривенно 30% раствор спирта (этанол замедляет процессы окисления метанола); усиление диуреза, капельница.
5. Метаболизм: метанол легко распространяется по организму и тканям, наибольшее количество в печени, почках, меньше в головном мозге, жировых тканях. Метаболизирует следующим образом: формальдегид муравьиная кислота H2O + CO2 (процессы окисления очень медленные, полностью метаболизирует в течение 5 суток). Выводится с мочой и выдыхаемым воздухом.
6. Изолирование. Макродистилляция (температура кипения метанола – 56°С). Приемник охлаждается льдом. Из крови и мочи – паро-воздушная дистилляция; ГЖХ (алкилнитритный метод).
7. Идентификация.
а) Предварительная проба: для мочи с K2Cr2O7 и 50% H2SO4 зеленое окрашивание.
б) ГЖХ. Идентификация по времени удерживания.
в) Окисление до формальдегида.
г) С хромотроповой кислотой.
д) С фуксинсернистой кислотой (pH=0,7).
8. Количественное определение.
а) ГЖХ по методу внутреннего стандарта.
б) ФЭК, СФМ в видимой области по реакции с фуксинсернистой кислотой.
Этанол.
1. Токсикологическое значение. По смертности на 1 месте. Широко применяется в промышленности, в пищевой промышленности, медицине, в лабораториях, в парфюмерии.
2. Действие на организм. Токсическая доза индивидуальна. Смертельная доза – 6-8 мл на килограмм. Этанол – наркотический яд, возбуждение переходит в угнетение. Вызывает паралич ЦНС. При длительном хроническом приеме вызывает расстройство желудка, цирроз печен, поражение ЦНС, сердечно-сосудистой системы.
Этанол хорошо всасывается и распространяется, передается с грудным молоком. 20% всасывается в желудке, 80% всасывается в кишечнике.
Стадии резорбции: через 15-20 минут (на голодный желудок) и через 30-40 минут (на сытый желудок). Выводится через 15-25 часа.
5. Метаболизм. На 90% метаболизирует в печени (фермент алкагольдегидрогеназа переводит этанол в уксусный альдегид уксусную кислоту CO2 + H2O). Небольшая часть окисляется до ацетальдегида (фермент каталаза). 10% выводится в неизменном виде с мочой и воздухом. Концентрация алкоголя в биологической жидкости измеряется в промилле ‰.
Концентрация в крови(‰) |
Состояние организма |
0,1-0,2 |
Естественное состояние |
0,3-0,4 |
Имеет место прием алкоголя; выявляется специальными тестами врачом-наркологом. Небольшое нарушение координации движений, нарушение восприятия. |
0,5-0,9 |
Слабое опьянение, нарушение координации движений, слабость, несвязанная речь. |
1,0-1,9 |
Опьянение средней степени. Неясная речь, нарушение психики, нарушение координации. |
2,0-2,9 |
Сильное опьянение. Снижение болевой чувствительности, признаки отравления. |
3,0-5,0 |
Острое отравление. Коматозное состояние. |
Более 5,0 |
Смерть. |
На исследование в наркодиспансер необходимо прислать кровь и мочу, т.к. забор крови может быть сделан небыстро, а время элиминации этанола – 15-20 часов.
Для судебно-медицинской экспертизы: кровь, моча. При пожаре: мышечная ткань или головной мозг (для определения ацетальдегида), содержимое желудка.
Изолирование: макро и микродистилляция (из биологического материала). Из крови и мочи – алкилнитритный метод газохроматографией (получаем более летучие жидкости, чем исходные спирты).
NaNO2 + CCl3-COOH HNO2 + CCl3-COONa
HNO2 + ROH RONO + H2O
Трихлоруксусная (ТХУ) кислота необходима для осаждения белка и образования HNO2.
Антидотной терапии нет.
Идентификация:
1) Окисление до альдегида (при t) – Оранжевый цвет ->зеленый, запах резаных яблок.
С2Н5ОН + К2Cr2O7 +4H2SO4 3CH3C(H)O + Cr2(SO4)3 + 7H2O + K2SO4
2) Образование йодоформа – желтый осадок с характерным запахом и характерной формой кристаллов.
4J2
+8NaOH
2NaJ
+ 4NaOH
+4H2O
C2H5OH
+ NaOJ
CH3C(O)H
+ NaJ
+ H2O
CH3C(O)H
+
3NaOJ
CJ3C(O)H
+ 3NaOH
CJ3C(O)H + NaOH CHJ3 + HC(O)Ona
C2H5OH + K2Cr2O7 CHJ3 + HCOONa + 5NaJ + 5H2O
3) Образование этилацетата – специфический запах.
4) Образование этилбензоата.
5) ГЖХ – алкил-нитритный метод (по расстоянию или времени удерживания).
Количественное определение: ГЖХ алкилнитритным методом. В пенициллиновый флакон помещают 0,5 мл 50% ТХУ, 1 мл крови или мочи, вводят внутренний стандарт (1 мл 4‰ раствора пропанола или изопропанола), флакон закрывают, укупоривают металлическим колпачком под обкатку или пенициллиновый флакон помещают в металлический стакан, плотно закрывая навинчивающейся крышкой с отверстием для шприца. Шприцом вводят 0,5 мл раствора NaNO2, встряхивают (греть не надо). Чистым шприцом отбирают газовую фазу и вводят в хроматограф. На получившейся хроматограмме определяют высоту или площадь пика анализируемого спирта и стандарта. Находят отношение и определяют концентрацию по калибровочному графику.
![]()
При анализе этанола надо помнить, что в пробе нет стандарта, поэтому для качественного определения этанола в качестве стандарта вводят метанол. Если наблюдается 2 пика, значит, было отравление этанолом, если один пик – не было, если нет пиков – забыли добавить NaNO2
При отравлении метанолом можно взять любой стандарт, главное, чтобы расстояние удерживания стандарта отличалось от расстояния удерживания метанола.
Определение спирта в выдыхаемом воздухе:
1) Проба Рапопорта. Воздух продувают через раствор KMnO4 + H2SO4, если раствор обесцвечивается в течение 30 секунд, значит, было потребление алкоголя. Проба не специфична, реагирует на корвалол, ацетон, бензин.
2) Проба Рапопорта-Архангеловой. Вместо KMnO4 K2Cr2O7. Проба неспецифична.
3) Проба Мохова-Шинкоренко. В трубке CrO3 смешиваем с селикагелем и H2SO4, концы трубки обламываем и продуваем. Если окраска меняется с желтого на зеленый или синий (большое количество алкоголя). Проба неспецифична.
Для расчета концентрации алкоголя в крови, используют формулу Видмарка.
A = P • r (c + β60 • t)
A – количество алкоголя, принятого, г.
Р – масса тела.
r – коэффициент распределения (для мужчин – 0,68, для женщин – 0,55).
β60 – количество алкоголя, выделенного из организма за час – ~15‰.
С – концентрация в ‰, установленная методом ГЖХ.
t – время от момента приема до момента анализа.
Изоамиловый спирт, Этиленгликоль, Уксусная кислота
Токсикологическое значение: применяют в промышленности (растворитель), в пищевой промышленности (растворитель), для получения ЛП (пары амилнитрита – при отравлении). В качестве изомера – 2 метилбутанола – в сивушных маслах.
Большое его количество содержится в самогонке, в чаче.
Высшие спирты очень медленно окисляются, выводятся с мочой в виде коньюгатов с глюкуроновой кислотой.
При вскрытии – особенностей нет. Из полости рта – запах изоамилового спирта.
Изолирование: на анализ кровь, моча, содержимое желудка, печень, почки. Кровь, моча – паро-воздушным методом (ГХ алкилнитритным методом). Из внутренних органов – макро и микродистилляция. При больших количествах он будет на поверхности дистиллята, его отделяют, идентифицируют. При малых количествах – проводят пробоподготовку, потом идентифицируют.
Идентификация:
ГХ алкилнитритным методом. Стандарт – любой спирт, отличающийся временем удерживания.
Химические методы:
1) Получение амилацетата
2) Окисление, запах
3) реакция Комаровского.
Количественное определение:
алкилнитритный метод ГХ по высоте или площади пика. Метод абсолютной калибровки или внутреннего стандарта.
Этиленгликоль
Подвижная жидкость, хорошо смешивается с водой, используется в качестве антифриза. Смертельная доза 200-300 мл.
Отравления: потеря сознания, судороги, отеки легких, падение артериального давления.
На 2-3 сутки развивается почечная и печеночная недостаточность.
Первая помощь: гемодиализ, перитониальный диализ, форсированный диурез, этанол внутрь (внутривенно), CaCl2 (противосудорожное).
При попадании внутрь хорошо всасывается в ЖКТ и распространяется в б/ж. Не кумулируется в биотканях.
Объекты на исследование: кровь, моча. При летальном исходе: б/ж и стенка мочевого пузыря.
3 стадии отравления:
1) Начальная – 12 часов. Поражение ЦНС по типу алкогольного опьянения.
2) Нейротоксичная. Поражение ЦНС, ССС и органов дыхания.
3) Нефротоксичная. Поражение почек за счет закупорки почечных канальцев.
Метаболизм:
![]()
Изолирование:
1) Макродистилляция – извлекается не более 2%
2) Макродистилляция с селективным уносчиком бензолом – извлекается 6-7%.
3) Прямая экстракция бензолом – 5-10%
4) Основной метод – метод Гуляевой (до 70%). Стенку мочевого пузыря измельчают и добавляют ацетон, который глубоко проникает в биоткань и одновременно осаждает белки для очистки извлечения используют активированный уголь. Извлечение фильтруют, испаряют ацетон, а получившийся раствор анализируют методом ГЖХ (детектор – ДИП)
Для крови – аналогично.
Для мочи – концентрируют мочу на водяной бане, добавляют активированный уголь, отфильтровывают и анализируют методом ГЖХ.
Идентификация:
ТСХ на пластине «силуфол». Детекция KMnO4 или Br2. Метод носит отрицательное судебно-медицинское значение и может быть использован также в сочетании с другими методами.
Химические методы:
1. Окисление
![]()
Далее реакции на формальдегид.
2. Окисление к. HNO3
![]()
Выпадет осадок в виде характерных кристаллов.
Для вещественных доказательств: реакция с CuSO4
![]()
Количественное определение:
ГЖХ. Внутренний стандарт: 1,2-пропиленгликоль. Детектор – ДИП,
Уксусная кислота:
Исследование проводят при специальных заданиях судебно-следственных органов. При изолировании свободной уксусной кислоты не подкисляют, при определении общей – подкисляют H2SO4 или H3PO4, при этом дистиллят собирают в приемник, содержащий точный объем 0,1М NaOH.
Отгонку уксусной кислоты осуществляют до получения отрицательного результат по качественным реакциям. Дистиллят делят на 2 части: для количественного и качественного анализа.
Количественное определение: оттитровывают 0,1М HCl.
Качественное определение:
1) С FeCl3 красная окраска.
2) Получение индиго. К дистилляту добавляют CaO, нагревают, образуется ацетон, который конденсируется в о-нитробензальдегидом – синяя окраска.
3) Образование этилацетата.
Основной метод – метод Коахновского. Берут стенку желудка, измельчают, помещают в колбу, добавляют этанол и к. H2SO4, далее осуществляют дистилляцию.
Дистиллируют веществ в хроматограф, добавляя внутренний стандарт бутанол. По относительному времени идентифицируют этилацетат. По площади или высоте пика определяют количественно. Детектор – ДИП.
Токсикологическое значение: применяют в пищевой промышленности для получения различных эфиров.
Отравление: суицидное и по ошибке.
Отравление: рвота с кровью, ожоги слизи, пищевода.
Метаболизирует до CO2
Первая помощь – обильное промывание желудка.
Ацетон, Фенол, Хлорированные углеводороды, дихлорэтана
Токсикологическое значение: в промышленности, в химчистках.
Яд наркотического действия.
Метаболизируют до CO2. Может быть обнаружен у людей, страдающих СД. На исследование: головной мозг легкие, кровь, моча.
Макро и микро дистилляция, ГЖХ.
Идентификация:
1) Йодоформная реакция – желтый осадок, запах и кристаллы характерной формы(больше чем у этанола.
3J2
+ 6NaOH
3NaOH
+ 3NaJ + 3 H2O
CH3COCH3
+ 3NaOJ
CJ3COCH3
+ 3NaOH
CJ3COCH3
+
NaOH
CHJ3 + CH3COONa
CH3COCH3 + 3J2 + 4NaOH CHJ3↓ + CH3COONa + 3NaJ + 3H2O
2) С нитропруссидом Na (рН=0,7) – желто-оранж или оранж окрашивание, при подкислении уксусной кислотой красно-фиол.
![]()
3) Реакция с фурфуролом. К дистилляту добавляют 1% спиртовой раствор фурфурола и 10% раствор щелочи, через 5 минут добавляют к. HCl. Наблюдается интенсивное красное окрашивание.
Количественное определение:
1) Йодометрия
2) ГЖХ.
Фенол
Токсикологическое значение: в медицинской практике – дезинфицирующее средство. В химическое промышленности – для получения красителей, фарм препаратов, производстве используется для защиты р-й.
В организм попадает через кожу (ожоги). Смертельная доза – 10,0. Отравление: рвота, боли в желудке, ожоги, моча оливкового цвета.
Выводится с мочой в виде коньюгатов с глюкуроновой и серной кислотами (см. лекцию метаболизм).
На анализ: моча, печень, почки, головной мозг.
Изолирование: макродистилляция.
Моча: макродистилляция, но предварительно проводится гидролиз ( + HNO3, HCl) для разрушения коньюгатов.
Анализ проводится после пробоподготовки. Добавляют NaHCO3.
Идентификация:
а) C бромной водой.
б) с FeCl3
Количественное определение:
1) Гравиметрия
2) Броматометрия.
Хлорированные углеводороды.
Хлороформ, четыреххлористый углерод, хлоралгидрат, дихлорэтан
Токсикологическое значение: широко применяются в быту, в промышленности.
Действуют на ЦНС, наблюдается почечная и печеночная недостаточность, рвота, бледность кожи, расстройство желудка.
Первая помощь: срочная госпитализация, промывание желудка, гемодиализ, перитональный диализ (с фистулой), искусственные почки.
Хлор-органика не смешивается с водой, а кумулируется в жировой ткани. На исследование берут органы, богатые жиром. В крови и моче очень сложно обнаружить.
Изолирование: макро и микродистилляция. ГЖХ на колонках различной полярности (детектор ДИП или детектор электронного захвата) или хромато-масспектрометрия по изотопам галогенов.
Идентификация:
1. Реакция Фудживара (образование глутаконового альдегида – розовое окрашивание) – щелочь + пиридин.
2. Отщепление органически связанного хлора (“+”СХЗ) – белый осадок или белая муть, опалесценция.
CHCl3 + 4 NaOH 3 NaCl + HCOONa ; t
NaCl + AgNO3 AgCl↓ + NaNO3 ; рН=2, HNO3
AgCl + 2 NH4OH [Ag(NH3)2]Cl + 2H2O
Для четыреххлористого углерода эта реакция начинается:
CCl4 + 4NaOH (спирт.) 4NaCl + CO2 + 2 H2O
3. Изонитрильная проба – специфический неприятный запах.
CHCl3 + C6H5NH2 + 3NaOH C6H5NC↑ + 3NaCl + 3H2O
4. С резорцином (розовое или малиново-красное окрашивание) (“–“ СХЗ)
0,1 резорцина растворяют в 1мл 10%р-ра NaOH + 1мл дистиллята и нагревают 5-10минут на водяной бане.
5. С реактивом Феллинга
Для дихлорэтана CH2Cl-CH2Cl
1. + ацетанилинид Cu красное окрашивание.
C2H2 + Cu(NO3)2 + NH4OH CuCCH + NH4NO3 + H2O
C2H2 +2 Cu(NO3)2 + 2 NH4OH CuC-CCu + 2 NH4NO3 + 2H2O
2. реакция образования формальдегида.
CH2Cl-CH2Cl + Na2CO3 + H2O CH2OH-CH2OH +2NaCl + CO2
NaCl + AgNO3 AgCl + NaNO3
CH2OH-CH2OH + KJO4 HC(O)H + KJO3 + H2O
HC(O)H с фуксинсернистой кислотой дает сине-фиолетовое окрашивание.
Отличие х/форма от х/гидрата: дистиллят извлекают эфиром (экстрагируется х/форм и х/гидрат). Эфир фильтруют через сульфат натрия в сухую фарфоровую чашку и выпаривают вместе с эфиром и СНCl3. Сухой остаток растворяют в воде и проводят качественные реакции. Если р-ция “-“ хлороформ, если “+” х/гидрат.
Количественное определение: аргентометрия по Фольгарду. ГЖХ – с любым стандартом.
Высшие спирты. Формальдегид.
Перед качественным анализом проводят пробоподготовку:
К дистилляту + эфир, фильтруют ч/з безводный Na2SO4 в сухую выпарительную чашку. Испаряют эфир при комнатной температуре. С сухим остатком проводят реакции.
1) Получение амилацетата – запах грушевой эссенции:
C5H11OH + 2 CH3COONa + H2SO4 CH3COOCH2CH2CH(CH3)2 + Na2SO4 + H2O
2) Окисление KmnO4 и H2SO4 – приятный запах неприятный приятный:
С5H11OH + 2 KMnO4 + 3 H2SO4 5 C4H9C(O)H + 2MnSO4 + K2SO4 + 8 H2O приятный
C4H9C(O)H + 2 KMnO4 + 3 H2O 5 C4H9COOH + 2MnSO4 + K2SO4 + 3 H2O неприятный
C4H9COOH + C5H11OH C4H9C(O)OC5H11 + H2O приятный
3) Реакция Комаровского – розовое или красное окрашивание.
![]()
Формальдегид.
1) С резорцином в щелочной среде – розовое или малиновое окрашивание
Также как у хлороформа (“-“ СХЗ)
2) С аммиачным раствором AgNO3 – серый осадок или “серебрянное зеркало”
HCOH + [Ag(NH3)2]NO3 2Ag↓ + HCOONH4 + 2 NH4NO3 + NH3
3) С реактивом Феллинга – желтый осадок коричневый
Так же как у хлороформа.
4) С фуксинсернистой кислотой – сине-фиолетовое окрашивание.
![]()
Схема анализа дистиллята:
50 мл. дистиллята:
1) С резорцином
а) Хлорорганика
б) Формальдегид
Хлорорганика – отщепление органически связанного хлора.
Формальдегид – фуксинсернистая кислота.
2) Образование йодоформа.
а) ацетон – нитропруссидом Na.
б) Этанол – образование этилацетата (или окисление).
3) Высшие спирты (пробоподготовка) – реакция Комаровского.
4) Метанол – окисление до формальдегида, анализ формальдегида.
5) Синильная кислота. Первую порцию дистиллята мы собираем в раствор щелочи.
а) Образование берлинской лазури.
б) с пиридинбензидиновым реактивом.
6) Фенол (пробоподготовка)
а) С бромной водой.
б) с FeCl3.
ГЖХ по абсолютному или относительному расстоянию удерживания. Катарометр для летучих ядов, которые дают газовую фазу (нельзя запускать формальдегид, фенол, хлоралгидрат). Дип – можно запускать дистиллят, для всех летучих ядов.
ВЕЩЕСТВА, ИЗОЛИРУЕМЫЕ МЕТОДОМ МИНЕРАЛИЗАЦИИ
Яды, имеющие судебно-медицинское значение: Ba, Cr, Zn, Tl, Mn, Cu, Ag, Pb, Hg, Bi, Cd, As, Sb, Sn, Ni.
Металлические яды попадают в организм главным образом per os, через кожу, редко – ингаляционно. Всасывание – в тонком кишечнике в ионизированном виде, яд быстро распространяется по организму и тканям.
2 группы металлических ядов:
а) Соединения, кумулируемые в мягких тканях – Tl, Ag, Cd, Bi, Zn, Sb, As.
б) В костных тканях – Ba, Pb.
Попадая в организм, металлические яды связываются с аминокислотами, белками, пептидами и образуют альбуминаты прочные соединения. Чтобы доказать металлический яды, альбуминаты разрушают методом минерализации.
Минерализация – окисление органического вещества, приводящее к высвобождению неорганического соединения из комплекса металла с белковой молекулой.
Объекты исследования: содержимое желудка, кишечник, печень, почки, волосы, ногти, кости.
Методы минерализации:
I Частные:
1) Сухое озоление
а. Сплавление
б. Сжигание
II Общие:
2) Мокрое озоление
а. KClO3 + HCl
б. H2SO4 + H2O2
в. NH4NO3 + H2SO4
г. H2SO4 + HNO3
д. H2SO4 + HNO3 + HClO4
III Деструктивный метод на ртуть.
Сухое озоление:
1. Сжигание. Если на исследование доступно необходимое количество биоматериала и при целенаправленном исследовании на Zn, Cu, Mn. Сжигают в кварцевых тиглях при 400°С. Не применяют в случае присутствия As, Hg (можно потерять).
2. Сплавление: Используют NaNO3, Na2CO3. При малом количестве биоматериала. При целенаправленном исследовании на As, Ag.
Деструктивный метод на ртуть:
Целенаправленный. Относится к общим методам. Используют к.H2SO4 + к.HNO3. В данном методе отсутствует вторая фаза глубокого жидкофазного окисления (т.к. ртуть можно потерять).
Мокро озоление: (общие методы)
1. Метод Фрезениуса-Бобо.
Недостатки: большой расход HCl, неполное окисление биоматериала.
Второй и третий методы имеют те же недостатки.
Недостатки: 2HClO4 Cl2O7 взрывоопасен, выброс реакционного материала.
Стадии минерализации:
1. Стадия деструкции. Биоматериал измельчают, помещают в колбу Кьельдаля, добавляют к.HNO3, к.H2SO4 и воду (1:1:1). Вода необходима, чтобы не проходили процессы нитрования и сульфирования ароматической части белковых молекул. Выдерживают 15-40 минут на кипящей водяной бане. Происходит деструкция (разрушение) элементов биоткани. Конец стадии: прозрачная жидкость, окрашенная в коричневый или желтый цвет, ткани нет.
Если биоматериал подвергался консервации (этанолом), то к биоматериалу добавляют Na2CO3 и осторожно испаряют этанол при 50°C. И только после этого проводят стадию деструкции.
2. Стадия глубокого жидкофазного окисления. Колбу Кьельдаля переносят на асбестовую сетку и прокаливают в течение от 4 часов до нескольких суток при температуре 350°С. При этом по каплям добавляют к.HNO3 и воду (1:1).
Конец второй стадии: однородная прозрачная жидкость или прозрачная жидкость с осадком Ba, Pb, Ca. Ca не имеет токсикологического значения.
Жидкость при температуре и без добавления HNO3 не должна темнеть в течение 30 минут и над жидкостью должны появиться пары серного ангидрида.
3. Стадия денитрации. Удаление окислов азота и азотсодержащих соединений. Источником окислов азота является нитрозил-серная кислота.
![]()
Для ее определения: каплю минерализата наносят на предметное стекло и добавляют дифениламин в H2SO4. Если появляется синее окрашивание, проводят денитрацию.
Для начала добавляют воду для разрушения нитрозил-серной кислоты:
![]()
Минерализат кипятят для удаления окислов азота и добавляют денитраторы: формальдегид или мочевина или сульфит натрия.
3HCHO + 4HNO2 3CO2 + 5H2O + 2N2
O=C(NH2)2 + 2HNO2 CO2 + 2N2 + 3H2O
3Na2SO3 + 2HNO2 3Na2SO4 + N2 + H2O
Проверяют полноту денитрации добавляя дифениламин (не должно быть синего окрашивания).
Обнаружение катионов в минерализате.
Катионы могут быть обнаружены как систематическим, так и дробным методом.
Систематический: последовательное выделение групп ионов, затем разделение на подгруппы, затем обнаружение их в подгруппах (сероводородный метод).
Недостатки: большая навеска биоматериала, длительность анализа, большое количество дополнительных операций (возможна потеря катионов), невозможен одновременный качественный и количественный анализ, H2S – токсичен.
Дробный метод по Крыловой.
Метод основан на применении реакций с помощью которых в любой последовательности можно обнаружить катионы в отдельных, небольших порциях минерализата.
Достоинства: Катионы могут быть обнаружены в небольших количествах, высокая чувствительность, не определяем катионы, которые содержатся в организме в естественном виде.
Способы устранения мешающих катионов:
1. При определенном рН среды выделение катионов в виде дитизонатов.
Ag, Hg – pH=1-2 ; Zn – pH=4-5 ; Pb – pH=7-10 ; Tl – pH=12
2. Добавление комплексонов. Комплексоны образуют бесцветные соединения. Трилон Б, фосфаты, лимонная кислота, гидроксиламин.
3. Изменение валентности катионов:
Sb3+ Sb+5 (NaNO2)
Tl3+ Tl1+ (гидроксиламин)
As3+ As5+ (SnCl2)
Cr3+ Cr6+ (персульфат аммония)
4. Устранение мешающих катионов в виде осадков (так удаляют Ag).
5. Экстракция и реэкстракция различными органическими растворителями.
В дробном методе проводят основную реакцию. Если эффект отрицателен – делаем заключение об отсутствии катиона. Если эффект положителен, то доказываем другими реакциями и методами.
Количественное определение:
1. ФЭК с СФМ в видимой области по цветным реакциям.
2. Объемные методы титрования. Гравиметрия, йодометрия, комплексонометрия.
3. Атомно-абсорбционная СФМ (элементарный анализ).
Рентгено-флюоресцентный анализ – измерение потока квантов рентг-флюоресценции, Е которых характеризует определенный элемент.
Эмисионно-спектральный анализ.
ТСХ – СКРИНИНГ. Анализ вещественных доказательств.
Скрининг – отбор или выбор из большой группы веществ какого-то одного или 2-х соединений.
Скрининги бывают: СФМ, Газохроматографический, ВЭЖХ.
1) Скрининг кислого хлороформного извлечения.
На стартовую линию (сорбент – силикагель) наносятся кислые х/ф извлечения. Ставят в камеру для х/графирования (хлороформ:ацетон - 9:1). Затем пластинку вынимают, высушивают и приступают к проявлению. Реактив – проявитель: дифенилкарбазон и HgSO4 (там где барбитураты – появляются фиолетовые пятна). Пластинку греют и проявляют FeCl3 (пиразолоны). Опрыскивают раствором Драгендорфа (алкалоиды). Измеряют Rf каждого вещества. Составляют таблицу. Т.к. у пятен различный путь, пластинку делят на зоны. Все вещества делят на 3 группы в зависимости от величины Rf:
1гр.: 0 – 0,26 (кофеин, антипирин)
2гр.: 0,27 – 0,35 (амидопирин, нитразепам)
3гр.: 0,38 – 0,5 (себозон, барбитураты)
Далее проводят анализ кислого хлороформного извлечения.
На стартовую линию наносят 4 точки: 1-я – задача, 2 – метчик из 1 зоны с max Rf, 3 – метчик из 2, 4 – из 3 зоны. Хроматографируют в той же системе растворителей хлороформ: ацетон – 9:1. Высушивают и проявляют также как и до этого. Подозреваем наличие того или иного вещества. Извлечение х/графируем в частной системе на подозреваемое вещество. Необходимо подтверждение физ-хим методами.
ТСХ – скрининг щелочного извлечения.
Проводится также
Общая система растворителей: Хлороформ : Ацетон : Аммиак – 12:24:1.
Проявители:
10% р-р FeCl3 (Пр.фенотиазина, пр.пиразолона)
Р-в Драгендорфа
1 зона: аминазин, тиоридазин, атропин.
2 зона: хинин, новокаин, дипразин.
3 зона: пр.пиразолона, левомепромазин
Анализ вещественных доказательств.
Таблетки. Описание: внеш вид, размер, цвет, оболочка, насечка, форма. Изол-е: изм-т, + воду, переносят в делит-ю воронку, подкисл-т до pH = 2, экстр-т х/ф, отд-т, фильтр-т ч/з б/водн Na2SO4 в сухую склянку. Оставшийся водн р-р подщелачивают до 10, экстр-т х/ф. Анализ х/ф извл-я: 1. хим р-ии 2. СФМ – часть извл-я выпаривают досуха, р-т в 5 мл спирта, к-ты или щелочи, снимают спектр в УФ области.
Р-ры д/инъекций или ампулы. Описание: внеш вид – V, герм-ть, надпись. Ампулу вскр-т и опр-т pH р-ра и пок-ль прел-я η на рефрактометре. Получ рез-ты ср-т с табличными и опр-т круг объектов. Изол-е по таблице. Анализ х/ф извл-я – по таблице.
Порошки. Предварит-е исп-я: описание- вн вид, цвет, запах, размер и форма кр-в; отн-е к нагр-ю и прокаливанию – не горят и не обугл-ся – н/орг в-ва, горят, обугл-ся – орг в-ва; опр-е р-ти, рН среды р-ра или водной вытяжки. Хим анализ – неорг в-ва (анионы и катионы), орг в-ва (элементный анализ). Изол-е.
Жидкости. Опсание – внеш вид, цвет, запах. Опред-е рН: < 7 – опр-т анион SO4 – с HCl и BaCl2, Cl - с HNo3 и AgNO3, NO3 и NO2 – с дифениламином – синее окр-е, CH3COO – в нейтр-й среде с FeCl3 – кр-коричн окр-е. Если обнаружили SO4, то ищем катионы по схеме дробного анализа. >7 – опред-т щелочи. = 7 – м.б. летучие яды.
Пишут отчет: условия получения вещ док-в, и далее по анализу. После р-ии и вывод.
Анализ ЛРС.
Схема иссл-я:
1. внешний вид сырья (макро- и микро-),
2. изолирование: ЛРС изм-т, зал-т водой, подк-т H2SO4 до рН=2-2,5. Наст-т 30 минут при период перемеш-и, фильтр-т в делит воронку, подщел-т NH4OH до рН=10 и экстр-т х/ф. Пуриновые Alk экстр-т при рН=5. х/ф извл-е фильтр-т ч/з б/водн Na2SO4 в сухую склянку и иссл-т. Р-ии проводят с сухим остатком.
3. Анализ:
Хинин – талейохинная, с NH4CNS, ТСХ (пластинка Армсорб, х/ф:ацетон:аммиак, детекция р-в Драгендорфа, УФ)
Пурины – мурексидная, кофеин – микрокрист, теобромин – Драгендорфа, теофиллин – азокраситель, ТСХ (х/ф:ацетон)
Морфин – FeCl3 (сине-зел), ТСХ (как хинин)
Папаверин – р-в Марки, CdCl2 (кр-лы), ТСХ
Атропин – р-я Витали-Морена (быстро исчез фиол окр), с пикриновой к-той и солью Рейнеке (кр-лы), ТСХ
Эфедрин – с нингидрином в ацетоне с ↑t (фиол), Драгендорф (кр-лы), соль Рейнеке, ТСХ
Пахикарпин – р-я Кочча, р-я с HCl и пикриновой к-той (кр-лы), с HCl и р-вом Бушарда (кр-лы), ТСХ
Никотин – с формальдегидом и H2SO4 при ↑t (розов), с винилином и серной к-той (кр), с Драгендорфом (кр-лы), с солью Рейнеке (кр-лы), ТСХ.
4. Отчет с заключением.
СХЕМА ДРОБНОГО АНАЛИЗА ПО А.Н. КРЫЛОВОЙ.
БАРИЙ, СВИНЕЦ, ТЕТРАЭТИЛСВИНЕЦ
Первый вариант: после минерализации мы имеем бесцветный или окрашенный раствор. Окраску дают Mn, Cr, Cu.
Второй вариант: прозрачный раствор с осадком. В осадок выпадают Ba, Pb (Ca, но он не имеет токсикологического значения) – BaSO4, PbSO4. На поверхности осадка десорбируются Cr, Mn. При наличии осадка к минерализату добавляют воду (чтобы фильтр не сгорел) и фильтруют. Фильтр промывают горячим раствором (NH4)CH3COO, Pb(CH3COO)2 переходит в раствор.
Ba.
Применяют как рентгеноконтрастное вещество, для изготовления керамики, для борьбы с грызунами.
заб. гол.м.
Паралич сердца.
Незначительная часть кумулируется в печени, почках, наибольшая – в почках. Выводится с мочой, через ЖКТ.
Первая помощь: промывание желудка, прием Na2SO4.
Идентификация: Минерализация смесью 2-х кислот.
1. Микрокристаллическая реакция. На предметное стекло помещают осадок, добавляют к.H2SO4 и нагревают в пламени горелки до выделения паров сернистого ангидрида. Охлаждают, получаются характерные кристаллы в виде «летящих птиц»
2. Микрокристаллическая реакция с KIO3. На платиновую петлю помещают осадок BaSO4 и вносят в пламя горелки. Содержимое петли помещают в каплю HCl, помещают на предметное стекло и добавляют кристалл KIO3 образуются призматические кристаллы.
BaSO4
![]() BaS + 2O2
BaS + 2O2
BaS + 2HCl BaCl2 + H2S
BaCl2 + KIO3 Ba(IO3)2 + 2KCl
Количественное определение:
Гравиметрия, обратная трилонометрия (растворяют в горячем насыщенном трилоне).
Pb
Используют в производстве аккумуляторов, при изготовлении свинцовых белил, для получения этилированного бензина.
Много свинца содержится в выхлопных газах и растительном сырье, произрастающем вдоль дорог.
Изменяется картина крови. Частично кумулируется в костях, печени, почках, выводится через ЖКТ.
Первая помощь: трилон Б.
Изолирование: смесью 2-х кислот.
Идентификация:
1. Реакция с дитизоном (основная):
![]()
(тион-тиольная таутомерия)
![]()
Хлороформный слой окрашивается в пурпурно-красный цвет. Его отделяют и добавляют раствор HNO3 (реэкстракция).
![]()
Хлороформный слой отбрасывают и с реэкстрактом проводят реакции:
2. С насыщенным раствором Na2S черный осадок.
Pb(NO3)2 + Na2S PbS↓ + 2NaNO3
3. Образование сульфата (белый осадок).
Pb(NO3)2 +H2SO4 PbSO4↓ + 2HNO3
4. С раствором KI. Желтый осадок (золотой дождь).
Pb(NO3)2 + KI PbI2↓ + 2KNO3
5. С K2Cr2O7. Желто-оранжевый осадок.
Pb(NO3)2 + K2Cr2O7 + H2O 2PbCrO4↓+ 2KNO2 + 2H2O
При малых количествах Pb используют микрокристаллические реакции:
1. С хлоридом цезия. Желто-зеленые кристаллы.
CsCl + 3KI + Pb(NO3_2 CsPbI3↓ + KCl + 2KNO3
2. С солями меди. Черные кристаллы в виде куба.
Pb(NO3)2 + Cu(CH3SOO)2 + 6KNO2 K2CuPb(NO2)6↓ + 2CH3COOK + 2KNO3
Количественное определение:
ФЭК, СФМ в видимой области (по первой реакции), комплексонометрия, бихроматометрия, йодометрия.
Тетраэтилсвинец. Pb(C2H5)4
Антидетонатор в двигателях внутреннего сгорания; воздействует на все отд. Hb, изм. каратина крови; галлюцинации, бессонница, головокружение.
Изолирование:
1. Метод дистилляции. Биоматериал измельчают и проводят перегонку с водяным паром. Дистиллят собирают в приемник, содержащий насыщенный раствор I2. Упаривают, добавляют H2SO4 и проводят качественные реакции на Pb.
2. Смесью 2-х кислот.
3. Из растительного сырья. Сырье измельчают, добавляют хлороформ, проводят экстракцию, хлороформ упаривают и проводят минерализацию смесью 2-х кислот.
Исследование основного минерализата:
1. Исследование следует начинать с Mn и Cr, затем Ag.
2. Соединения Ag мешают определению катионов, поэтому его выводят из минерализата, добавляя раствор NaCl.
3. Особое внимание и следует уделить следующим сочетаниям: Sb + Tl, Cu + Sb, As + Sb.
Фосфид цинка.
Средство дератизации, используется в настойках, таблетках.
Под действием HCl желудка:
Zn3P2 + HCl 3ZnCl2 + PH3
PH3 токсичен. объекты исследования: желудок, кишечник.
Доказательство Zn3P2 – обнаружение PH3 и Zn.
объекты исследования помещают в колбу, добавляют воды, р.H2SO4 (чтобы избежать потери PH3). Перегоняют. Приемники – 4-5 колб, которые содержать бромную воду. Не должно быть полного обесцвечивания бромной воды. Отсутствие над жидкостью газообразных продуктов в течение 3-5 минут указывает на полноту отгонки PH3. Дистиллят из всех приемников сливают вместе, выпаривают на водяной бане. Сухой остаток растворяют в воде, определяют H3PO4 и Zn.
МАРГАНЕЦ, ХРОМ, СЕРЕБРО.
Mn
Стекольная промышленность, металлургия, медицинская практика.
Отравление с целью суицида.
Ожоги слизистой. Mn воздействует на ЦНС, кумулируется в печени, почках, выводится с мочой или через ЖКТ.
Изолирование:
1. При целенаправленном исследовании – сухое озоление (сжигание)
2. Смесью 2-х кислот.
Идентификация:
Основана на реакциях окисления.
1.
2MnSO4 + 5KIO4 + 3H2O
![]() 2HMnO4 + 5KIO3 + 2H2SO4
2HMnO4 + 5KIO3 + 2H2SO4
Розовое окрашивание.
Дигидрофосфат Na необходим для связывания Fe, Sb, которые мешают окраске.
Реакция носит отрицательное судебно-химическое значение, т.к. открывает эндо и экзогенный Mn.
2.
2MnSO4 + 8H2O + 5(NH4)S2O8
![]() 2HMnO4 + 5(NH4)SO4 + 7H2SO4
2HMnO4 + 5(NH4)SO4 + 7H2SO4
Розовое окрашивание. AgNO3 – катализатор. Реакция носит положительное суд-мед значение.
Количественное определение:
ФЭК или СФМ по первой реакции, йодометрия.
Cr
Токсикологическое значение: применяется в кожевенной промышленности, в гальванических цехаха, в сельском хозяйстве для протравливания семян.
Очень опасны соли Cr+6, они вызывают онкологические заболевания, ожоги слизистой. На анализ берут желудок, пищевод (окрашены в желтый цвет).
Кумулируется в печени, почках, выводится с мочой, через ЖКТ.
Антидот: унитиол и различные мази при экземах и ожогах.
Изолирование: смесью 2-х кислот.
Идентификация: чтобы проводит основную реакцию на Cr, необходимо перевести его из Cr3+ в Cr6+.
Cr(SO4)3
+ 3(NH4)2S2O8 + 7H2O
![]() H2Cr2O7 + 3(NH4)2SO4 + 6H2SO4
H2Cr2O7 + 3(NH4)2SO4 + 6H2SO4
1. Образование надхромовых кислот. Эфирный слой окрашивается в синий цвет.
H2Cr2O7 + 4H2O2 2H2CrO6 + 3H2O
2. С дифенилкарбазидом.
а)
![]()
б)
![]()
в)
![]()
Розовое окрашивание. При добавлении этилацетата окраска усиливается (до красно-фиолетовой).
Количественное определение:
ФЭК или СФМ по реакции с дифенилкарбазидом.
Ag
Токсикологическое значение: в производстве зеркал, в фотографии, в медицине, реактив в лабораториях.
При попадании на кожу, внутрь – прижигающее действие. Длительное применение – аргирия (кожа серо-зеленого цвета).
Выводится с мочой, через ЖКТ.
Первая помощь: трилон Б, NaCl.
Изолирование:
1. Целенаправленное обнаружение – сухое озоление.
2. Смесью двух кислот.
Идентификация:
1. С дитизоном. Хлороформный слой окрашивается в золотисто-желтый цвет.
![]()
Аналогичным образом реагирует ртуть. Для того, чтобы их отличить, хлороформный слой отделяют, добавляют раствор HCl. Если эффект сохраняется, то имеем дело с ртутью, если хлороформный слой становится зеленым, а в водном слое появляется белый осадок, то у нас серебро.
2. Т.к. Ag мешает определению других катионов, его выводят: добавляют NaCl насыщенный, нагревают, фильтруют. Теперь с минерализатом можно проводить дальнейшие исследования, а осадок растворяют в NH4OH, часть раствора помещают на предметное стекло, упаривают и добавляют KI. Появляются желтые кристаллы.
3. Микрокристаллическая реакция. К раствору прибавляют тиомочевину, пикрат калия – выпадают желтые призматические кристаллы.
Количественное определение:
Роданидом аммония
СФМ или ФЭК по реакции с дитизоном.
Серебро не мешает определению Mn, Cr, но мешает определению последующих катионов, поэтому его выводят из минерализата, добавляя насыщенный NaCl. Но открытию Mn, Cr будут мешать хлорид-ионы:
2HMnO4 + 14HCl 2MnCl2 + 5Cl2 + 8H2O
В реакциях окисления Cr, Mn в качестве катализатора используют AgNO3, серебро выпадет в осадок AgCl. Поэтому в первую очередь открывают Cr, Mn.
