
- •1.Световая волна. Интерференция света. Когерентность световых волн. Расчет интерференционной картины от двух источников.
- •2.Методы наблюдения интерференции (опыт Юнга, интерференция в тонких пленках). Интерферометры.
- •3.Дифракция света. Принцип Гюйгенса-Френеля. Зоны Френеля. Дифракция на круглом отверстии. Векторные диаграммы.
- •4.Дифракция от одной щели. Условия максимума и минимума.
- •5.Дифракционная решетка. Дифракция на пространственной решетке, формула Брэггов-Вульфа.
- •6.Поляризация света. Поперечность световых волн. Виды поляризации. Закон Малюса.
- •7.Поляризация света при отражении. Закон Брюстера. Двойное лучепреломление. Поляриметрия.
- •8.Дисперсия света. Теория дисперсии света Лоренца.
- •9.Поглощение света. Закон Бугера.
- •10.Тепловое излучение. Законы теплового излучения. Абсолютно черное тело. Квантовая гипотеза и формула Планка.
- •11. Внешний фотоэффект. Уравнение Эйнштейна. Фотоны, их энергия и импульс.
- •12. Давление света. Эффект Комптона.
- •13. Корпускулярно-волновой дуализм. Гипотеза де Бройля. Дифракция электронов. Соотношение неопределенностей.
- •14. Волновая функция, ее свойства и статистический смысл. Уравнение Шредингера (временное, стационарное).
- •15. Стационарное уравнение Шредингера, его применение. Частица в одномерной потенциальной яме.
- •16.Линейный гармонический осциллятор. Туннельный эффект.
- •17. Строение атома. Опыты Резерфорда по рассеянию α-частиц. Ядерная модель, ее трудности. Закономерности в атомных спектрах. Теория атома водорода по Бору. Спектр водорода.
- •18. Атом водорода в квантовой механике. Квантовые числа. Многоэлектронные атомы. Спектры атомов.
- •19.Спонтанное и вынужденное излучение. Лазеры.
- •20. Термодинамический и статистический методы. Молекулярно-кинетическая теория идеального газа. Тепловое движение. Уравнение состояния идеального газа.
- •22. Понятие о классической статистике. Математическая вероятность, законы сложения и умножения вероятностей. Функция распределения. Среднее значение.
- •23. Закон распределения по скоростям и по компонентам скоростей Максвелла. Скорости теплового движения (средняя арифметическая, средняя квадратичная, наиболее вероятная).
- •24. Газ в поле тяготения. Барометрическая формула. Распределение Больцмана.
- •25. Столкновения молекул. Средняя длина свободного пробега. Эффективный диаметр молекул.
- •26. Диффузия, внутреннее трение, теплопроводность. Коэффициенты диффузии, вязкости и теплопроводности.
- •27. Термодинамика. Первое начало термодинамики. Теплоемкости газа. Работа и теплоемкость при изопроцессах. Зависимость теплоемкости от температуры.
- •28. Адиабатический процесс. Работа при адиабатическом процессе. Уравнение Пуассона.
- •29. Круговой процесс (цикл). Кпд цикла. Обратимые и необратимые процессы. Второе начало термодинамики по Кельвину и Клаузиусу
- •30. Энтропия, ее свойства. Неравенство Клаузиуса.
- •31. Изменение энтропии в изопроцессах с идеальным газом. Т-s-диаграмма.
- •32. Цикл Карно, теорема Карно. Максимальный кпд тепловой машины.
- •33. Термодинамическая вероятность состояния системы. Статистический смысл второго начала термодинамики. Понятие о термодинамике открытых неравновесных систем. Третье начало термодинамики.
- •34. Реальный газ. Межмолекулярные взаимодействия. Уравнение Ван-дер-Ваальса. Критические параметры. Фазы и фазовые переходы.
- •35. Кристаллическое состояние, его характеристика. Типы кристаллических решеток. Механические свойства твердых тел. Закон Гука.
- •36. Тепловое расширение твёрдых тел. Теплоемкость твердых тел. Закон Дюлонга и Пти.
- •37. Квантовые статистики. Функция распределения Ферми-Дирака и Бозе-Эйнштейна. Вырожденный и невырожденный квантовый газ.
- •38. Фотонный и фононный газ. Теплоемкость кристаллической решетки.
- •39. Выводы квантовой теории электропроводимости металлов. Зависимость сопротивления проводников от температуры. Сверхпроводимость.
- •40. Элементы зонной теории твердого тела. Энергетические зоны в кристаллах. Заполнение зон. Металлы, диэлектрики и полупроводники с точки зрения зонной теории.
- •41. Собственные полупроводники. Зависимость сопротивления полупроводников от температуры.
- •42. Примесные полупроводники. P-n – переход.
- •43. Фотопроводимость. Транзистор.
- •44. Работа выхода электрона из металла. Термоэлектронная эмиссия, её применение. Контактная разность потенциалов (внешняя, внутренняя).
- •45. Термоэлектрический эффект. Эффект Пельтье.
- •46. Современная физическая картина мира.
22. Понятие о классической статистике. Математическая вероятность, законы сложения и умножения вероятностей. Функция распределения. Среднее значение.
Рассматривается макросистема, состоящая
из очень большого числа микрочастиц.
Пусть какая-либо хар-ка частицы может
принимать только дискретные значения.
x,p,E
N-измерений(оч. бол.)

Перед каждым измерением систему приводим в одно и тоже состояние.
Статистический ансабль – стат-ансамбль – это набор одинаковых макросистем, находящихся в одинаковом состоянии.
Отношение
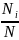 -это частота появления результата
-это частота появления результата
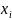 .
.
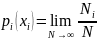

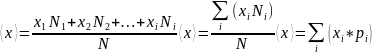
1)закон умножения вероятностей
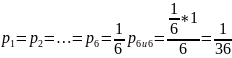
2)закон сложения вероятностей; или

Пусть величина может принимать непрерывный
ряд значений

Вероятность того что x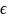 интервалу
величине
интервала
интервалу
величине
интервала
F(x) – ф-ция
распределения вероятностей величины
x.
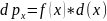
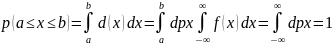
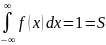 -
под всем графиком ф-ции.
-
под всем графиком ф-ции.
Среднее значение.
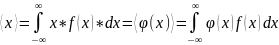 –
рекомендация как находить ср.знач.
–
рекомендация как находить ср.знач.
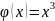
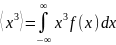
23. Закон распределения по скоростям и по компонентам скоростей Максвелла. Скорости теплового движения (средняя арифметическая, средняя квадратичная, наиболее вероятная).
Рассматривается газ в состоянии равновесия все направления скоростей молекул равновероятны, а сами скорости различны и меняются медленно; быстрых- очень мало, а>с – не бывает.
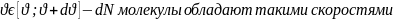
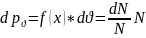 -
полное число молекул.
-
полное число молекул.
 – численно равна =
– численно равна =

Доля молекул со скоростями лежат в
интервале от
 до
до
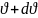 в расчете на единичный интервал скоростей.
в расчете на единичный интервал скоростей.
Введем ф-цию распределения по
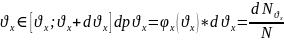
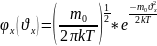
Скорости теплового движения.
Ср. ариф.: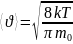
Ср. квад.:
Вероятная: 1-для
молекул,2- для газа
1-для
молекул,2- для газа
24. Газ в поле тяготения. Барометрическая формула. Распределение Больцмана.
1)поле однородно

2)газ идеальный
3)
Равновестное распределение молекул устанавливается в результате одновременного действия двух конкурирующих факторов:
1.Газ стремится занять весь предоставленый ему объем.
2.Молекулы притягиваются к земле.
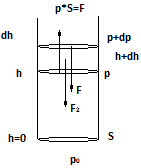
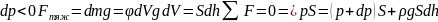


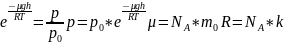
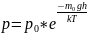

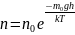
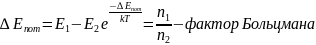 показывает во сколько раз отличаются
концентрации частиц в 2 точках, если их
потенциальные энергии в этих точках
отличаются
показывает во сколько раз отличаются
концентрации частиц в 2 точках, если их
потенциальные энергии в этих точках
отличаются
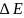 (распределение
частиц по координатам).
(распределение
частиц по координатам).

25. Столкновения молекул. Средняя длина свободного пробега. Эффективный диаметр молекул.
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул <l>.
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
Так как за 1 с молекула проходит в среднем
путь, равный средней арифметической
скорости <v>,
и если (z)
—среднее число столкновений,
испытываемых одной молекулой газа за
1 с, то средняя длина свободного пробега
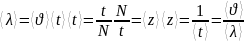
Эффективный диаметр молекулы- это min расстояние до которого могут свдвинутся две молекулы.
Эффективное сечение – это сечение шара, который описан вокруг молекулы.
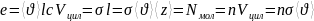

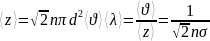
Вакуум- это такое состояние газа, когда длина свободного пробега соизмеряется длиной сосуда.
