
- •Диаграммы однокомпонентных систем
- •Отклонения от закона Рауля
- •Применение - обнаружение присутствия ионов в растворах электролитов
- •5. Молекулярная адсорбция из растворов
- •Теория мономолекулярной адсорбции Ленгмюра
- •6. Адсорбция из растворов электролитов
- •11. Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил.
11. Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил.
Скорость седиментации зависит от массы, размера, формы и плотности вещества частицы, 0%92%D1%8F%D0%B7%D0%BA%D0%BE%D1%81%D1%82%D1%8C"вязкости и плотностисреды, а также от ускорения силы тяжести и действующих на частиц центробежных сил.
В поле гравитационных сил седиментируют частицы грубодисперсных систем; в поле центробежных сил возможна седиментация коллоидных частиц и макромолекул (см. 0%A6%D0%B5%D0%BD%D1%82%D1%80%D0%B8%D1%84%D1%83%D0%B3%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5"центрифугирование).
Седиментацию используют в промышленности при обогащении 0%9F%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D1%8B%D0%B5_%D0%B8%D1%81%D0%BA%D0%BE%D0%BF%D0%B0%D0%B5%D0%BC%D1%8B%D0%B5"полезных ископаемых, различных продуктов0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%82%D0%B5%D1%85%D0%BD%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F"химической и нефтехимической технологии, при водоочистке и др.
Седиментацио́нный ана́лиз — совокупность методов определения размеров частиц в 0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"дисперсных системах и молекулярной массы макромолекул в растворах полимеров по скорости 0%A1%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D1%8F"седиментации в условиях седиментационно-диффузного равновесия.
При осаждении частиц возникает градиент их концентрации, направленный по направлению силы тяжести, такой градиент приводит к 0%94%D0%B8%D1%84%D1%84%D1%83%D0%B7%D0%B8%D1%8F"диффузии частиц в направлении их меньшей концентрации, то есть в направлении, обратном направлению седиментации; при этом возможно состояние, когда седиментационный и диффузионный потоки взаимно уравновешиваются — наступает седиментационно-диффузное равновесие, описываемое 0%91%D0%B0%D1%80%D0%BE%D0%BC%D0%B5%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%84%D0%BE%D1%80%D0%BC%D1%83%D0%BB%D0%B0"барометрической формулой:
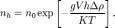
МЕТОДЫ : Обычно седиментация в гравитационном поле применяется для грубодисперсных систем (0%A1%D1%83%D1%81%D0%BF%D0%B5%D0%BD%D0%B7%D0%B8%D1%8F"суспензий, 0%AD%D0%BC%D1%83%D0%BB%D1%8C%D1%81%D0%B8%D1%8F"эмульсий), размер частиц которых превышает 1 мкм. Один из традиционных приборов для этой цели — 0%A2%D0%BE%D1%80%D1%81%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B5_%D0%B2%D0%B5%D1%81%D1%8B&action=edit&redlink=1"торсионные весы.
Седиментация
в центробежном поле используется для
изучения коллоидных систем и растворов
полимеров; центробежные ускорения
достигают сотен тысяч  и
реализуются
в 0%A3%D0%BB%D1%8C%D1%82%D1%80%D0%B0%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B8%D1%84%D1%83%D0%B3%D0%B0&action=edit&redlink=1"ультрацентрифугах с
частотой вращения ротора до нескольких
десятков тысяч об/мин.
и
реализуются
в 0%A3%D0%BB%D1%8C%D1%82%D1%80%D0%B0%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B8%D1%84%D1%83%D0%B3%D0%B0&action=edit&redlink=1"ультрацентрифугах с
частотой вращения ротора до нескольких
десятков тысяч об/мин.
12. Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться явление самопроизвольного перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – осмос. Осмотические свойства раствора количественно характеризуются величиной осмотического давления. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть осмотическое давление π. Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению (III.16):
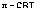
Уравнение (III.16) есть т.н. принцип Вант-Гоффа:
осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
Рассмотрим роль осмоса в водном режиме растительной клетки. Осмотическое давление жидкости, контактирующей с клеткой, может быть больше, меньше либо равно осмотическому давлению внутриклеточной жидкости. Соответственно выделяют гипертонические, гипотонические и изотонические растворы.
13. Электрофорез (от электро- и 0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA"греч. φορέω — переносить) — это 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%8F%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F&action=edit&redlink=1"электрокинетическое HYPERLINK "http://ru.wikipedia.org/w/index.php?title=%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%8F%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F&action=edit&redlink=1"явлениеперемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D0%BF%D0%BE%D0%BB%D0%B5"электрического поля. С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновение в углубления и поры.
ЭлектроHYPERLINK "http://ru.wikipedia.org/wiki/%D0%9E%D1%81%D0%BC%D0%BE%D1%81"осмос — это движение жидкости через капилляры или пористые диафрагмы при наложении внешнего электрического поля. Электроосмос — одно из основных электрокинетических явлений. Электроосмос используют для удаления избыточной влаги из 0%9F%D0%BE%D1%87%D0%B2%D0%B0"почв при прокладке транспортных магистралей и гидротехническом строительстве, для сушки 0%A2%D0%BE%D1%80%D1%84"торфа, а также для очистки воды, технических жидкостей и др.
14. Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами (молекулярно- или ионно-дисперсными системами) и грубодисперсными системами. Поэтому коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методыконденсации и диспергирования (в отдельную группу выделяется метод пептизации, который будет рассмотрен позднее). Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
Методы конденсации
Вещество, находящееся в молекулярно-дисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – т.н. методом замены растворителя. В качестве примера можно привести получение золя канифоли, которая не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется коллоидный раствор канифоли в воде. Аналогичным образом может быть получен гидрозоль серы.
15. Некоторые молекулярно-кинетические свойства коллоидных систем используют для очистки золей от электролитов и молекулярных примесей, которыми полученные золи часто бывают загрязнены. Наиболее распространенными методами очистки коллоидных систем являются диализ, электродиализ и ультрафильтрация, основанные на свойстве некоторых материалов – т.н. полупроницаемых мембран (коллодия, пергамента, целлофана и т.п.) – пропускать ионы и молекулы небольших размеров и задерживать коллоидные частицы. Все полупроницаемые мембраны представляют собой пористые тела, и непроницаемость их для коллоидных частиц обусловлена тем, что коэффициент диффузии для коллоидных частиц значительно (на несколько порядков) меньше, чем для ионов и молекул, имеющих намного меньшие массу и размеры.
Прибор для очистки золей методом диализа называется диализатором; простейший диализатор представляет собой сосуд, нижнее отверстие которого затянуто полупроницаемой мембраной (рис. 4.17). Золь наливают в сосуд и помещают последний в ёмкость с дистиллированной водой (обычно проточной); ионы и молекулы примесей диффундируют через мембрану в растворитель.
Электродиализ — процесс изменения концентрации 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82"электролита в растворе под действием электрического тока. Электродиализ применяют для 0%9E%D0%BF%D1%80%D0%B5%D1%81%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5_%D0%B2%D0%BE%D0%B4%D1%8B"опреснения воды, выделении солей из растворов.
Ультрафильтрация — это мембранный процесс, по своей природе занимающий промежуточное положение между обратным осмосом и микрофильтрацией. Размеры пор ультрафильтрационных мембран варьируются от 0,05 мкм (граница минимальных размеров пор в микрофильтрационных мембранах) до 1 нм (граница пор максимального размера в обратноосмотических мембранах). Типичное применение ультрафильтрации — отделение макромолекулярных компонентов от раствора, причем нижний предел отделяемых растворенных веществ соответствует молекулярным массам в несколько тысяч.
16. Особые оптические свойства коллоидных растворов обусловлены их главными особенностями: дисперсностью и гетерогенностью. На оптические свойства дисперсных систем в значительной степени влияют размер и форма частиц. Прохождение света через коллоидный раствор сопровождается такими явлениями, как поглощение, отражение, преломление и рассеяние света. Преобладание какого-либо из этих явлений определяется соотношением между размером частиц дисперсной фазы и длиной волны падающего света. Вгрубодисперсных системах в основном наблюдается отражение света от поверхности частиц. В коллоидных растворах размеры частиц сравнимы с длиной волны видимого света, что предопределяет рассеяние света за счёт дифракции световых волн.
Светорассеяние в коллоидных растворах проявляется в виде опалесценции – матового свечения (обычно голубоватых оттенков), которое хорошо заметно на тёмном фоне при боковом освещении золя. Причиной опалесценции является рассеяние света на коллоидных частицах за счёт дифракции. С опалесценцией связано характерное для коллоидных систем явление – эффект Тиндаля: при пропускании пучка света через коллоидный раствор с направлений, перпендикулярных лучу, наблюдается образование в растворе светящегося конуса.
Процесс дифракционного светорассеяния на частицах, размер которых значительно меньше длины волны описывается уравнением Рэлея, связывающим интенсивность рассеянного единицей объёма света I с числом частиц в единице объёма ν, объёмом частицы V, длиной волны λ и амплитудой А падающего излучения и показателями преломления дисперсной фазы и дисперсионной среды n1 и n2 соответственно:
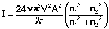
Из уравнения (IV.18) видно, что, чем меньше длина волны падающего излучения, тем больше будет рассеяние. Следовательно, если на частицу падает белый свет, наибольшее рассеивание рассеяние будут испытывать синие и фиолетовые компоненты. Поэтому в проходящем свете коллоидный раствор будет окрашен в красноватый цвет, а в боковом, отраженном – в голубой.
17. Зако́н Бугера — Ламберта — Бера — 0%A4%D0%B8%D0%B7%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD"физический закон, определяющий ослабление параллельного0%9C%D0%BE%D0%BD%D0%BE%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D0%B8%D0%B7%D0%BB%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D0%B5"монохроматического пучка светапри распространении его в поглощающей среде.
Закон выражается следующей формулой:
 ,
,
где  — интенсивностьвходящего
пучка,
— интенсивностьвходящего
пучка,  —
толщина слоя вещества, через которое
проходит
свет,
—
толщина слоя вещества, через которое
проходит
свет,  — 0%9F%D0%BE%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D0%B5%D0%BB%D1%8C_%D0%BF%D0%BE%D0%B3%D0%BB%D0%BE%D1%89%D0%B5%D0%BD%D0%B8%D1%8F"показатель
поглощения (не
путать с безразмерным показателем
поглощения
— 0%9F%D0%BE%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D0%B5%D0%BB%D1%8C_%D0%BF%D0%BE%D0%B3%D0%BB%D0%BE%D1%89%D0%B5%D0%BD%D0%B8%D1%8F"показатель
поглощения (не
путать с безразмерным показателем
поглощения  ,
который связан с
формулой
,
который связан с
формулой 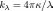 ,
где
,
где  —
длина волны).
—
длина волны).
Показатель поглощения характеризует свойства вещества и зависит от 0%94%D0%BB%D0%B8%D0%BD%D0%B0_%D0%B2%D0%BE%D0%BB%D0%BD%D1%8B"длины волны λ поглощаемого света. Эта зависимость называется 0%A1%D0%BF%D0%B5%D0%BA%D1%82%D1%80_%D0%BF%D0%BE%D0%B3%D0%BB%D0%BE%D1%89%D0%B5%D0%BD%D0%B8%D1%8F"спектром поглощения вещества.
Мутность воды обусловлена содержанием взвешенных в воде мелкодисперсных примесей – нерастворимых или коллоидных частиц различного происхождения.
Мутность воды обусловливают и некоторые другие характеристики воды – такие, как: – наличие осадка, который может отсутствовать, быть незначительным, заметным, большим, очень большим, измеряясь в миллиметрах; – взвешенные вещества, или грубодисперсные примеси, – определяются гравиметрически после фильтрования пробы, по привесу высушенного фильтра. Этот показатель обычно малоинформативен и имеет значение, главным образом, для сточных вод; – прозрачность, измеряется как высота столба воды, при взгляде сквозь который можно различать узнаваемый знак (отверстия на диске, стандартный шрифт, крестообразная метка и т.п.).
Опти́ческая пло́тность — мера ослабления света прозрачными объектами (такими, как кристаллы, стекла, фотоплёнка) или отражения света непрозрачными объектами (такими, как фотография, металлы и т.д.).
Вычисляется как десятичный логарифм отношения 0%9F%D0%BE%D1%82%D0%BE%D0%BA_%D0%B8%D0%B7%D0%BB%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F"потока излучения падающего на объект, к потоку излучения прошедшего через него (отразившегося от него), т. е. это есть логарифм от величины, обратной к 0%9A%D0%BE%D1%8D%D1%84%D1%84%D0%B8%D1%86%D0%B8%D0%B5%D0%BD%D1%82_%D0%BF%D1%80%D0%BE%D0%BF%D1%83%D1%81%D0%BA%D0%B0%D0%BD%D0%B8%D1%8F"коэффициенту пропускания (0%9A%D0%BE%D1%8D%D1%84%D1%84%D0%B8%D1%86%D0%B8%D0%B5%D0%BD%D1%82_%D0%BE%D1%82%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D1%8F_(%D0%BE%D0%BF%D1%82%D0%B8%D0%BA%D0%B0)"отражения).
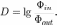
К примеру D=4 означает, что свет был ослаблен в 104=10 000 раз, т. е. для человека это полностью чёрный объект, а D=0 означает, что свет прошёл (отразился) полностью.
Оптические методы исследования
основаны на использовании законов оптики, касающихся природы, распространения и взаимодействия с веществом электромагнитного излучения оптического диапазона (видимый свет, ультрафиолетовое и инфракрасное излучение).
Законы геометрической оптики, характеризующие прямолинейное распространение света в однородных средах, его отражение и преломление в гетерогенных средах, лежат в основе расчета, конструирования и эксплуатации таких широко используемых в медицине приборов, как микроскопы, рефрактометры, медицинские осветители, аппараты для светолечения, эндоскопы, лазерные установки и др.
18. Коагуляция (от 0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA"лат. coagulatio — свертывание, сгущение), также старение — объединение мелких частиц 0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"дисперсных систем в более крупные под влиянием сил сцепления с образованием коагуляционных структур.
Коагуляция — физико-химический процесс слипания коллоидных частиц.
Коагуляция ведёт к выпадению из 0%9A%D0%BE%D0%BB%D0%BB%D0%BE%D0%B8%D0%B4%D0%BD%D1%8B%D0%B5_%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D1%8B"коллоидного раствора хлопьевидного 0%9E%D1%81%D0%B0%D0%B4%D0%BE%D0%BA"осадка или к0%A1%D1%82%D1%83%D0%B4%D0%BD%D0%B8"застудневанию. Коагуляция — естественный, самопроизвольный процесс расслаивания коллоидного раствора на твёрдую 0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%84%D0%B0%D0%B7%D0%B0"фазу и дисперсионную среду. Таким образом дисперсная система стремится достигнуть 0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D1%80%D0%B0%D0%B2%D0%BD%D0%BE%D0%B2%D0%B5%D1%81%D0%B8%D0%B5"состояния минимальной энергии.
способность сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд. Агрегативная устойчивость золей обусловлена, таким образом, рядом факторов: во-первых, снижением поверхностной энергии дисперсной фазы (т.е. уменьшения движущей силы коагуляции) в результате образования двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания имеющих одноименный заряд коллоидных частиц и противоионов.
19. 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82"Электролиты в диспергаторе ускоряют старение (0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BA%D0%BE%D0%B0%D0%B3%D1%83%D0%BB%D1%8F%D1%86%D0%B8%D1%8F"электрокоагуляция).
Столкновения частиц, происходящие ввиду 0%91%D1%80%D0%BE%D1%83%D0%BD%D0%BE%D0%B2%D1%81%D0%BA%D0%BE%D0%B5_%D0%B4%D0%B2%D0%B8%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5"броуновского движения, далеко не всегда приводят к их слиянию. Двойной электрический слой, окружающий дисперсные частицы, отталкивает их друг от друга. 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82"Электролиты разрушают и деформируют этот слой, ускоряя коалесценцию. Эффективность процесса зависит от вида электролита (лиотропные ряды0%98%D0%BE%D0%BD"ионов) и его 0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C"валентности.
Правило Шульце - Гарди:
"Коагулирующий ион имеет заряд, протиоположный коллоидной частицы, и чем он больше, тем больше его коагулирующее действие."
Теория коагуляции золей под действием электролитов (теория ДЛФО) строится на рассмотрении баланса молекулярных сил притяжения и сил ионно-электростатического отталкивания, действующих в узком зазоре, разделяющим частицы дисперсной фазы. Первые количественные расчеты были произведены Б.В.Дерягиным в конце 30-х гг. и затем завершены в работе Б.В.Дерягина и Л.Д.Ландау (1941 г.). Аналогичный подход к изучению устойчивости коллоидных систем независимо был развит в работах голландских исследователей Фервея и Оербека (1946 г.). По начальным буквам фамилий основных авторов теория получила название ДЛФО.
Основное упрощение теории ДЛФО состоит в том, что на частицы действуют две силы. Одна из них – взаимное притяжение частиц, создаваемое дисперсионными силами.
По эмпирическому правилу Шульце-Гарди порог коагуляции определяется в основном валентностью противоионов: отношение порогов коагуляции одно-, двух- и трёхвалентных противоионов приближенно равно 1:0,016:0,0013 (соответственно отношение обратных величин — коагулирующих способностей равно 1:60:700).
Вместе с тем, наряду с общим уменьшением порога коагуляции с ростом валентности противоионов наблюдаются более слабые различия коагулирующих способностей ионов одной валентности — так называемые лиотропные ряды ионов, — связанные с различием их поляризуемости и гидратируемости.
20. Коллоидная защита — предохранение коллоидных растворов от коагуляции и, следовательно, повышение их устойчивости добавлением небольших количеств высокомолекулярных веществ (белков, крахмала, агар-агара и др.), так называемых защитных веществ. Коллоидная защиту используют при изготовлении устойчивых коллоидных препаратов серебра (колларгол), ртути, серы и других
Устойчивость дисперсных систем характеризуется постоянством дисперсности (распределения частиц по размерам) и концентрации дисперсной фазы (числом частиц в единице объема). Наиболее сложна в теоретическом аспекте и важна в практическом отношении проблема устойчивости аэрозолей и жидких лиофобных дисперсных систем.
Различают седиментационную устойчивость и устойчивость к коагуляции (агрегативную устойчивость). Седиментационно устойчивы коллоидные системы с газовой и жидкой дисперсионной средой, в которых броуновское движение частиц препятствует оседанию; грубодисперсные системы с одинаковой плотностью составляющих их фаз; системы, скоростью седиментации в которых можно пренебречь из-за высокой вязкости среды.
21. Суспе́нзия — смесь веществ, где твёрдое вещество распределено в виде мельчайших частичек в жидком веществе во взвешенном (неосевшем) состоянии.0%A1%D1%83%D1%81%D0%BF%D0%B5%D0%BD%D0%B7%D0%B8%D0%B8"[1]HYPERLINK "http://ru.wikipedia.org/wiki/%D0%A1%D1%83%D1%81%D0%BF%D0%B5%D0%BD%D0%B7%D0%B8%D0%B8"[2] Суспензия — это 0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"грубодисперсная система с твёрдой дисперсной фазой и жидкой0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"дисперсионнойHYPERLINK "http://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0" средой. Обычно частицы дисперсной фазы настолько велики (более 10 мкм), что оседают под действием силы тяжести (седиментируют). Порошо́к — состояние вещества, при которой твёрдое вещество или вещества, входящие в его состав, очень сильно измельчены, причём его частицы не соединены друг с другом (например клеем), что позволяет придавать их скоплению произвольную форму. Широко применяется в различных индустриях и народном хозяйстве. Пе́на — 0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"дисперсная система, состоящая из0%9F%D1%83%D0%B7%D1%8B%D1%80%D1%8C"пузырей 0%93%D0%B0%D0%B7"газа, разделённых 0%96%D0%B8%D0%B4%D0%BA%D0%BE%D1%81%D1%82%D1%8C"жидкой (или0%A2%D0%B2%D1%91%D1%80%D0%B4%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE&action=edit&redlink=1"твёрдой) фазой.Жидкая пена образуется при смешении жидкости с газом, а также при 0%9A%D0%B8%D0%BF%D0%B5%D0%BD%D0%B8%D0%B5"кипении. Для облегчения образования пены применяются0%9F%D0%B5%D0%BD%D0%BE%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D0%BE%D0%B2%D0%B0%D1%82%D0%B5%D0%BB%D1%8C"пенообразователи. Оставленная в покое, пена разрушается (разделяется на жидкость и газ).Примеры твёрдой пены — 0%9F%D0%B5%D0%BC%D0%B7%D0%B0"пемза, 0%9F%D0%B5%D0%BD%D0%BE%D0%B1%D0%B5%D1%82%D0%BE%D0%BD"пенобетон,0%9F%D0%B5%D0%BD%D0%BE%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB"пенометалл, 0%9F%D0%B5%D0%BD%D0%BE%D0%BF%D0%BB%D0%B0%D1%81%D1%82"пенопласт, 0%9F%D0%BE%D1%80%D0%BE%D0%BB%D0%BE%D0%BD"поролон,0%9F%D0%B5%D0%BD%D0%BE%D0%BF%D0%BE%D0%BB%D0%B8%D1%83%D1%80%D0%B5%D1%82%D0%B0%D0%BD"пенополиуретан.
22. Эму́льсия (новолат. emulsio, от лат. emulgeo — дою, выдаиваю) — 0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"дисперсная HYPERLINK "http://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D0%BF%D0%B5%D1%80%D1%81%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"системас жидкой дисперсионной средой и жидкой дисперсной фазой. Эмульсии состоят из несмешиваемых жидкостей. Например, молоко — одна из первых изученных эмульсий, в нём капельки жира распределены в водной среде. Эмульсии низкой концентрации — неструктурированные жидкости. Высококонцентрированные эмульсии — структурированные системы.
Основные типы эмульсий:
Прямые, с каплями неполярной жидкости в 0%9F%D0%BE%D0%BB%D1%8F%D1%80%D0%BD%D0%B0%D1%8F_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B0"полярной среде (типа «масло в воде»)
Обратные, или инвертные (типа «вода в масле»)
Деэмульгирование, процесс, обратный эмульгированию, разрушение эмульсий, т. е. дисперсных систем, состоящих из двух несмешивающихся жидкостей, одна из которых в виде мелких капель равномерно распределена в объёме другой. Капли эмульсии при Д. укрупняются вследствие0%BA%D0%BD%D0%B8%D0%B3%D0%B8/%D0%91%D0%A1%D0%AD/%D0%9A%D0%BE%D0%B0%D0%BB%D0%B5%D1%81%D1%86%D0%B5%D0%BD%D1%86%D0%B8%D1%8F/"коалесценции (слияния) в процессе броуновского движения, 0%BA%D0%BD%D0%B8%D0%B3%D0%B8/%D0%91%D0%A1%D0%AD/%D0%A1%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D1%8F/"седиментации (оседания) или перемешивания. Д. приводит к полному или частичному расслоению образующих эмульсию жидкостей.
Действие эмульгаторов основано на способности поверхностно-активных веществ снижать энергию, необходимую для создания свободной поверхности раздела фаз.Концентрируясь на поверхности раздела смешивающихся фаз, ПАВ снижают межфазное поверхностное натяжение и обеспечивают длительную стабильность композиции.В зависимости от природы ПАВ они ускоряют образование и стабилизируют тип эмульсии, в дисперсионной среде в которой они лучше растворимы.
