
- •Диаграммы однокомпонентных систем
- •Отклонения от закона Рауля
- •Применение - обнаружение присутствия ионов в растворах электролитов
- •5. Молекулярная адсорбция из растворов
- •Теория мономолекулярной адсорбции Ленгмюра
- •6. Адсорбция из растворов электролитов
- •11. Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил.
Отклонения от закона Рауля
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых 0%9A%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D1%8F_%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%BE%D0%B2"концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных — отрицательные отклонения.
18. Криоскопия (от 0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA"гречHYPERLINK "http://ru.wikipedia.org/wiki/%D0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA". κρύο — холод и 0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA"греч. σκοπέω смотрю) — метод исследования растворов, в основе которого лежит измерение понижения 0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"температуры 0%9A%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D0%B8%D0%B7%D0%B0%D1%86%D0%B8%D1%8F"замерзания 0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80"раствора по сравнению с температурой замерзания чистого 0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D1%82%D0%B5%D0%BB%D1%8C"растворителя. Был предложен 0%A0%D0%B0%D1%83%D0%BB%D1%8C,_%D0%A4%D1%80%D0%B0%D0%BD%D1%81%D1%83%D0%B0_%D0%9C%D0%B0%D1%80%D0%B8"Ф. Раулем в 0%B3%D0%BE%D0%B4"1882 году.
Давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и может быть выражено уравнением (согласно 0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%A0%D0%B0%D1%83%D0%BB%D1%8F"закону Рауля):
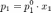
где  —
мольная доля растворителя.
—
мольная доля растворителя.
Видно,
что оно ниже, чем давление пара над
чистым растворителем, и снижается с
ростом концентрации растворенного
вещества. Измеряя 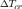 ,
можно определить молярную массу
растворенного вещества, в соответствии
с выражением:
,
можно определить молярную массу
растворенного вещества, в соответствии
с выражением:
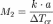
где a — число граммов растворенного вещества, приходящееся на 1000 граммов растворителя.
Эбулиоскопия (от лат. ebulio — вскипаю) — метод исследования0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80"растворов, основанный на измерении повышения их 0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BA%D0%B8%D0%BF%D0%B5%D0%BD%D0%B8%D1%8F"температуры кипения по сравнению с чистым растворителем. Используется для определения 0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%B0%D1%8F_%D0%BC%D0%B0%D1%81%D1%81%D0%B0"молекулярной массы растворенного вещества, активностирастворителя, 0%A1%D1%82%D0%B5%D0%BF%D0%B5%D0%BD%D1%8C_%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D0%B8"степени диссоциации (или 0%98%D0%B7%D0%BE%D1%82%D0%BE%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%BA%D0%BE%D1%8D%D1%84%D1%84%D0%B8%D1%86%D0%B8%D0%B5%D0%BD%D1%82"изотонического коэффициента).
Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с 0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%A0%D0%B0%D1%83%D0%BB%D1%8F"законом Рауля, может быть выражено уравнением:
где — мольная доля растворителя.
Если известны изменение температуры кипения и концентрация раствора, можно определить молярную массу растворенного вещества:
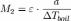
где a — число грамм растворенного вещества на 1000 г растворителя. Этот метод применим для разбавленных растворов нелетучих веществ и неэлектролитов.
19. О́смос (от 0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA"гречHYPERLINK "http://ru.wikipedia.org/wiki/%D0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA". ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Более широкое толкование явления осмоса основано на применении0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5_%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5_%E2%80%94_%D0%91%D1%80%D0%B0%D1%83%D0%BD%D0%B0"ПринципаHYPERLINK "http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5_%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5_%E2%80%94_%D0%91%D1%80%D0%B0%D1%83%D0%BD%D0%B0" HYPERLINK "http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5_%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5_%E2%80%94_%D0%91%D1%80%D0%B0%D1%83%D0%BD%D0%B0"ЛеHYPERLINK "http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5_%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5_%E2%80%94_%D0%91%D1%80%D0%B0%D1%83%D0%BD%D0%B0" HYPERLINK "http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5_%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5_%E2%80%94_%D0%91%D1%80%D0%B0%D1%83%D0%BD%D0%B0"ШательеHYPERLINK "http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5_%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5_%E2%80%94_%D0%91%D1%80%D0%B0%D1%83%D0%BD%D0%B0" — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на 0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80"раствор, отделённый от чистого0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D1%82%D0%B5%D0%BB%D1%8C"растворителя 0%A7%D0%B0%D1%81%D1%82%D0%B8%D1%87%D0%BD%D0%BE_%D0%BF%D1%80%D0%BE%D0%BD%D0%B8%D1%86%D0%B0%D0%B5%D0%BC%D0%B0%D1%8F_%D0%BC%D0%B5%D0%BC%D0%B1%D1%80%D0%B0%D0%BD%D0%B0"полупроницаемой мембраной, при котором прекращается0%94%D0%B8%D1%84%D1%84%D1%83%D0%B7%D0%B8%D1%8F"диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный 0%9F%D0%B0%D1%80%D0%B0%D0%BC%D0%B5%D1%82%D1%80"параметр, характеризующий поведение 0%92%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE"вещества в 0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80"растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролитатой же 0%9A%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D1%8F_%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%BE%D0%B2"концентрации при неизменных прочих параметрах системы:
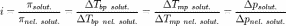 ,
,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — 0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BA%D0%B8%D0%BF%D0%B5%D0%BD%D0%B8%D1%8F"температура кипения, а Tmp —0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BF%D0%BB%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F"температура плавления (замерзания).
20. Добавление третьего компонента к бинарной системе всегда влияет на взаимную растворимость данных двух компонентов. При этом критическая температура бинарной системы может возрастать или уменьшаться, т.е. взаимная растворимость первых двух компонентов может улучшаться или ухудшаться. Это зависит от способности третьего компонента растворяться в первых двух. Допустим , что компоненты А и Б ограниченно смешиваются. Если третий компонент С в равной степени растворим в компонентах А и Б, то взаимная смешиваемость компонентов А и Б улучшается.
Нернста закон распределения
определяет относительное содержание в двух несмешивающихся или ограниченно смешивающихся жидкостях растворимого в них компонента; является одним из законов идеальных разбавленных растворов. Открыт в 1890 В. 0%9D%D0%B5%D1%80%D0%BD%D1%81%D1%82"Нернстом. Согласно Н. з. р., при равновесии отношение концентраций третьего компонента в двух жидких фазах является постоянной величиной. Н. з. р. может быть записан в виде c1/c2 = k, где c1 и c2 — равновесные молярные концентрации третьего компонента в первой и второй фазах; постоянная k — коэффициент распределения, зависящий от температуры. Н. з. р. позволяет определить более выгодные условия экстрагирования веществ из растворов.
Экстра́кция (от 0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA"лат. extraho — извлекаю) — метод извлечения0%92%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE"вещества из 0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80"раствора или сухой смеси с помощью подходящего0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D1%82%D0%B5%D0%BB%D1%8C"растворителя (экстраге́нта). Для извлечения из раствора применяются растворители, не смешивающиеся с этим раствором, но в которых вещество растворяется лучше, чем в первом растворителе.
Экстракция может быть разовой (однократной или многократной) или непрерывной (перколя́ция).
21. Электроли́ты — 0%92%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE"вещества, 0%A0%D0%B0%D1%81%D0%BF%D0%BB%D0%B0%D0%B2%D1%8B"расплавы или 0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D1%8B"растворы которых проводят0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%82%D0%BE%D0%BA"электрическийHYPERLINK "http://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%82%D0%BE%D0%BA" ток вследствие 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F"диссоциации на 0%98%D0%BE%D0%BD"ионы, однако сами вещества не проводят электрический ток. Примерами электролитов могут служить растворы 0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0"кислот, 0%A1%D0%BE%D0%BB%D0%B8"солей и 0%9E%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5_(%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)"оснований. Электролиты — проводникивторого рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, и обладающие вследствие этого ионной проводимостью.
Удельной проводимостью называют меру способности веществапроводить 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%82%D0%BE%D0%BA"электрический ток. Согласно 0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%9E%D0%BC%D0%B0"закону Ома в линейном изотропномвеществе удельная проводимость является коэффициентом пропорциональности между 0%9F%D0%BB%D0%BE%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%82%D0%BE%D0%BA%D0%B0"плотностью возникающего тока и 0%9D%D0%B0%D0%BF%D1%80%D1%8F%D0%B6%D1%91%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B3%D0%BE_%D0%BF%D0%BE%D0%BB%D1%8F"величиной электрического поля в среде:
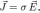
где
 —
удельная
проводимость,
—
удельная
проводимость, —
вектор 0%9F%D0%BB%D0%BE%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%82%D0%BE%D0%BA%D0%B0"плотности
тока,
—
вектор 0%9F%D0%BB%D0%BE%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%82%D0%BE%D0%BA%D0%B0"плотности
тока, —
вектор 0%9D%D0%B0%D0%BF%D1%80%D1%8F%D0%B6%D1%91%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B3%D0%BE_%D0%BF%D0%BE%D0%BB%D1%8F"напряжённости
электрического поля.
В неоднородной среде σ может зависеть
(и в общем случае зависит) от координат,
то есть не совпадает в различных точках
проводника.
—
вектор 0%9D%D0%B0%D0%BF%D1%80%D1%8F%D0%B6%D1%91%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B3%D0%BE_%D0%BF%D0%BE%D0%BB%D1%8F"напряжённости
электрического поля.
В неоднородной среде σ может зависеть
(и в общем случае зависит) от координат,
то есть не совпадает в различных точках
проводника.
22. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BF%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BD%D0%BE%D1%81%D1%82%D1%8C"электропроводности разбавленного раствора бинарного 0%A1%D0%BB%D0%B0%D0%B1%D1%8B%D0%B5_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D1%8B"слабого электролита от концентрации раствора:
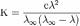
Здесь К — 0%9A%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D0%B0_%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D0%B8"константа диссоциации 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D1%8B"электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием 0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D1%85_%D0%BC%D0%B0%D1%81%D1%81"закона действующих масс и равенства
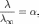
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F"электролитической диссоциации.
