
- •Диаграммы однокомпонентных систем
- •Отклонения от закона Рауля
- •Применение - обнаружение присутствия ионов в растворах электролитов
- •5. Молекулярная адсорбция из растворов
- •Теория мономолекулярной адсорбции Ленгмюра
- •6. Адсорбция из растворов электролитов
- •11. Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил.
5. Молекулярная адсорбция из растворов
Изотермы адсорбции растворенных веществ из раствора по своему виду аналогичны изотермам адсорбции для газов; для разбавленных растворов эти изотермы хорошо описываются уравнениями Фрейндлиха или Ленгмюра, если в них подставить равновесную концентрацию растворенного вещества в растворе. Однако адсорбция из растворов является значительно более сложным явлением по сравнению с газовой, поскольку одновременно с адсорбцией растворенного вещества часто происходит и адсорбция растворителя.
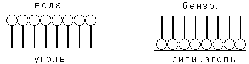
Рис. 4.8 Ориентация молекул ПАВ на поверхности адсорбента
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химикИHYPERLINK "http://www.physchem.chimfak.rsu.ru/Source/History/Persones/Langmuir.html". HYPERLINK "http://www.physchem.chimfak.rsu.ru/Source/History/Persones/Langmuir.html"Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
 (IV.15)
(IV.15)
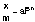 (IV.16)
(IV.16)
|
|
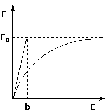
Рис. 4.7 Изотерма адсорбции Фрейндлиха в обычных (а) и логарифмических (б) координатах
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения (IV.15 - IV.16), получаем:
 (IV.17)
(IV.17)
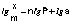 (IV.18)
(IV.18)
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
6. Адсорбция из растворов электролитов
Адсорбция из водных растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов.
Двойной электрический слой (межфазный) (ДЭС) — слой 0%98%D0%BE%D0%BD"ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, 0%94%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F"диссоциации поверхностного соединения или ориентировании полярных молекул на границе0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%84%D0%B0%D0%B7%D0%B0"фаз. Ионы, непосредственно связанные с 0%9F%D0%BE%D0%B2%D0%B5%D1%80%D1%85%D0%BD%D0%BE%D1%81%D1%82%D1%8C"поверхностью называются потенциалопределяющими. 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B7%D0%B0%D1%80%D1%8F%D0%B4"Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
[0%94%D0%B2%D0%BE%D0%B9%D0%BD%D0%BE%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%81%D0%BB%D0%BE%D0%B9&action=edit§ion=1"править]Механизм образования ДЭС
Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является 0%96%D0%B8%D0%B4%D0%BA%D0%BE%D1%81%D1%82%D1%8C"жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:
Переход ионов или 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD"электронов из одной фазы в другую (поверхностная ионизация). Примером может служить диссоциация поверхностных функциональных групп, принадлежащих одной из фаз (как правило, 0%A2%D0%B2%D0%B5%D1%80%D0%B4%D0%BE%D0%B5_%D1%82%D0%B5%D0%BB%D0%BE"твердой). Для определения знака заряда поверхности используется 0%9F%D1%80%D0%B0%D0%B2%D0%B8%D0%BB%D0%BE_%D0%A4%D0%B0%D1%8F%D0%BD%D1%81%D0%B0_%E2%80%94_%D0%9F%D0%B0%D0%BD%D0%B5%D1%82%D0%B0"правило Фаянса — HYPERLINK "http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B0%D0%B2%D0%B8%D0%BB%D0%BE_%D0%A4%D0%B0%D1%8F%D0%BD%D1%81%D0%B0_%E2%80%94_%D0%9F%D0%B0%D0%BD%D0%B5%D1%82%D0%B0"Панета
Преимущественная адсорбция в межфазном слое ионов одного знака.
Ориентирование полярных молекул в поверхностном слое. По этому механизму ДЭС образуется в случае, если вещества, составляющие фазы системы не могут обмениваться зарядами. Для определения знака заряда поверхности используют правило Кёна, гласящее, что из двух соприкасающихся фаз положительно заряжается та, которая имеет большую 0%94%D0%B8%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%BF%D1%80%D0%BE%D0%BD%D0%B8%D1%86%D0%B0%D0%B5%D0%BC%D0%BE%D1%81%D1%82%D1%8C"диэлектрическую проницаемость.
Строение ДЭС : В отсутствие теплового движения частиц, строение двойного электрического слоя подобно строению плоского 0%9A%D0%BE%D0%BD%D0%B4%D0%B5%D0%BD%D1%81%D0%B0%D1%82%D0%BE%D1%80"конденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:
Слой Гельмгольца или адсорбционный слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет толщину δ, равную радиусу потенциалопределяющих ионов в0%A1%D0%BE%D0%BB%D1%8C%D0%B2%D0%B0%D1%82%D0%B0%D1%86%D0%B8%D1%8F"несольватированном состоянии.
Диффузный слой или слой Гуи, в котором находятся противоионы. Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать больших значений. Толщина диффузного слоя рассчитывается по формуле:
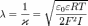
Электрической характеристикой ДЭС является 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%BF%D0%BE%D1%82%D0%B5%D0%BD%D1%86%D0%B8%D0%B0%D0%BB"потенциал φ.
7. Адсорбция из водных растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов.
АДСОРБЦИЯ СЕЛЕКТИВНАЯ (ИЗБИРАТЕЛЬНАЯ) — процесс, основанный на неодинаковой способности отдельных компонентов газовой или жидкой смеси поглощаться из данного растворителя данным адсорбентом. В аналитической практике и в технике вариации в выборе адсорбентов и десорбирующих растворителей (десорбентов), а также вариации в режиме процесса позволяют осуществлять самые различные задачи А. с. Она является основой метода разделения многокомпонентных смесей, называемого хроматографией .
По классификации М.М. Дубинина за основу принят размер пор и механизм протекающих на них процессов.
1. Макропористые тела. Радиус пор от 100 - 200 нм, Sуд = 0.5 - 2 м2/г - Для этих же адсорбентов пригодна теория адсорбции Ленгмюра. В адсорбентах и катализаторах макропоры выступают в качестве транспортных каналов и адсорбцией в них можно пренебречь.
2. Переходно-пористые тела. Радиус пор более 2 - 100 нм, Sуд = 100 - 500 м2/г. Для них характерна полимолекулярная адсорбция, которая с увеличением давления заканчивается капиллярной конденсацией.
3. Микропористые тела. Радиус пор 0.5 - 2 нм, Sуд = 500 - 1000 м2/г. Отличительной особенностью этих тел является чрезвычайно близкое расположение противоположных стенок в порах. При этом их поля поверхностных сил перекрываются и они действуют во всем объеме микропор. К ним применима теория объемного заполнения микропор.
Реальные и промышленные адсорбенты имеют набор всех пор, но соотношение пор с разными радиусами различно. Каких пор больше, к такому классу их и относят.
8. Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорбция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.
Иониты — твердые нерастворимые вещества, способные обменивать свои 0%98%D0%BE%D0%BD"иоHYPERLINK "http://ru.wikipedia.org/wiki/%D0%98%D0%BE%D0%BD"ны на ионы из окружающего их раствора. Обычно это 0%A1%D0%BC%D0%BE%D0%BB%D1%8B"синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются накатиониты, поглощающие 0%9A%D0%B0%D1%82%D0%B8%D0%BE%D0%BD"катионы, и аниониты, поглощающие 0%90%D0%BD%D0%B8%D0%BE%D0%BD"анионы. Широко применяются иониты для опреснения вод, в 0%90%D0%BD%D0%B0%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%85%D0%B8%D0%BC%D0%B8%D1%8F"аналитической химии для разделения веществ методом 0%A5%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D1%8F"хроматографии, в химической технологии. В зависимости от природы матрицы различают неорганические и органические иониты.
АМФОТЕРНЫЕ ИОНООБМЕННЫЕ СМОЛЫ
(полиамфолиты, биполярные ионообменные смолы), сетчатые полимеры, способные к обмену как анионов, так и катионов при контакте с р-рами электролитов. Кислотные и основные группы смол могут взаимод. между собой, образуя солевые связи. В ионном обмене участвуют группы, к-рые не соединены такими связями или образуют слабые солевые связи. Наиб. распространенные А. и. с., имеющие, как правило, макропористую структуру (см. Макропористые ионообменные слюлы), - амино- или иминокарбоксильные, пиридинкарбоновые, аминофосфорнокислотные.
применяют для извлечения и разделения тяжелых, цветных и редких металлов в гидрометаллургии, для разделения смесей сильных и слабых электролитов, в-в с разл. изоэлектрич. точками, рацематов. При помощи А. и. с. выделяют примеси неорг. в-в из р-ров биол. препаратов, неустойчивых в кислых и щелочных средах, и др. Выпускают эти смолы в промышленно развитых странах небольшими партиями.
9. Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Коллоидный раствор можно получить обменной реакцией. Рассмотрим образование иодида серебра при сливании разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI = AgI + KNO3,
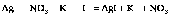 .
.
Если иодид калия и нитрат серебра взяты в эквивалентных количествах, частицы AgI растут, достигая размеров, превосходящих размеры коллоидных частиц, и быстро выпадают в осадок. Если же реакцию проводят с разбавленными растворами, то осадок не выпадает, а образуется коллоидный раствор иодида серебра. Основную массу мицеллы составляет ядро – мельчайший кристаллик иодида серебра, состоящий из большого числа молекул: m(AgI).
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
Коллоидная мицелла золя иодида серебра (см. рис. 4.9) образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+.
10. Некоторые молекулярно-кинетические свойства коллоидных систем используют для очистки золей от электролитов и молекулярных примесей, которыми полученные золи часто бывают загрязнены. Наиболее распространенными методами очистки коллоидных систем являются диализ, электродиализ и ультрафильтрация, основанные на свойстве некоторых материалов – т.н. полупроницаемых мембран (коллодия, пергамента, целлофана и т.п.) – пропускать ионы и молекулы небольших размеров и задерживать коллоидные частицы. Все полупроницаемые мембраны представляют собой пористые тела, и непроницаемость их для коллоидных частиц обусловлена тем, что коэффициент диффузии для коллоидных частиц значительно (на несколько порядков) меньше, чем для ионов и молекул, имеющих намного меньшие массу и размеры.
Бро́уновское движе́ние — в естествознании, беспорядочное движение микроскопических, видимых, взвешенных в жидкости (или газе) частиц твёрдого вещества (пылинки, частички 0%9F%D1%8B%D0%BB%D1%8C%D1%86%D0%B0"пыльцы растения и так далее), вызываемое 0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D0%B2%D0%BE%D0%B5_%D0%B4%D0%B2%D0%B8%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5"тепловым движением частиц жидкости (или газа). Не следует смешивать понятия «броуновское движение» и «тепловое движение»: броуновское движение является следствием и свидетельством существования теплового движения. Броуновское движение происходит из-за того, что все жидкости и газы состоят из атомов или молекул — мельчайших частиц, которые находятся в постоянном хаотическом тепловом движении, и потому непрерывно толкают броуновскую частицу с разных сторон. Было установлено, что крупные частицы с размерами более 5 мкм в броуновском движении практически не участвуют (они неподвижны или0%A1%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D1%8F"седиментируют), более мелкие частицы (менее 3 мкм) двигаются поступательно по весьма сложным траекториям или вращаются.
Диффузия(лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму0%94%D0%B8%D1%84%D1%84%D1%83%D0%B7%D0%B8%D1%8F"[1]. В некоторых ситуациях одно из веществ уже имеет выравненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (против 0%93%D1%80%D0%B0%D0%B4%D0%B8%D0%B5%D0%BD%D1%82_%D0%BA%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D0%B8"градиента концентрации). Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной).
Уравнение Смолуховского — 0%9A%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F&action=edit&redlink=1"кинетическое уравнение, описывающее эволюцию функции распределения координат и скороостей частиц при одномерном 0%91%D1%80%D0%BE%D1%83%D0%BD%D0%BE%D0%B2%D1%81%D0%BA%D0%BE%D0%B5_%D0%B4%D0%B2%D0%B8%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5"броуновском движении.

где 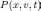 —
функция распределения броуновских
частиц по координатам и скоростям,
v — 0%A1%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C"скорость,
—
функция распределения броуновских
частиц по координатам и скоростям,
v — 0%A1%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C"скорость, 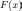 —
внешняя
сила,
—
внешняя
сила, 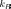 — 0%9F%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F_%D0%91%D0%BE%D0%BB%D1%8C%D1%86%D0%BC%D0%B0%D0%BD%D0%B0"постоянная
Больцмана,
T —0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"температура,
— 0%9F%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F_%D0%91%D0%BE%D0%BB%D1%8C%D1%86%D0%BC%D0%B0%D0%BD%D0%B0"постоянная
Больцмана,
T —0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"температура,  —
параметр,
характеризующий 0%92%D1%8F%D0%B7%D0%BA%D0%BE%D1%81%D1%82%D1%8C"вязкость среды,
в которой происходит броуновское
движение.
—
параметр,
характеризующий 0%92%D1%8F%D0%B7%D0%BA%D0%BE%D1%81%D1%82%D1%8C"вязкость среды,
в которой происходит броуновское
движение.
Коэффицие́нт диффу́зии — количественная характеристика скорости 0%94%D0%B8%D1%84%D1%84%D1%83%D0%B7%D0%B8%D1%8F"диффузии, равная 0%9A%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%BE_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%B0"количеству вещества (в массовых единицах), проходящего в единицу времени через участок единичной 0%9F%D0%BB%D0%BE%D1%89%D0%B0%D0%B4%D1%8C"площади (например, 1 м²) при 0%93%D1%80%D0%B0%D0%B4%D0%B8%D0%B5%D0%BD%D1%82_%D0%BA%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D0%B8"градиенте концентрации, равном единице (соответствующем изменению 1 моль/л → 0 моль/л на единицу длины). Коэффициент диффузии определяется свойствами среды и типом диффундирующих частиц.
Зависимость коэффициента диффузии от 0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"температуры в простейшем случае выражается 0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%90%D1%80%D1%80%D0%B5%D0%BD%D0%B8%D1%83%D1%81%D0%B0"законом Аррениуса:
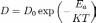 ,
,
где
D — коэффициент диффузии [ {м²}/{сек}
]; 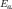 — 0%AD%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F_%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D0%B0%D1%86%D0%B8%D0%B8"энергия
активации [Дж];
k —0%9F%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F_%D0%91%D0%BE%D0%BB%D1%8C%D1%86%D0%BC%D0%B0%D0%BD%D0%B0"постоянная
Больцмана;
T — температура [
— 0%AD%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F_%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D0%B0%D1%86%D0%B8%D0%B8"энергия
активации [Дж];
k —0%9F%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F_%D0%91%D0%BE%D0%BB%D1%8C%D1%86%D0%BC%D0%B0%D0%BD%D0%B0"постоянная
Больцмана;
T — температура [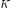 ].
].
В 0%A4%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0"физике (главным образом в 0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE-%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D1%8F"молекулярно кинетической теории) соотношением Эйнштейна (также называемое соотношением Эйнштейна — Смолуховского) называется выражение, связывающее подвижность молекулы (молекулярный параметр) с коэффициентом диффузии и температурой (макро параметры). Оно было независимо открыто 0%AD%D0%B9%D0%BD%D1%88%D1%82%D0%B5%D0%B9%D0%BD,_%D0%90%D0%BB%D1%8C%D0%B1%D0%B5%D1%80%D1%82"Альбертом Эйнштейном в 0%B3%D0%BE%D0%B4"1905 году и Марианом Смолуховским(1906) в ходе работ по изучению 0%91%D1%80%D0%BE%D1%83%D0%BD%D0%BE%D0%B2%D1%81%D0%BA%D0%BE%D0%B5_%D0%B4%D0%B2%D0%B8%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5"броуновского движения:
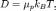
где  —
коэффициент 0%94%D0%B8%D1%84%D1%84%D1%83%D0%B7%D0%B8%D1%8F"диффузии,
—
коэффициент 0%94%D0%B8%D1%84%D1%84%D1%83%D0%B7%D0%B8%D1%8F"диффузии, 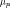 —
подвижность
частиц,
— 0%9F%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F_%D0%91%D0%BE%D0%BB%D1%8C%D1%86%D0%BC%D0%B0%D0%BD%D0%B0"постоянная
Больцмана,
а
— 0%90%D0%B1%D1%81%D0%BE%D0%BB%D1%8E%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"абсолютная
температура.
—
подвижность
частиц,
— 0%9F%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F_%D0%91%D0%BE%D0%BB%D1%8C%D1%86%D0%BC%D0%B0%D0%BD%D0%B0"постоянная
Больцмана,
а
— 0%90%D0%B1%D1%81%D0%BE%D0%BB%D1%8E%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"абсолютная
температура.
Величина подвижности определяется из соотношения
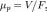
где  —
стационарная скорость перемещения
частицы в вязкой среде под действием
силы
.
—
стационарная скорость перемещения
частицы в вязкой среде под действием
силы
.

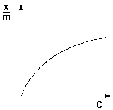 (а)
(а)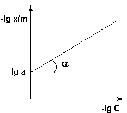 (б)
(б)