
- •1 Траектория, путь, перемещение. Скорость движения точки по прямой. Нахождение координаты по известной зависимости скорости от времени.
- •2. Векторный и координатный способы описания движения точки в пространстве. Скорость (средняя, линейная, мгновенная) и ускорение. Вычисление пройденного пути и перемещения.
- •3. Движение материальной точки по окружности (равномерное и произвольное). Баллистическое движение. Криволинейное движение точки в пространстве.
- •4. 3Акон инерции. Инерциальные системы отсчета. Второй закон Ньютона. Третий закон Ньютона и область его применимости.
- •5. Сила упругости. Закон Гука
- •7. Закон сохранения импульса в изолированной системе из двух материальных точек. Изменение импульса системы материальных точек. Импульс силы.
- •8. Теорема о движении центра масс.
- •9. Движение тел с переменной массой. Уравнение Мещерского, уравнение Циолковского.
- •10. Работа силы. Мощность. Геометрическая форма представления работы.
- •11. Кинетическая энергия материальной точки. Связь кинетической энергии с работой сил. Теорема Кенига.
- •14. Вращение твердого тела вокруг неподвижной оси. Угловая скорость и угловое ускорение как векторные величины. Связь между векторами скорости и угловой скорости.
- •15. Момент инерции. Уравнение динамики вращательного движения твердого тела. Момент инерции твердого тела
- •16. Работа при вращении тела. Условия равновесия твердого тела.
- •19. Система отсчета равномерно вращается (материальная точка покоится в нисо, материальная точка движется в нисо). Теорема Кориолиса.
- •20. Законы Кеплера и обобщение Ньютона (закон всемирного тяготения). Сила тяжести. Поле тяготения. Космические скорости.
- •22. Гармонический осциллятор. Превращения энергии при колебаниях осциллятора. Примеры гармонических осцилляторов (физический маятник, математический маятник).
- •23. Плотность среды и давление в гидростатике. Основные законы гидростатики. Барометрическая формула.
- •24. Понятие потока жидкости (газа) и уравнение непрерывности. Вывод уравнения Бернулли. Теорема Торричелли. Течение в горизонтальной трубе.
- •26. Параметры, определяющие состояние вещества. Идеальный газ. Вывод основного уравнения кинетической теории газов. Вывод основных газовых законов. Уравнение состояния идеальных газов.
- •27. Универсальная газовая постоянная. Средняя квадратичная скорость молекул. Постоянная Больцмана и средняя кинетическая энергия одной молекулы.
- •30. Теплоемкость, закон Джоуля, уравнение Роберта Майера.
- •31. Первый закон термодинамики. Работа газа при изменении объема.
- •32. 0Братимые и необратимые процессы. Равновесные и неравновесные процессы. Изопроцессы в газах.
- •34. Адиабатный процесс. Уравнение Пуассона, адиабата. Политропный процесс, уравнение политропы.
- •35. Круговые процессы или циклы. Идеальная тепловая машина и цикл Карно. К.П.Д. Идеальной тепловой машины. К.П.Д. Реальной тепловой машины.
- •36. Содержание второго закона термодинамики.
- •37. Неравенство Клаузиуса. Энтропия. Изменение энтропии при обратимых и необратимых процессах. Изменение энтропии в процессах идеального газа.
- •9.14 Теорема Клаузиуса
- •38. Энтропия и вероятность. Статистический характер второго закона термодинамики. Третье начало термодинамики.
- •39. Реальные газы. Межмолекулярные силы.
- •40. Уравнение Ван - дер - Ваальса. График уравнения Ван - дер - Ваальса.
38. Энтропия и вероятность. Статистический характер второго закона термодинамики. Третье начало термодинамики.
7.Энтропия. Вероятность.
Более
глубокий смысл энтропии вскрывается
в статистической физике: энтропия
связывается с термодинамической
вероятностью состояния системы.
Термодинамическая вероятность
![]() состояния
системы − это число способов, которыми
может быть реализовано данное состояние
системы, или число микросостояний,
осуществляющих данное макросостояние.
состояния
системы − это число способов, которыми
может быть реализовано данное состояние
системы, или число микросостояний,
осуществляющих данное макросостояние.
Согласно Больцману, энтропия системы и термодинамическая вероятность связаны между собой следующим образом:
![]() , где
, где![]() −
постоянная Больцмана, S − энтропия.
−
постоянная Больцмана, S − энтропия.
Энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
В случае необратимых процессов в замкнутой системе энтропия возрастает, т. е. процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. В случае обратимых процессов энтропия и термовероятность замкнутой системы остаются постоянными. Энтропия системы, находящейся в равновесном состоянии, максимальна.
Эти утверждения имеют место для систем, состоящих из очень большого числа частиц, но могут нарушаться в системах с малым числом частиц. Для малых систем может наблюдаться флуктуации, т. е. энтропия и термодинамическая вероятность состояний замкнутой системы на определенном отрезке времени могут убывать или оставаться постоянными.
С понижением температуры во всякой системе наблюдается тенденция к упорядоченности. Если бы тело можно было охладить до температуры, равной абсолютному нулю, когда тепловые движения молекул не мешали бы установлению порядка, то в системе установился бы идеальный порядок, которому соответствовала бы минимальная энтропия.
Если при абсолютном нуле температуры над системой совершить работу, то энтропия системы не изменится. Это доказано и отражено в теореме Нернста [2]:
при абсолютном нуле температуры любые изменения состояния происходят без изменения энтропии.
При Т=0 энтропия минимальна S=0. Иногда теорему Нернста возводят в ранг третьего начала термодинамики.
Часто третье начало термодинамики формулируют так: абсолютный нуль температуры недостижим.
Действительно, если бы существовало тело с Т=0 К (следовательно, S=0), то можно было бы построить вечный двигатель второго рода, что противоречит второму началу термодинамики.
39. Реальные газы. Межмолекулярные силы.
При
давлении 500 МПа (1 атм=101,3 кПа) объем
молекул составит уже половину всего
объема газа. Таким образом, при высоких
давлениях и низких температурах
указанная модель идеального газа
непригодна.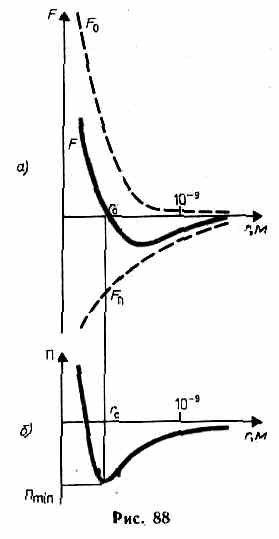 При рассмотрении реальных
газов —
При рассмотрении реальных
газов —
газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях £10-9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В XX в., по мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На рис. 88, а приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fo и Fп — соответственно силы отталкивания и притяжения, a F — их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными. На расстоянии r = r0 результирующая сила F=0, т. е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние r0 соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При r<r0 преобладают силы отталкивания (F>0), при r>r0 — силы притяжения (F<0). На расстояниях r>10-9 м межмолекулярные силы взаимодействия практически отсутствуют (F®0).
Элементарная работа dA силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е. dA=Fdr=-dП. (60.1)
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рис. 88, б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (г®¥), то П=0. При постепенном сближении молекул между ними появляются силы притяжения (F<0), которые совершают положительную работу (dA=Fdr>0). Тогда, согласно (60.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при r=r0. При r<r0 с уменьшением r силы отталкивания (F>0) резко возрастают и совершаемая против них работа отрицательна (dA=Fdr<0). Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (r=r0) обладает минимальной потенциальной энергией.
