
- •1 Траектория, путь, перемещение. Скорость движения точки по прямой. Нахождение координаты по известной зависимости скорости от времени.
- •2. Векторный и координатный способы описания движения точки в пространстве. Скорость (средняя, линейная, мгновенная) и ускорение. Вычисление пройденного пути и перемещения.
- •3. Движение материальной точки по окружности (равномерное и произвольное). Баллистическое движение. Криволинейное движение точки в пространстве.
- •4. 3Акон инерции. Инерциальные системы отсчета. Второй закон Ньютона. Третий закон Ньютона и область его применимости.
- •5. Сила упругости. Закон Гука
- •7. Закон сохранения импульса в изолированной системе из двух материальных точек. Изменение импульса системы материальных точек. Импульс силы.
- •8. Теорема о движении центра масс.
- •9. Движение тел с переменной массой. Уравнение Мещерского, уравнение Циолковского.
- •10. Работа силы. Мощность. Геометрическая форма представления работы.
- •11. Кинетическая энергия материальной точки. Связь кинетической энергии с работой сил. Теорема Кенига.
- •14. Вращение твердого тела вокруг неподвижной оси. Угловая скорость и угловое ускорение как векторные величины. Связь между векторами скорости и угловой скорости.
- •15. Момент инерции. Уравнение динамики вращательного движения твердого тела. Момент инерции твердого тела
- •16. Работа при вращении тела. Условия равновесия твердого тела.
- •19. Система отсчета равномерно вращается (материальная точка покоится в нисо, материальная точка движется в нисо). Теорема Кориолиса.
- •20. Законы Кеплера и обобщение Ньютона (закон всемирного тяготения). Сила тяжести. Поле тяготения. Космические скорости.
- •22. Гармонический осциллятор. Превращения энергии при колебаниях осциллятора. Примеры гармонических осцилляторов (физический маятник, математический маятник).
- •23. Плотность среды и давление в гидростатике. Основные законы гидростатики. Барометрическая формула.
- •24. Понятие потока жидкости (газа) и уравнение непрерывности. Вывод уравнения Бернулли. Теорема Торричелли. Течение в горизонтальной трубе.
- •26. Параметры, определяющие состояние вещества. Идеальный газ. Вывод основного уравнения кинетической теории газов. Вывод основных газовых законов. Уравнение состояния идеальных газов.
- •27. Универсальная газовая постоянная. Средняя квадратичная скорость молекул. Постоянная Больцмана и средняя кинетическая энергия одной молекулы.
- •30. Теплоемкость, закон Джоуля, уравнение Роберта Майера.
- •31. Первый закон термодинамики. Работа газа при изменении объема.
- •32. 0Братимые и необратимые процессы. Равновесные и неравновесные процессы. Изопроцессы в газах.
- •34. Адиабатный процесс. Уравнение Пуассона, адиабата. Политропный процесс, уравнение политропы.
- •35. Круговые процессы или циклы. Идеальная тепловая машина и цикл Карно. К.П.Д. Идеальной тепловой машины. К.П.Д. Реальной тепловой машины.
- •36. Содержание второго закона термодинамики.
- •37. Неравенство Клаузиуса. Энтропия. Изменение энтропии при обратимых и необратимых процессах. Изменение энтропии в процессах идеального газа.
- •9.14 Теорема Клаузиуса
- •38. Энтропия и вероятность. Статистический характер второго закона термодинамики. Третье начало термодинамики.
- •39. Реальные газы. Межмолекулярные силы.
- •40. Уравнение Ван - дер - Ваальса. График уравнения Ван - дер - Ваальса.
31. Первый закон термодинамики. Работа газа при изменении объема.
Первое
начало термодинамики: Количество
теплоты, сообщённое газу, идёт на
приращение внутренней энергии газа и
на совершение газом работы над внешними
телами.
 - первое начало термодинамики.
Определим физические величины,
входящие в этот закон.
- первое начало термодинамики.
Определим физические величины,
входящие в этот закон.
а)
Внутренняя энергия идеального
газа равна
 ,
где
,
где
 - количество вещества, i
– число степеней свободы молекул газа.
Тогда изменение внутренней энергии
газа равно
- количество вещества, i
– число степеней свободы молекул газа.
Тогда изменение внутренней энергии
газа равно
 - изменение внутренней энергии газа.
- изменение внутренней энергии газа.
б)
Вычислим теперь работу, совершаемую
газом при изменении объёма. Для этого
рассмотрим газ, находящийся в цилиндре
под поршнем, который может свободно
перемещаться.
 При нагревании давление газа P
, будет оставаться постоянным, и, как
видно из рисунка, работа, которую
совершает газ, будет равна:
При нагревании давление газа P
, будет оставаться постоянным, и, как
видно из рисунка, работа, которую
совершает газ, будет равна:
 ,
где dV=Sdl
- изменение объема газа.
,
где dV=Sdl
- изменение объема газа.
 - работа, совершаемая газом при
изменении его объема.
- работа, совершаемая газом при
изменении его объема.
в)
Наконец, найдём формулу для подсчёта
количества теплоты, сообщенной газу
массы при его нагревании на
при его нагревании на
 .
Для этого введем понятие молярной
теплоёмкости газа
.
Для этого введем понятие молярной
теплоёмкости газа
 .
Молярная теплоёмкость газа – это
количество теплоты, сообщённой 1 молю
газа, для увеличения его температуры
на
.
Тогда формула для подсчёта теплоты
будет иметь вид
.
Молярная теплоёмкость газа – это
количество теплоты, сообщённой 1 молю
газа, для увеличения его температуры
на
.
Тогда формула для подсчёта теплоты
будет иметь вид
 -
теплота, сообщённая газу для увеличения
его температуры на dT.
-
теплота, сообщённая газу для увеличения
его температуры на dT.
32. 0Братимые и необратимые процессы. Равновесные и неравновесные процессы. Изопроцессы в газах.
Равновесным состоянием системы называется такое состояние, при котором параметры системы имеют определённые значения, остающиеся при неизменных внешних условиях постоянными сколько угодно долго. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным или квазистатическим. Из сказанного следует, что равновесным может быть только бесконечно медленный процесс. При достаточно медленном протекании реальные процессы могут приближаться к равновесному процессу сколько угодно близко. Равновесный процесс может быть проведен в обратном направлении, причём система будет проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют также обратимыми процессами. В случае обратимого процесса при возвращении в исходное состояние ни в самой системе, ни в окружающих телах не остаётся никаких изменений. Если такие изменения появляются, то такой процесс называется необратимым процессом. Все реальные процессы необратимы
1. Термодинамика изохорического процесса: V=const
Рассмотрим закон, описывающий этот процесс и его график в координатах (P,V). Этот закон является частным случаем уравнения состояния идеального газа: PV = RT.

 .
- закон Шарля. Так как
.
- закон Шарля. Так как
 ,
то
,
то
 и
и
 ,
т.е
,
т.е
 -
работа совершаемая газом при
изохорическом процессе равна нулю.
Тогда
-
работа совершаемая газом при
изохорическом процессе равна нулю.
Тогда
 -
первое начало термодинамики для
изохорического процесса. Поскольку
количество теплоты, сообщенное газу,
равно
-
первое начало термодинамики для
изохорического процесса. Поскольку
количество теплоты, сообщенное газу,
равно
 ,
где
,
где
 -
молярная теплоёмкость газа при постоянном
объёме, то мы получаем полезную формулу
для подсчёта приращения внутренней
энергии газа:
-
молярная теплоёмкость газа при постоянном
объёме, то мы получаем полезную формулу
для подсчёта приращения внутренней
энергии газа:
 -
изменение внутренней энергии газа.
Сравнивая эту формулу с другой
формулой
-
изменение внутренней энергии газа.
Сравнивая эту формулу с другой
формулой
 получим выражение для молярной
теплоёмкости газа при постоянном
объёме:
получим выражение для молярной
теплоёмкости газа при постоянном
объёме:
 .
.
Термодинамика изобарического процесса: P=const.
Соотношение Майера
Сначала
рассмотрим закон, описывающий этот
процесс и его график в координатах
(P,V).

 - закон Гей-Люссака. Теперь работа,
совершаемая газом,
- закон Гей-Люссака. Теперь работа,
совершаемая газом,
 приращение внутренней энергии газа
тоже не равно нулю
приращение внутренней энергии газа
тоже не равно нулю
 ,
и первое начало термодинамики не
меняет своего вида:
,
и первое начало термодинамики не
меняет своего вида:
 первое начало термодинамики для
изобарического процесса. Формула
для подсчёта теплоты теперь примет вид
первое начало термодинамики для
изобарического процесса. Формула
для подсчёта теплоты теперь примет вид
 где
где
 -
молярная теплоёмкость газа при постоянном
давлении. Приращение внутренней энергии
запишем в виде
.
Работу, совершаемую газом, также
представим в аналогичном виде
-
молярная теплоёмкость газа при постоянном
давлении. Приращение внутренней энергии
запишем в виде
.
Работу, совершаемую газом, также
представим в аналогичном виде
 .
Здесь мы воспользовались уравнением
Менделеева-Клапейрона
.
Здесь мы воспользовались уравнением
Менделеева-Клапейрона
 дифференциальное уравнение которого
при
дифференциальное уравнение которого
при
 дает
дает
 .
Из выражения для работы следует
размерность и физический смысл
универсальной газовой постоянной R:
.
Из выражения для работы следует
размерность и физический смысл
универсальной газовой постоянной R:
 ,
, .
Универсальная газовая постоянная R
численно равно работе, совершённой
одним молем газа при изобарическом
процессе при увеличении его температуры
на один градус. Продолжим рассмотрение
изобарического процесса. Подставляя
полученные выражения для dQ,
dU, dA
в первое начало термодинамики, получим:
.
Универсальная газовая постоянная R
численно равно работе, совершённой
одним молем газа при изобарическом
процессе при увеличении его температуры
на один градус. Продолжим рассмотрение
изобарического процесса. Подставляя
полученные выражения для dQ,
dU, dA
в первое начало термодинамики, получим:
 Сокращая на dT,
получим соотношение между молярными
теплоёмкостями газа при постоянном
объёме
Сокращая на dT,
получим соотношение между молярными
теплоёмкостями газа при постоянном
объёме
 и постоянном давлении
и постоянном давлении
 :
:
 - соотношение Майера. Учитывая
выражение для
- соотношение Майера. Учитывая
выражение для
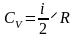 ,
получим аналогичное выражение для
=
,
получим аналогичное выражение для
= .
Приведем также выражение для отношения
молярных теплоёмкостей
и
.
Приведем также выражение для отношения
молярных теплоёмкостей
и
 .
Для двухатомных молекул при невысоких
температурах i
= 5, тогда
.
Для двухатомных молекул при невысоких
температурах i
= 5, тогда
 1,4.
Выпишем работу, совершаемую газом при
изобарическом процессе (P=const):
1,4.
Выпишем работу, совершаемую газом при
изобарическом процессе (P=const):

 - работа, совершаемая
газом при изобарическом процессе.
- работа, совершаемая
газом при изобарическом процессе.
 На графике (P,V)
работа, совершаемая газом, численно
равна площади прямоугольника, построенного
под изобарой.
На графике (P,V)
работа, совершаемая газом, численно
равна площади прямоугольника, построенного
под изобарой.
3. Термодинамика изотермического процесса: T=const.
Приведем
закон, описывающий этот процесс, и его
график в координатах (P,V).

 - закон
Бойля-Мариотта Так как
T
= const,
то
- закон
Бойля-Мариотта Так как
T
= const,
то
 т. е. dU
= 0 - изменение
внутренней энергии газа при изотермическом
процессе равно нулю.
Тогда dQ
= dA
- Первое начало термодинамики при
изотермическом процессе. При
изотермическом процессе вся теплота,
сообщенная газу, идет на работу,
совершаемую газом: Q=A.
Выпишем работу, совершаемую газом при
изотермическом процессе. Используя
уравнение Менделеева-Клапейрона
представим
элементарную работу в виде:
т. е. dU
= 0 - изменение
внутренней энергии газа при изотермическом
процессе равно нулю.
Тогда dQ
= dA
- Первое начало термодинамики при
изотермическом процессе. При
изотермическом процессе вся теплота,
сообщенная газу, идет на работу,
совершаемую газом: Q=A.
Выпишем работу, совершаемую газом при
изотермическом процессе. Используя
уравнение Менделеева-Клапейрона
представим
элементарную работу в виде:
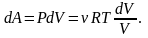 Тогда
Тогда
 .
работа, совершаемая газом при
изотермическом процессе
.
работа, совершаемая газом при
изотермическом процессе

 .
Учитывая то, что при изотермическом
процессе
.
Учитывая то, что при изотермическом
процессе
 работу можно вычислить также по формуле:
работу можно вычислить также по формуле:
 ;
;
На графике (P,V) работа, совершаемая газом, численно равна площади под кривой, описывающий изотермический процесс.
33.
