
- •1.Метод и законы термодинамики. Основные понятия и определения термодинамики.
- •2.Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа. Координаты р-V.
- •4. Потенциальная работа. Координаты р-V. Распределение работы.
- •5. Истинная и средняя теплоемкости веществ.
- •6.Смеси жидкостей, паров и газов, расчет характеристик смеси веществ.
- •7. Схемы смешения. Закон Дальтона.
- •8. Определение температуры смеси. Теплоемкость смеси.
- •9. Термодинамические условия фазовых переходов
- •10. Критические параметры чистого вещества и смесей газов.
- •11. Теория соответственных состояний. Коэффициент сжимаемости.
- •12. Постулат и математическое выражение 1 начала термодинамики.
- •13. Первое начало термодинамики в аналитическое форме.
- •14. 1 Начало термодинамики для идеального газа.
- •15. Принцип существования энтропии идеального газа.
- •1 6. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах p-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •17. Изобарный процесс изменения состояния идеального газа. Уравнение процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •18. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •19. Изохорный процесс изменения состояния идеального газа. Уравнения процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функции состояния.
- •20. Изопотенциальный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности.
- •32. Ду теплопроводности. Условия однозначности.
- •33. Теплопроводность через однослойные и многослойные плоские стенки.
- •34. Теплопроводность через однослойные и многослойные цилиндрические стенки.
- •35. Теплоотдача. Уравнение Ньютона. Коэффициент теплоотдачи.
- •36. Критериальные уравнения, физический смысл критериев подобия.
- •37. Последовательность расчетов конвективного теплообмена в в условиях свободной конвекции.
- •38. Последовательность расчетов конвективного теплообмена в условиях вынужденной конвекции.
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •41. Коэффициент лучистого теплообмена. Уравнение Ньютона-Рихмана.
- •42. Сложный теплообмен. Эффективный коэффициент теплопроводности.
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоские однослойные и многослойные стенки.
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •46,(47).Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи(Методы снижения теплового потока).
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс и уравнение теплопередачи теплообменного аппарата.
- •50. Средняя разность температур для сложных схем теплообмена.
- •51. Обобщенные уравнения теплопередачи при переменных температурах.
- •52. Последовательность расчета теплообменных аппаратов 1 рода.
- •53. Последовательность расчетов теплообменного аппарата 2 рода
- •54. Круговые процессы, кпд и холодильный коэффициент
- •55. Обратимый цикл Карно, прямой и обратный процесс. Теорема Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчетные соотношения. Истечение несжимаемой жидкости.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60. Переход через критическую скорость. Сопло Лаваля, определение геометрических размеров.
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация циклов тепловых двигателей:
- •65. Схема, рабочий процесс и тд цикл Брайтона. Кпд.
- •66. Схема, рабочий процесс и тд цикл Гемфри. Кпд.
- •67. Сопоставление тд циклов Брайтона и Гемфри по эффективности.
- •68. Схема, рабочий процесс и тд цикл Отто, кпд.
- •69. Схема, рабочий процесс и тд цикл Дизеля. Кпд
- •71. Сопоставление тд циклов двс по эффективности.
- •72. Схема, рабочий процесс и цикл паросиловой установки, цикл Ренкина, методы повышения кпд
- •73.Схема, рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74. Схема, рабочий процесс и цикл паросиловой установки с регенерацией.
- •75. Схема, рабочий процесс и цикл паровой компрессионной холодильной машины.
- •77,78. Рабочий процесс двухтактного(и четырехтактного) двигателя внутреннего сгорания.
- •79. Индикаторные и эффективные характеристики двигателей внутреннего сгорания.
13. Первое начало термодинамики в аналитическое форме.
Значения
удельных внутренней энергии и энтальпии
простого тела однозначно определяются
двумя независимыми переменными и могут
быть представлены следующим образом: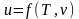 ;
; .
Изменения внутренней энергии и энтальпии
простого тела, как функций состояния,
в элементарных процессах являются
полными дифференциалами и определяются
соотношениями
.
Изменения внутренней энергии и энтальпии
простого тела, как функций состояния,
в элементарных процессах являются
полными дифференциалами и определяются
соотношениями
 ;
(1)
;
(1)
 .
(2)
.
(2)
Для
изохорного процесса ( )
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости:
)
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости:
 ,
,
а
для изобарного процесса (
)
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости:
 .
.
В
результате подстановки выражений (1) и
(2) в уравнение и разделения переменных получим:
и разделения переменных получим:
 .
.
Данное соотношение называется первым началом термодинамики для простых тел в аналитической форме.
14. 1 Начало термодинамики для идеального газа.
Идеальный
газ
– система, которая подчиняется уравнению
Менделеева-Клаперона:
 и внутренняя энергия системы зависит
только от температуры
и внутренняя энергия системы зависит
только от температуры
 .
.
Первое
начало термодинамики для простого тела:
 .
Для идеального газа:
.
Для идеального газа:
 ,
,
 ,
,
 ,
,
 .
Получим:
.
Получим:

Получили
закон Майера:
 .
.
Универсальная
газовая постоянная
 .
.
Разделим
первое начало термодинамики на
 :
:
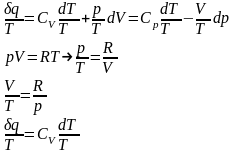
15. Принцип существования энтропии идеального газа.
Энтропия
 ,
,
 .
Удельная энтропия
.
Удельная энтропия
 ,
,


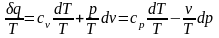 .
.
С
учетом того, что для идеального газа,
исходя из уравнения Клапейрона,
справедливы равенства:
 ;
;
 получим
получим
 .
.
Правая
часть уравнения (74) представляет собой
сумму полных дифференциалов. Это значит,
что и соотношение
 есть полный дифференциал некоторой
функции состояния идеального газа
(s),
называемой удельной энтропией.
есть полный дифференциал некоторой
функции состояния идеального газа
(s),
называемой удельной энтропией.
Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением
 .
(75)
.
(75)
Из уравнения (74) после интегрирования получим, что изменение удельной энтропии идеального газа в процессе (1-2) может быть найдено из соотношения
 =
=
 .
.
1 6. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах p-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
Изобарный
процесс
( )
– процесс в котором давление в системе
остается постоянным. В изобарных
процессах происходит увеличение или
уменьшение удельного объема, что связано
изменением температуры, обусловленным
подводом или отводом теплоты.
)
– процесс в котором давление в системе
остается постоянным. В изобарных
процессах происходит увеличение или
уменьшение удельного объема, что связано
изменением температуры, обусловленным
подводом или отводом теплоты.
Удельная
термодинамическая и потенциальная
работы в изобарном процессе определяются
из соотношений: ,
,
 .
.
Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе, определяется из выражения первого начала термодинамики
 .
.
 .
.


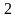
Так
как
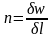 ,
то
,
то
 .
.
Первое начало термодинамики: .
Для
идеального газа:
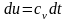 и
и

 .
.


