
- •1.Метод и законы термодинамики. Основные понятия и определения термодинамики.
- •2.Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа. Координаты р-V.
- •4. Потенциальная работа. Координаты р-V. Распределение работы.
- •5. Истинная и средняя теплоемкости веществ.
- •6.Смеси жидкостей, паров и газов, расчет характеристик смеси веществ.
- •7. Схемы смешения. Закон Дальтона.
- •8. Определение температуры смеси. Теплоемкость смеси.
- •9. Термодинамические условия фазовых переходов
- •10. Критические параметры чистого вещества и смесей газов.
- •11. Теория соответственных состояний. Коэффициент сжимаемости.
- •12. Постулат и математическое выражение 1 начала термодинамики.
- •13. Первое начало термодинамики в аналитическое форме.
- •14. 1 Начало термодинамики для идеального газа.
- •15. Принцип существования энтропии идеального газа.
- •1 6. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах p-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •17. Изобарный процесс изменения состояния идеального газа. Уравнение процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •18. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •19. Изохорный процесс изменения состояния идеального газа. Уравнения процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функции состояния.
- •20. Изопотенциальный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности.
- •32. Ду теплопроводности. Условия однозначности.
- •33. Теплопроводность через однослойные и многослойные плоские стенки.
- •34. Теплопроводность через однослойные и многослойные цилиндрические стенки.
- •35. Теплоотдача. Уравнение Ньютона. Коэффициент теплоотдачи.
- •36. Критериальные уравнения, физический смысл критериев подобия.
- •37. Последовательность расчетов конвективного теплообмена в в условиях свободной конвекции.
- •38. Последовательность расчетов конвективного теплообмена в условиях вынужденной конвекции.
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •41. Коэффициент лучистого теплообмена. Уравнение Ньютона-Рихмана.
- •42. Сложный теплообмен. Эффективный коэффициент теплопроводности.
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоские однослойные и многослойные стенки.
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •46,(47).Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи(Методы снижения теплового потока).
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс и уравнение теплопередачи теплообменного аппарата.
- •50. Средняя разность температур для сложных схем теплообмена.
- •51. Обобщенные уравнения теплопередачи при переменных температурах.
- •52. Последовательность расчета теплообменных аппаратов 1 рода.
- •53. Последовательность расчетов теплообменного аппарата 2 рода
- •54. Круговые процессы, кпд и холодильный коэффициент
- •55. Обратимый цикл Карно, прямой и обратный процесс. Теорема Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчетные соотношения. Истечение несжимаемой жидкости.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60. Переход через критическую скорость. Сопло Лаваля, определение геометрических размеров.
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация циклов тепловых двигателей:
- •65. Схема, рабочий процесс и тд цикл Брайтона. Кпд.
- •66. Схема, рабочий процесс и тд цикл Гемфри. Кпд.
- •67. Сопоставление тд циклов Брайтона и Гемфри по эффективности.
- •68. Схема, рабочий процесс и тд цикл Отто, кпд.
- •69. Схема, рабочий процесс и тд цикл Дизеля. Кпд
- •71. Сопоставление тд циклов двс по эффективности.
- •72. Схема, рабочий процесс и цикл паросиловой установки, цикл Ренкина, методы повышения кпд
- •73.Схема, рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74. Схема, рабочий процесс и цикл паросиловой установки с регенерацией.
- •75. Схема, рабочий процесс и цикл паровой компрессионной холодильной машины.
- •77,78. Рабочий процесс двухтактного(и четырехтактного) двигателя внутреннего сгорания.
- •79. Индикаторные и эффективные характеристики двигателей внутреннего сгорания.
10. Критические параметры чистого вещества и смесей газов.
Критические
параметры являются важнейшими
термодинамическими постоянными вещества.
Критическая температура
 –
это температура, при которой и выше
которой газ никаким сжатием не может
быть переведен в жидкое состояние.
Критическое давление
–
это температура, при которой и выше
которой газ никаким сжатием не может
быть переведен в жидкое состояние.
Критическое давление
 –
это такое давление, при котором и выше
которого жидкость невозможно перевести
в газообразное состояние никаким
изменением температуры.
–
это такое давление, при котором и выше
которого жидкость невозможно перевести
в газообразное состояние никаким
изменением температуры.
В закритической
области ( )
вещество может находиться только в
однофазном состоянии. Условным признаком
непрерывности однофазного состояния
вещества является возможность перехода
его из любого однофазного исходного
состояния в другое однофазное состояние
путем непрерывных изменений параметров
состояния, минуя фазовые энергетические
барьеры.
)
вещество может находиться только в
однофазном состоянии. Условным признаком
непрерывности однофазного состояния
вещества является возможность перехода
его из любого однофазного исходного
состояния в другое однофазное состояние
путем непрерывных изменений параметров
состояния, минуя фазовые энергетические
барьеры.
Идеальными газами называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
Уравнение состояния идеальных газов - уравнение Клапейрона:
для 1 кг газа
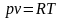 ;
для
;
для
 кг газа
кг газа
 ,
,
где
 – характеристическая постоянная газа;
Т
– абсолютная температура газа
– характеристическая постоянная газа;
Т
– абсолютная температура газа
Используя уравнение Авагадро уравнение Клапейрона можно привести к виду:
для 1
кмоля газа
 ;
для
;
для
 кмолей газа
кмолей газа

где
 (
Дж/кмоль К
) – универсальная
газовая
постоянная, не зависит от природы газов.
(
Дж/кмоль К
) – универсальная
газовая
постоянная, не зависит от природы газов.
Для
реальных газов
 ,
где
,
где
 - коэффициент сжимаемости.
- коэффициент сжимаемости.
Уравнение
Ван-дер-Ваальса:
 .
Коэффициент
.
Коэффициент
 учитывает взаимодействия между
молекулами, коэффициент
учитывает взаимодействия между
молекулами, коэффициент
 - объём молекул.
- объём молекул.
11. Теория соответственных состояний. Коэффициент сжимаемости.
В
инженерных расчетах часто пользуются
уравнением состояния идеального газа
с введением в него поправочного
коэффициента (z),
называемого коэффициентом
сжимаемости:
 .
Коэффициент
сжимаемости (z)
учитывает
различие между идеальным и реальными
газами (для идеального газа z
=
1).
Коэффициент сжимаемости является
функцией давления, температуры и зависит
от природы газа.
.
Коэффициент
сжимаемости (z)
учитывает
различие между идеальным и реальными
газами (для идеального газа z
=
1).
Коэффициент сжимаемости является
функцией давления, температуры и зависит
от природы газа.
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулированный Ван-дер-Ваальсом. Принцип «соответственных» состояний утверждает, что критическое состояние действительно является одинаковым для всех веществ.
В
критической точке для всех веществ r
=
0,
 ,
,
 ,
,
 .
Вещества находятся в соответственных
состояниях при одинаковом удалении от
критической точки.Степень удаления от
критической точки определяется с помощью
приведенных параметров: приведенного
давления
.
Вещества находятся в соответственных
состояниях при одинаковом удалении от
критической точки.Степень удаления от
критической точки определяется с помощью
приведенных параметров: приведенного
давления
 ;
приведенной температуры
;
приведенной температуры
 ;
приведенного объема
;
приведенного объема
 .
.
Уравнение
состояния, записанное в виде F
( )
= 0, называется приведенным
уравнением состояния.
Оно не содержит индивидуальных констант
вещества.
)
= 0, называется приведенным
уравнением состояния.
Оно не содержит индивидуальных констант
вещества.
Состояния
вещества, в которых они имеют одинаковые
 и
и
 называются соответственными.
называются соответственными.
12. Постулат и математическое выражение 1 начала термодинамики.
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Математическое выражение первого начала термодинамики:
Внутренняя
энергия изолированной системы сохраняет
своё постоянное значение при всех
изменениях, протекающих внутри системы,
то есть
 .
Изменение внутренней энергии
неизолированной системы складывается
из подведённой (отведённой) теплоты и
подведённой (отведённой) работы, то есть
.
Изменение внутренней энергии
неизолированной системы складывается
из подведённой (отведённой) теплоты и
подведённой (отведённой) работы, то есть
 .
.
Первое
начало термодинамики по
внешнему
балансу:
 ,
где
,
где
 - теплота внешнего теплообмена, то есть
количество теплоты, которая подводится
извне,
- эффективная работа, то есть
термодинамическая работа без учёта
работы эффективных потерь. Первое начало
термодинамики по внешнему балансу
справедливо для обратимых процессов.
- теплота внешнего теплообмена, то есть
количество теплоты, которая подводится
извне,
- эффективная работа, то есть
термодинамическая работа без учёта
работы эффективных потерь. Первое начало
термодинамики по внешнему балансу
справедливо для обратимых процессов.

В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
Работа необратимых
потерь
 ,
связанная с затратами энергии на
преодоление сил трения, удары, завихрения
превращается в теплоту внутреннего
теплообмена (
,
связанная с затратами энергии на
преодоление сил трения, удары, завихрения
превращается в теплоту внутреннего
теплообмена ( ).
).
 =
+
=
+
 .
.
Подставив значение
и
в
исходное уравнение, получим следующие
соотношения:
 ;
;
 .
.
Эти уравнения называются уравнениями первого начала термодинамики по балансу рабочего тела, и справедливы для реальных процессов.
В обратимых процессах = = 0 и уравнения первого начала термодинамики по внешнему балансу и балансу рабочего тела совпадают.
