
- •1.Метод и законы термодинамики. Основные понятия и определения термодинамики.
- •2.Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа. Координаты р-V.
- •4. Потенциальная работа. Координаты р-V. Распределение работы.
- •5. Истинная и средняя теплоемкости веществ.
- •6.Смеси жидкостей, паров и газов, расчет характеристик смеси веществ.
- •7. Схемы смешения. Закон Дальтона.
- •8. Определение температуры смеси. Теплоемкость смеси.
- •9. Термодинамические условия фазовых переходов
- •10. Критические параметры чистого вещества и смесей газов.
- •11. Теория соответственных состояний. Коэффициент сжимаемости.
- •12. Постулат и математическое выражение 1 начала термодинамики.
- •13. Первое начало термодинамики в аналитическое форме.
- •14. 1 Начало термодинамики для идеального газа.
- •15. Принцип существования энтропии идеального газа.
- •1 6. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах p-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •17. Изобарный процесс изменения состояния идеального газа. Уравнение процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •18. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •19. Изохорный процесс изменения состояния идеального газа. Уравнения процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функции состояния.
- •20. Изопотенциальный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности.
- •32. Ду теплопроводности. Условия однозначности.
- •33. Теплопроводность через однослойные и многослойные плоские стенки.
- •34. Теплопроводность через однослойные и многослойные цилиндрические стенки.
- •35. Теплоотдача. Уравнение Ньютона. Коэффициент теплоотдачи.
- •36. Критериальные уравнения, физический смысл критериев подобия.
- •37. Последовательность расчетов конвективного теплообмена в в условиях свободной конвекции.
- •38. Последовательность расчетов конвективного теплообмена в условиях вынужденной конвекции.
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •41. Коэффициент лучистого теплообмена. Уравнение Ньютона-Рихмана.
- •42. Сложный теплообмен. Эффективный коэффициент теплопроводности.
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоские однослойные и многослойные стенки.
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •46,(47).Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи(Методы снижения теплового потока).
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс и уравнение теплопередачи теплообменного аппарата.
- •50. Средняя разность температур для сложных схем теплообмена.
- •51. Обобщенные уравнения теплопередачи при переменных температурах.
- •52. Последовательность расчета теплообменных аппаратов 1 рода.
- •53. Последовательность расчетов теплообменного аппарата 2 рода
- •54. Круговые процессы, кпд и холодильный коэффициент
- •55. Обратимый цикл Карно, прямой и обратный процесс. Теорема Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчетные соотношения. Истечение несжимаемой жидкости.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60. Переход через критическую скорость. Сопло Лаваля, определение геометрических размеров.
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация циклов тепловых двигателей:
- •65. Схема, рабочий процесс и тд цикл Брайтона. Кпд.
- •66. Схема, рабочий процесс и тд цикл Гемфри. Кпд.
- •67. Сопоставление тд циклов Брайтона и Гемфри по эффективности.
- •68. Схема, рабочий процесс и тд цикл Отто, кпд.
- •69. Схема, рабочий процесс и тд цикл Дизеля. Кпд
- •71. Сопоставление тд циклов двс по эффективности.
- •72. Схема, рабочий процесс и цикл паросиловой установки, цикл Ренкина, методы повышения кпд
- •73.Схема, рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74. Схема, рабочий процесс и цикл паросиловой установки с регенерацией.
- •75. Схема, рабочий процесс и цикл паровой компрессионной холодильной машины.
- •77,78. Рабочий процесс двухтактного(и четырехтактного) двигателя внутреннего сгорания.
- •79. Индикаторные и эффективные характеристики двигателей внутреннего сгорания.
3.Термодинамическая работа. Координаты р-V.

Термодинамическая работа – работа, вызванная изменением объёма, .
Удельная элементарная
термодинамическая работа обратимого
изменения объема
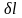 (Дж/кг)
определяется:
(Дж/кг)
определяется:
 .
(1.1)
.
(1.1)
Поскольку
термодинамическая работа зависит от
пути (вида) процесса, для вычисления
интегральных значений полной ( ),
или удельной (
),
или удельной ( )
работы должны быть заданы уравнения
процессов изменения состояния тела в
форме,
)
работы должны быть заданы уравнения
процессов изменения состояния тела в
форме,
 либо его графическое изображение в
диаграммах состояния р–V(v).
либо его графическое изображение в
диаграммах состояния р–V(v).
Работа определяется площадью под кривой процесса независимо от вида рабочего тела и его свойств . В силу этого координаты р–V и р–v называются универсальными координатами работы.
В частном случае
для изобарного процесса (p
= idem)
интегральные значения полной и удельной
термодинамической работы определяются
по следующим соотношениям L1,2
=
 =
=
 ;
l1,2
=
;
l1,2
=
 =
=
 .
.
Работа расширения
считается положительной ( ,
,
 ),
а работа сжатия – отрицательной (
),
а работа сжатия – отрицательной ( ).
).
4. Потенциальная работа. Координаты р-V. Распределение работы.
Потенциальная работа - работа по перемещению сплошных масс (газа, пара или жидкости) из области одного давления (p1) в область другого давления (p2).
Элементарная
потенциальная работа простого тела
определяется из соотношения
 .
.
Удельная потенциальная
работа в элементарном процессе
 определяется по формуле:
определяется по формуле: .
.
Для определения
интегральных значений полной ( )
или удельной (
)
или удельной ( )
работы надо знать уравнение процесса
изменения состояния рабочего тела
или его графическое изображение в
диаграммах состояния р–V
или р–v.
)
работы надо знать уравнение процесса
изменения состояния рабочего тела
или его графическое изображение в
диаграммах состояния р–V
или р–v.
Работа определяется в кооординатах р–V площадью независимо от вида рабочего тела и его свойств.

В частном случае
для изохорного процесса (v
= idem)
интегральные значения полной и удельной
потенциальной работы определяются по
следующим соотношениям:
 ;
;
 .
.
Потенциальная
работа (+) при снижении давления ( )
и (-) – (
)
и (-) – ( ).
).
Потенциальная
работа в обратимом процессе ( )
есть сумма эффективной работы
)
есть сумма эффективной работы
 и необратимых потерь работы
и необратимых потерь работы
 :
=
:
=
 +
.
+
.
Эффективная т/д
работа ( )
простого тела в замкнутом пространстве
и эффективная потенциальная работа (
)
потока передаются внешней системе (
)
простого тела в замкнутом пространстве
и эффективная потенциальная работа (
)
потока передаются внешней системе ( или
или
 )
и используются для изменения энергии
внешнего положения тела (dEcz):
=
+ dEcz;
=
+
dEcz
.
)
и используются для изменения энергии
внешнего положения тела (dEcz):
=
+ dEcz;
=
+
dEcz
.
В условиях механических процессов (dEcz=GcЕdcЕ+Ggdz) уравнение распределения термодинамической и потенциальной работ формулируется :
 ;
;
 ,
,
где cE – скорость движения тела, dz – изменение высоты центра тяжести тела в поле тяготения.
5. Истинная и средняя теплоемкости веществ.
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают
массовую теплоемкость
с,
измеряемую в Дж/(кгК),
молярную
 – Дж/(кмольК)
и объемную с'
–
Дж/(м3К).
– Дж/(кмольК)
и объемную с'
–
Дж/(м3К).
Связь между
массовой, молярной и объемной теплоемкостью
представлена следующими соотношениями:
 ;
;
 .
.
Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
 .
- Эта теплоемкость называется
истинной.
.
- Эта теплоемкость называется
истинной.
Экспериментальное определение теплоемкости проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv ) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
 .
.
 .
.
Средняя теплоемкость численно равна истинной теплоемкости при среднеарифметической температуре процесса.
