
- •1. Параметры и закономерности прямолинейного движения мт.
- •2. Криволинейное движение материальной точки.
- •3. Основные законы поступательного движения
- •4. Принципы суперпозиций и относительность движение мт.
- •1. Принцип относительности Галилея
- •5. Работа и энергия и их эквивалентность.
- •9. Колебательные движения материальной точки.
- •12. Законы сохранения в механике мт.
- •13. Условия равновесного состояния тел.
- •14. Параметры и основной закон вращательного движения.
- •15. Методика определения момента инерции тела (на примере точки). Теорема Штейнера.
- •16. Закон сохранения для вращательного движения.
- •17. Колебательное движение твердого тела, определение частоты колебаний.
- •18. Степени свободы механического движения системы тел. Закон равнораспределения энергии для газа.
- •21. Теплопроводность газа.
- •22. Внутреннее трение в газе
- •23. Диффузия в газе.
- •19. Максвелловское распределения молекул газа по скоростям.
- •24. Закон сохранения энергии для изотермического и адиабатического.
- •27. Термодинамические циклы, кпд тепловых машин.
- •25. Работа газа и его теплоемкость при изо- и адиабатных процессах.
- •26. Уравнение Пуасона, уравнение политропического процесса.
- •29. Молекулярно-кинетический смысл энтропии.
- •20. Больцмановское распределение молекул газа.
- •31. Уравнение состояния газа и его применение.
- •10. Явление резонанса при колебании мт.
20. Больцмановское распределение молекул газа.
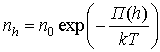
Где
![]() концентрация на уровне z=0.
Это
выражение является распределением
Больцмана,
характеризующим распределение
концентрации частиц в потенциальном
поле. Это выражение определяет
распределение частиц в потенциальном
поле при максвелловском распределении
этих частиц по скоростям.
концентрация на уровне z=0.
Это
выражение является распределением
Больцмана,
характеризующим распределение
концентрации частиц в потенциальном
поле. Это выражение определяет
распределение частиц в потенциальном
поле при максвелловском распределении
этих частиц по скоростям.
Из распределения Больцмана следует, что частицы с большей плотностью располагается там, где ниже их потенциальная энергия, а также там, где выше температура.
В поле силы тяжести П(h)=mgh, а p=nkT поэтому можем записать барометрическую формулу для распределения давления воздуха по высоте
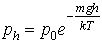 ,
(24)
,
(24)
где p0 – давление газа поверхности Земли.
Практическое подтверждение вытекающей из закона Больцмана барометрической формулы показывает, что максвелловское распределение частиц газа по скоростям является универсальным, т.е. пригодным для систем с наложенным и без наложенного силового поля, поскольку потенциальное поле сил не изменяет вид функции распределения Максвелла по любой из проекций скоростей частиц газа.
31. Уравнение состояния газа и его применение.
Реальный газ хорошо описывается уравнением Менделеева-Клапейрона:
![]()
где R – молярная газовая постоянная, n =m/M - количество вещества (M - молярная масса газа, m - масса газа). Но только при малых плотностях, т.е. при небольшом давлении и достаточно высоких температурах. С повышением давления и уменьшением температуры наблюдается значительное отступление от уравнения Менделеева – Клапейрона.
Самым простым и вместе с тем дающим хорошие результаты при описании газов в широком интервале плотностей, оказалось уравнение Ван-дер-Ваальса
 ,
,
где
p
– давление газа, Vm
– молярный объем; а
и
b
– постоянные Ван-дер-Ваальса, имеющие
для разных газов различные значения.
Поправка
![]() характеризует
ту добавку к внешнему давлению, которая
обусловлена взаимным притяжением
молекул друг к другу. Вследствие того,
что молекулы обладают конечным объемом,
пространство, доступное для движения
молекул, оказывается меньшим, чем объем
сосуда Vm.
Поправка b
характеризует ту часть объема, которая
недоступна для движения молекул.
Уравнение можно переписать для
произвольной массы m,
учитывая, что V
= nVm
характеризует
ту добавку к внешнему давлению, которая
обусловлена взаимным притяжением
молекул друг к другу. Вследствие того,
что молекулы обладают конечным объемом,
пространство, доступное для движения
молекул, оказывается меньшим, чем объем
сосуда Vm.
Поправка b
характеризует ту часть объема, которая
недоступна для движения молекул.
Уравнение можно переписать для
произвольной массы m,
учитывая, что V
= nVm
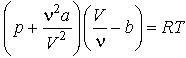 ,
,
где n =m/M – количество вещества. Записываем уравнение для n молей газа
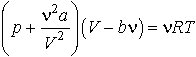 .
(5)
.
(5)
Реальные газы следуют уравнению Ван-дер-Ваальса лишь приближенно. Воображаемый газ, точно подчиняющийся уравнению (5), называется ван-дер-ваальсовским.
10. Явление резонанса при колебании мт.
Резонанс – явление резкого возрастания амплитуды вынужденных колебаний при приближении частоты вынуждающей силы к частоте равной или близкой собственной частоте колебательной системы.
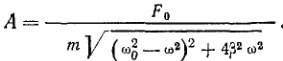
Амплитуда установившихся вынужденных колебаний прямо пропорциональна амплитуде вынуждающей силы F0 обратно пропорциональна массе т системы и уменьшается с увеличением коэффициента затухания β. При постоянных F0, т и β амплитуда зависит только от соотношения циклических частот вынуждающей силы w и свободных незатухающих колебаний системы w0. Рис. 8.19 позволяет определить сдвиг фаз φ0 между скоростью установившихся вынужденных колебаний и вынуждающей силой, а также сдвиг фаз α=φ0-π/2 между смещением и вынуждающей силой.

Арез=f0/2βw0
