
- •Диссертация
- •1. Введение
- •2. Литературный обзор.
- •2.1. Строение и свойства технического углерода.
- •2.1.1. Строение и механизм образования технического углерода [2,3].
- •Рентгеноструктурный анализ.
- •Электронная микроскопия.
- •2.1.2. Свойства технического углерода и методы их анализа [7]. Дисперсность
- •Пористость
- •Структурность.
- •2.1.3 Адсорбционные свойства. Методы исследования.
- •2.1.4. Метод комплексного анализа саж (метод ''КомпАс'').
- •2.1.5. Метод дериватографии [41].
- •2.2. Способы получения саж [7,42].
- •2.2.1 Получение печной сажи
- •2.2.2. Получение Канальной сажи [3].
- •2.2.3. Получение термической сажи [7].
- •2.2.4 Получение ацетиленовой сажи [7].
- •3. Экспериментальная часть
- •3.1. Постановка задачи исследования.
- •3.2. Характеристика объектов исследования.
- •3.3. Методика проведения исследования и описание лабораторной установки.
- •3.4. Полученные результаты и их обсуждение.
- •Однако следует заметить, что более интенсивное окисление наблюдается у печной сажи. Это закономерность подтверждается также при проведении опыта в изотермических условиях. (рис. 3.6)
- •4. Выводы.
- •Список литературы
3.3. Методика проведения исследования и описание лабораторной установки.
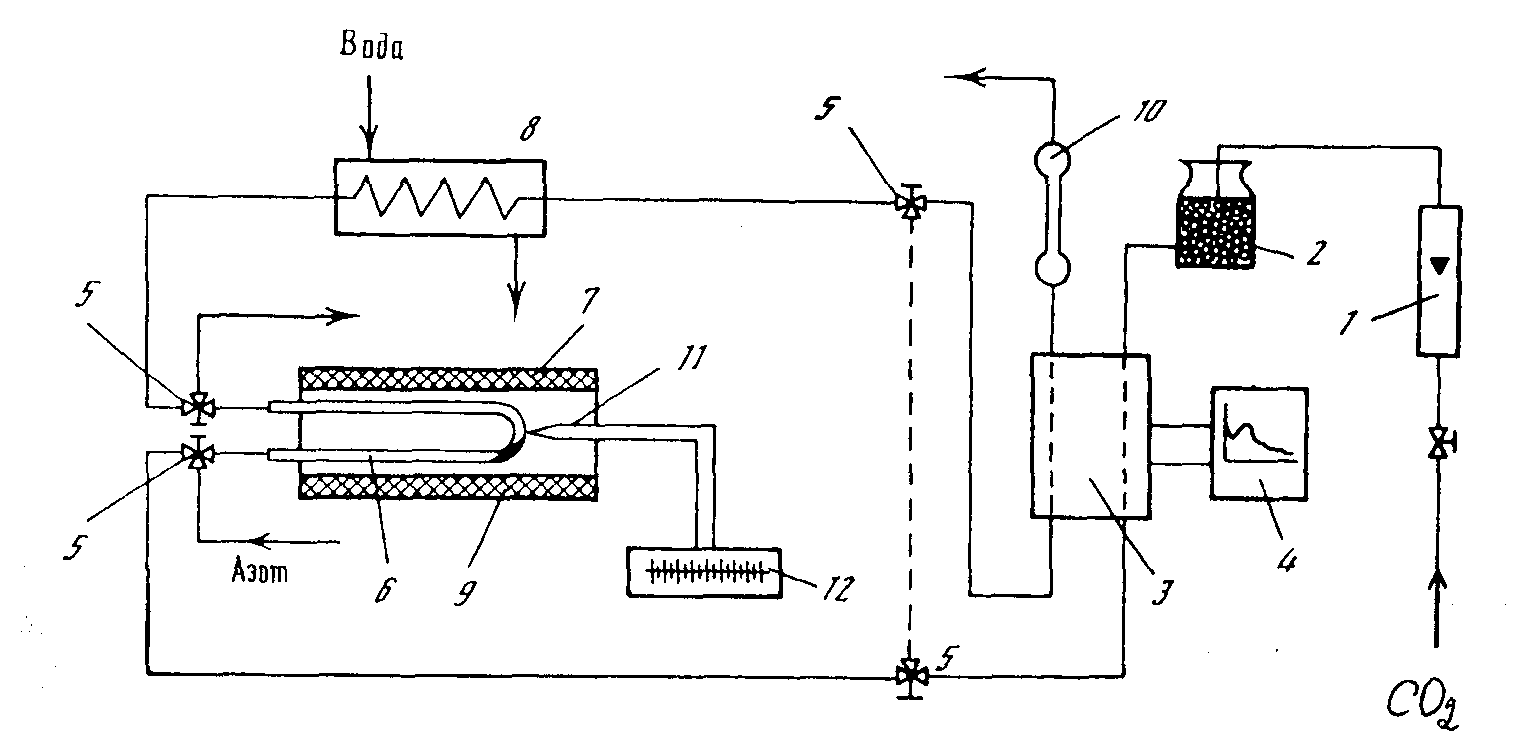
Рис.3.1. Схема установки для исследования саж методом КомпАС в непрерывном режиме: / -
ротаметр; 2 - склянка с КОН; 3 - детектор-катарометр; 4 - самописец; 5 - трехходовой
кран; 6 - кварцевая трубка; 7 - электропечь; 8 - холодильник; 9 - навеска сажи; 10 –
реометр; // - термопара; 12 - потенциометр
Установка для исследования саж в непрерывном режиме показана на рис.3.1
Образец сажи помещают в кварцевую трубку 6 и после первичного прокаливания для удаления с поверхности сажи адсорбированных газов, трубку подключают к газовому хроматографу таким образом, что вначале диоксид углерода поступает в сравнительную ячейку детектора-катарометра 3, затем в кварцевую трубку 6 с сажей 9, помещенную в электропечь 7, откуда газ через холодильник 8 поступает в рабочую ячейку детектора 3. При этом самописец 4 фиксирует кривую изменения количества выделяющегося оксида углерода.
Длительность исследования одного образца в непрерывном режиме составляет 1-3 ч в зависимости от дисперсности и плотности упаковки частиц в агрегатах сажи. Метод “КомпАС” требует применения точно такой калибровки, как и любой хроматографический метод определения удельной поверхности.
Образцы сажи исследовались в изотермических и неизотермических условиях.
Для эксперимента взвешивали образец сажи, равный 0,0517-0,0520 грамм и затем помещали в U- образную кварцевую трубку, диаметром d = 3-6 мм и высотой Н = 150-200 мм. Кварцевую трубку подключали к линии подачи диоксида углерода. В течение нескольких минут пропускали диоксид углерода через трубку для вытеснения из нее воздуха. Расход СО2, устанавливался с помощью пенного измерителя (30 мл/мин) и контролировался по показаниям жидкостного манометра. Для отображения характера развития процесса окисления применялся хроматограф с детектором по теплопроводности. Через одну из ячеек катарометра проходил диоксид углерода, который затем направлялся в трубку с образцом. Выходящий из трубки реакционный газ поступал во вторую ячейку. Масштаб показаний прибора и скорость движения ленты устанавливались исследователем. После вытеснения воздуха из трубки, когда регистратор хроматографа начинал показывать отсутствие рассогласования в ячейках, трубка с образцом помещалась в печь. Вращением ручки лабораторного автотрансформатора устанавливалось напряжение, пода ваемое на печь, и задавалась скорость ее нагрева. Температуру в реакторе фиксировали периодически.
Рис.3.2. Зависимость изменения температуры процесса от времени.

На рисунке ( 3.2 ) показано изменение температуры во времени при окислении исследуемых образцов дисперсного углерода.
 Рис.3.3.
Зависимость изменения высоты пика от
времени окисления
Рис.3.3.
Зависимость изменения высоты пика от
времени окисления
(неизотермический режим).
Рис 3.4. Зависимость изменения высоты пика от времени окисления
(изотермический режим).

Нами делалось допущение, что в результате взаимодействия технического углерода с диоксидом углерода выделяется только монооксид углерода. В результате образования СО менялась теплопроводность газовой смеси, что и фиксировалось катарометром хроматографа. (рис 3.3. неизотермический режим).
По окончании эксперимента были получены хроматограммы, представленные на рисунках. С помощью хроматограмм окисления можно определить характер развития процесса, количество образовавшегося монооксида углерода, скорость газификации материала, температуру, при которой процесс окисления начинает протекать с заметной скоростью.
Те же действия выполняются и для опыта в изотермических условиях ( рис 3.4. изотермический режим).
Следует отметить, что весь выделившийся СО численно равен количеству прореагировавшего технического углерода. По площади пика рассчитывали суммарное и на каждом участке количество прореагировавшего технического углерода, степень его окисления, а также скорость процесса.
Расчет количества выделившегося СО производился по формулам :
∑ Si пика = ∑ n (CO)
где S – площадь ( мм2), n –количество выделившегося СО моль
для прореагировавшего углерода с учетом реакции процесса:
C + CO2 = 2 CO
∑ Si пика = ∑ 2*n( C )
2 – коэффициент реакции
n(C)i= Si пика (моль)
Степень окисления рассчитывали по выражению :
( Si / S ∑ ) * 100 %
где Si – площадь пика на i – том участке.
Скорость процесса: (дифференциальная)
R = n( C ) / dt ( моль/мин)
Где dt- интервал времени, мин
