
- •1.Кинематическое описание движения (ф-лы для описания поступательного и вращательного движения).
- •2. Современная трактовка законов Ньютона. Законы Ньютона
- •3.Постулаты специальной теории относительности и геометрия пространства - времени .
- •4. Фундаментальные взаимодействия
- •5.Силы тяготения и электрические силы
- •6.Напряженность поля сил. Принцип суперпозиции силовых полей
- •7.Магнитные силы. Сила Лоренца.
- •8. Силы упругости. Деформации, их виды.
- •9. Закон Гука и модуль Юнга.
- •10.Силы трения. Виды трения. Трение покоя. Внутреннее трение
- •12. Работа и кинетическая энергия. Мощность
- •13. Теорема живых сил. Закон сохранения полной механической энергии
- •14.Момент инерции твердого тела. Момент импульса. Теорема Штейнера
- •15.Уравнение движения и условия равновесия твердого тела
- •16.Закон сохранения момента импульса Кинетическая энергия вращения
- •17. Формула Ньютона для сил внутреннего трения. Коэффициент вязкости.
- •18. Гармонические колебания
- •19. Свободные затухающие колебания.
- •20.Вынужденные колебания осциллятора под действием синусоидальной силы
- •21. Амплитуда и фаза при вынужденных колебаниях. Резонансные кривые.
- •27. Точечный источник волн. Плоская и сферическая волна.
- •28. Фазовая скорость волны. Длина волны, волновое число.
- •29. Когерентность. Длина когерентности
- •30. Интерференция плоских волн условия возникновения интерференционного максимума и минимума.
- •31. Интерференция в тонких плёнках. Просветление оптики.
- •32. Принцип Гюйгенса-Френеля
- •33. Дифракция на круглом отверстии
- •36. Дифракция Фраунгофера и спектральное разложение. Разрешающая способность и дисперсия дифракционной решетки.
- •Модель атома Бора
- •Модели атома Томсона и Резерфорда
- •39. Гипотеза ДеБройля, свойства волн ДеБройля
- •41. Гипотеза Борна, волновая функция
- •42. Принцип неразличимости микрочастиц. Бозоны и фермионы
- •43. Квантование атома водорода. Квантовые числа
- •44. Характеристики квантовых чисел. Правила отбора.
- •45. Энергетическая диаграмма водородоподобного атома.
- •46. Вырождение энергетических уровней. Эффекты Зеемана и Штарка.
- •47.Спектры двухатомных молекул. Переходы в молекулярных спектрах.
- •48. Спектры твердого тела. Энергетические зоны.
- •49. Энергетические зоны и проводимость твердых тел.
- •55.Закон поглощения радиоактивного излучения
- •56.Способы регистрации радиоактивного излучения. Счетчик Гейгера и Камера Вильсона
- •57.Диэлектрики в электростатическом поле. Поляризация диэлектриков
- •58.Диэлектрическая проницаемость и диэлектрическая восприимчивость.
- •59.Теорема Остроградского-Гаусса. Ее использование для расчета полей симметричных объектов.
- •60. Конденсаторы. Электроемкость. Емкость плоского конденсатора и уединенной сферы
- •61. Электростатические поля в проводнике. Распределение потенциала и заряда по поверхности проводника
- •71. Три вида магнетиков. Их особенности.
- •75.Индуктивность соленоида. Взаимоиндукция. Принцип работы трансформатора.
- •76.Уравнения Максвелла, их физический смысл.
- •77.Электромагнитные волны. Их свойства. Соотношения Максвелла
- •78.Макроскопическая (термодинамическая) система. Интенсивные и экстенсивные переменные
- •79.Метод молекулярной динамики. Основное уравнение молекулярно-кинетической теории.
- •80. Уравнение Ван-дер-Вальса. Изотермы Ван-дер-Вальса. Уравнение Ван-дер-Вальса. Для одного моля газа Для молей газа
- •81. Критическая изотерма, закон соответственных состояний
- •83. Первое начало термодинамики. Обоснование
- •83. Первое начало термодинамики для изопроцессов
- •84. Основы теории теплоемкости. Формула Майера
- •96. Электрический ток в газах. Самостоятельный и несамостоятельный разряд
- •Виды газовых разрядов и их применение
47.Спектры двухатомных молекул. Переходы в молекулярных спектрах.
Двухатомная молекула — молекула, составленная из двух атомов одного или разных элементов. Атомы связаны при помощи ковалентной связи.
Всего восемь элементов могут существовать в виде двухатомных молекул. Двухатомные молекулы образуют только газообразные при обычных условиях элементы (за исключением инертных газов). То же относится и ко многим другим элементам в парах при достаточно высоких температурах.
К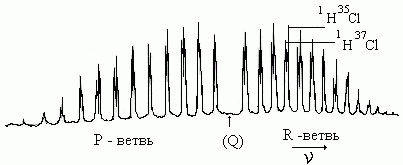 олебательно-вращательные
спектры двухатомных молекул лежат в
инфракрасной и видимой областях спектра
электромагнитных волн. Каждый
колебательный переход сопровождается
большим числом вращательных переходов,
которые при хорошей разрешающей
способности прибора имеют вид отдельных
близко лежащих линий.
олебательно-вращательные
спектры двухатомных молекул лежат в
инфракрасной и видимой областях спектра
электромагнитных волн. Каждый
колебательный переход сопровождается
большим числом вращательных переходов,
которые при хорошей разрешающей
способности прибора имеют вид отдельных
близко лежащих линий.
Рассмотрим наиболее вероятные переходы с колебательного квантового уровня v1=0 на уровень v2=1. Изменение энергии вращения подчиняется правилам отбора: ∆j=±1. Учитывая, что Евр.кол=Екол+Евр, частоту перехода (волновое число) можно представить в виде суммы ω=ωкол+ωвр: ω=(Е2.вр.кол–Е1.вр.кол)/hc=( Е2.кол –Е1.кол)/hc+2 Ве'j'(j'+1)-2 Ве" j"(j"+1)
У молекулы в виде жесткой сферы R=const и I=const , поэтому Ве'= Ве"=Ве. Для такой молекулы ω=ωе(1-2хе)+2 Вe j' (j'+1) - 2 Bej"(j"+1)
В результате перехода молекулы с уровня v=0 на уровень v=1 получается совокупность линий, соответствующих разным значениям ∆j. При ∆j=+1 возникает R-ветвь, а при ∆j= -1 имеем Р-ветвь. Волновые числа этих ветвей: ωR=ωе (1-2хе,)+2Be(j"+1), ωР=ωе (1-2хе)+2Bej". (1.4.4)
Вращательные линии в R-ветви соответствует переходам с j"=n на j'=n+1 при n=0,1 2,3…, а вращательные линии в Р-ветви – с j"=n на j'=n-1 при n=1, 2, 3…. Выражение для волнового числа первой линии в R-ветви (j"=0) имеет вид ωR=ωе(1-2хе)+2Be, выражение для второй линии - ωR=ωе(1-2хе)+4Be и т.д. Выражение для волнового числа первой линии в Р-ветви (j"=1) имеет вид ωР=ωе(1-2хе)-2Be; выражение для второй линии-ωR=ωе(1-2хе)-4Be и т.д. Спектральная линия, соответствующая основной частоте ω=ωе(1-2хе), в спектре не проявляется; между R- и Р- ветвями возникает «нулевой промежуток» в 4Ве, а разность между двумя соседними линиями для модели жесткой сферы в R- и Р-ветвях, равна 2 Be, т.е ∆ωR,Р=2Ве=h/4π2Iс.
Спектр поглощения жесткого ротатора состоит из равноудаленных друг от друга линий.
48. Спектры твердого тела. Энергетические зоны.
Раскаленные твердые тела дают сплошной спектр. Он содержит все спектральные цвета, непрерывно переходящие один в другой. Накаленные газы дают линейчатый спектр. Число и расположение линий характерно для каждого данного вещества. По расположению спектральных линий можно судить о наличии данного вещества даже в удаленных телам, например в звездах.
Исходящие из накаленных твердых тел или газов лучи образуют спектры испускания (эмиссионные). Если пропустить лучи, исходящие от раскаленного твердого тела, через раскаленные пары, то на непрерывном спектре на местах линий, которые присущи спектру испускания данного пара, появляются черные полосы: спектр поглощения.
Линии Фраунгофера в солнечном спектре позволяют судить о парах, которые окружают ядро Солнца.
Обращенные линии натрия. В непрерывном спектре электрической дуги часто можно видеть желтую двойную линию натрия. Она появляется благодаря присутствию в дуге раскаленных паров натрия. Если такой свет пропустить через более холодные пары натрия, то на месте, где была видна линия натрия, появляется темная полоса. Пары натрия поглотили то излучение, которое они сами и излучают.
Закон Кирхгова и Бузена. Светящиеся газы поглощают такие же лучи, которые сами испускают.
Энергетические зоны - совокупность возможных значений энергии валентных электронов в кристаллах. Энергетические зоны: - состоят из большого, но конечного числа очень близких уровней энергии; - разделены интервалами запрещенных значений энергии электронов (запрещенными зонами).
