
- •Предисловие
- •Введение
- •Глава I развитие гидрогеологии и инженерной геологии
- •Глава II вода в атмосфере и на поверхности земли
- •Влажность воздуха
- •Температура воздуха
- •Атмосферные осадки
- •Испарение
- •Инфильтрация
- •Глава III вода в земной коре состояние воды в земной коре, понятие о подземных водах
- •Теории происхождения и формирования подземных вод
- •Глава IV физико-механические и водные свойства пород температурные зоны в земной коре
- •Механический (гранулометрический) состав горных пород
- •Виды воды в горных породах
- •Водные свойства горных пород
- •Механические свойства горных пород
- •Глава V
- •Классификация подземных вод
- •Верховодка
- •Грунтовые воды
- •Артезианские воды
- •Трещинные и карстовые воды
- •Подземные воды в районах многолетней мерзлоты
- •Минеральные воды
- •Режим подземных вод
- •Влияние леса и болот на режим подземных вод
- •Глава VI
- •Физические свойства подземных вод
- •Химический состав подземных вод
- •Химический анализ воды; отбор проб для анализа
- •Формы выражения химического анализа воды
- •Химическая характеристика и классификации подземных вод
- •Глава VII
- •Основные законы движения подземных вод
- •Расходы потока подземных вод и построение кривой депрессии
- •Приток воды к водозаборным сооружениям
- •Движение подземных вод в трещиноватых породах
- •Определение водопритока в карьеры
- •Глава VII!
- •Гидрогеологические наблюдения при разведочных работах
- •Определение водопроницаемости горных пород
- •Определение скорости движения подземных вод
- •Глава IX обводненность месторождений
- •Классификация месторождений полезных ископаемых по гидрогеологическим условиям и степени обводненности
- •9 Богомолов г. В. 257
- •Глава XI
- •Глава XII
- •Водоснабжение
- •Оценка запасов подземных вод и их охрана
- •Искусственное восполнение запасов подземных вод
- •Орошение
- •Осушение
- •Глава XIII
- •Глава VIII. Гидрогеологические исследования 227
- •Глава IX. Обводненность месторождений полезных ископаемых и борьба
- •Глава XI. Главнейшие физико-геологические явления, связанные с деятель ностью поверхностных и подземных вод 267
- •Глава XII. Инженерно-геологические и гидрогеологические исследования
- •Глава XIII. Применение геофизических методов при гидрогеологических и
Химическая характеристика и классификации подземных вод
Существуют различные классификации подземных вод. Так, О. А. Алекин в основу своей классификации природных вод положил содержание, выраженное в миллиграмм-эквивалентах шести главных ионов. По преобладающему аниону он делит воды на три больших класса: гидрокарбонатные и карбонатные (НСОз~+ + СО32~), сульфатные (SO42~) и хлоридные (С1~). К первому классу относятся маломинерализованные воды рек, пресных озер, значительное количество подземных вод и немногие озера с повышенной минерализацией (с содержанием в воде иона СО32~). К классу хлоридных вод автор относит минерализованные воды морей, лиманов, реликтовых и материковых озер, подземные воды солончаковых районов, пустынь и полупустынь. Сульфатные воды по минерализации и распространению занимают промежуточное положение между гидрокарбонатными и хлоридными классами.
Классы делятся на четыре типа.
Первый тип характеризуется соотношением НСОз~>Са2++ + Mg2+. Воды слабоминерализованные. В них количество ионов НСОГболее суммы ионов щелочно-земельных металлов. Для второго типа характерно соотношение HCO3~<Ca2++Mg2+<HCO3~+ + SC>4~- К нему относятся подземные воды, а также воды рек, озер малой и средней минерализации. Третьему типу вод соответствует соотношение HCO3~+SO42~<Ca2++Mg2+. Воды сильноминерализованные, смешанные и метаморфизованные. К ним относятся воды океанов, морей, лиманов, реликтовых водоемов. Четвертый тип характеризуется отсутствием ионов HCOJT- Воды кислые. Они входят в сульфатный и хлоридный классы, в группу Са2+ + +Mg2+. Это рудничные и нефтяные воды, обогащенные включением рассеянного пирита.
Для подземных вод нефтяных и газовых месторождений в СССР применяется классификация В. А. Сулина (1946, 1948), по которой они разделяются на четыре типа, включающие в себя 'группы, классы и подгруппы (табл. 12). Для первых двух типов воды (сульфатно-натриевый и гидрокарбонатно-натриевый) соотноше-
Na . Na — Cl . , Na — Cl ., „ ние = 1 и соответственно р> 1 и <_!. Это ха-
ТАБЛИЦА 12
№ пп |
Тип воды |
Отношение процент-эквивалентов |
г |
Сульфатно-натриевый |
(rNa+— /-C1-) : /-SC>4~<1 |
II III |
Гидрокарбонатно-натриевый . ... Хлормагниевый |
(rNa+— rCI-) : rSO|~>l (/•Cl--rNa+):rMg2+<l |
IV |
Хлоркальциевый |
(/•Cl--rNa+):rMg2+>l |
|
|
|
185
растеризует континентальную обстановку формирования вод. Для третьего и четвертого типов (хлормагниевый и хлоркальциевый)
Na . , Cl—Na .... С1 — Na ^ ,
соотношение <С 1 и соответственно <С1 и >!•
С1 ^ Mg Mg
Оно свидетельствует о морском и глубинном происхождении вод. По В. А. Сулину, рассчитываются также следующие дополни-
, . .ч , SO4 SOi
тельные коэффициенты: 1) сульфатность —-— или ;
Cl CI -f- SO4
Са
2) коэффициент , по которому воду относят к кальциевой или
Mg
0. , , С1
магниевой группе; 3) коэффициент , по которому отличают
Вг
соленые воды, формирующиеся за счет выщелачивания глубоких
С1 вод; по А. П. Виноградову, при = 300 —воды соленые, про-
С1
изводные нормальной морской воды, при <^300 —глубокие
Вг
воды, производные остаточной рапы морских озер и при
^>300 —воды выщелачивания солей; 4) коэффициент
Вг • I
{по Б. А. Бедеру); для нефтяных вод он не превышает 30, для других вод он не менее 85.
Недостатком классификации В. А. Сулина является отсутствие обоснованности генетических коэффициентов, определяющих выделенные им типы вод, переходных и смешанных групп и подгрупп вод, встречающихся в природе.
Для подземных вод нефтяных и газовых месторождений характерно повышенное содержание иода, брома, бора, аммония и вблизи нефтяной залежи нафтеновых кислот. По химическому составу это обычно хлоридно-кальциево-натриевые рассолы с общей минерализацией 50 г/л и выше. В районе нефтяных месторождении встречаются кислые и щелочные воды гидрокарбонатно-натриево-го и иногда х-лоридно-сульфатно-натриевого состава.
Для оценки типа вод и степени водообмена и абсолютного возраста воды А. Л. Козлов рекомендует следующие две формулы, учитывающие коэффициенты растворимости гелия и аргона в воде:
Г=—— 25-Ю6 лет при свободно выделяющихся газах А
Т = — 115-106 лет при растворенных газах.
А
М. Г. Валяшко (1971) природную воду рассматривает как равновесную систему, состоящую из девяти солей угольной, серной и соляной кислот: Ма2СОз, MgCOa, СаСОз; Na2SO4, MgSC>4, CaSC^; NaCl, MgCl2, СаС12. Из них СаСОз, MgCO3 и CaSO4 обладают низкой растворимостью.
По А. П. Виноградову, вода в верхние слои Земли поступает в виде водного раствора (ювенильного), состоящего из ряда компо-
186
нентов, лз глубоких недр в результате дегазации мантии. В дальнейшем раствор, взаимодействуя с различными породами, приобретает свойства, характерные для вод суши.
В США для вод нефтяных месторождений пользуются классификацией Пальмера. Она основана на объединении ионов, сходных по химическим свойствам. Пальмер делит катионы на три группы (сильные основания, слабые основания и тяжелые металлы), а анионы на две (сильные кислоты, слабые кислоты), в соответствии с чем вода может иметь три степени солености и три степени щелочности. В зависимости от сочетания перечисленных групп ионов он выделяет пять классов природных вод. Классификация Пальмера имеет существенные недостатки: она объединяет в одну группу компоненты, имеющие различную геохимическую природу; не учитывает температуру воды, газовый состав и общую минерализацию. В настоящее время эта классификация в СССР не применяется.
Для характеристики типа воды и выражения химического состава подземных вод в СССР широко применяется формула М. Г. Курлова. В числителе формулы представлены анионы в процент-эквивалентах в убывающем порядке их содержания, а в знаменателе — в таком же порядке катионы. Если ионов менее 10% экв, в формуле они не указываются. Слева от дроби указывается общая минерализация и специфические компоненты, справа — температура воды и дебит:
рМ анионы Т, В, (VI-1)
катионы
где р — специфический элемент, содержащийся в воде, в г; М — общая минерализация в г/л; Т — температура воды в °С; D — дебит в л/с. Анионы и катионы обозначаются химическими символами. Для примера приводим формулу химического состава воды доломитного нарзана в Кисловодске по Курлову:
![]()
2
COl,9/Kl3,9
Содержание кремнезема в доломитовом нарзане колеблется в пределах 10 — 12 мг/л, рН 6,1 — 6,4, дебит 30000 л/с. В некоторых минеральных источниках Чехословакии кремнезема более 100 мг/л.
В ряде районов северо-западного Казахстана, а также на некоторых угольных месторождениях СССР, Канады, Франции встречаются кислые воды за счет окисления рассеянного пирита в породах. В саргаевско-евлановском водоносном комплексе девонских отложений Припятской впадины подземные воды также имеют повышенную кислотность (рН от 3,5 до 6,5).
В условиях восстановительной среды и присутствия метана развивается процесс десульфуризации, ведущий к восстановлению сульфатов и образованию щелочных вод гидрокарбонатно-натрие-
187
вого типа. Реакция
протекает следующим образом:![]()
В составе подземных вод и особенно глубоких водоносных горизонтов отмечаются не только такие широко распространенные компоненты, как Na, К, Са, Mg, Cl, Br, SO^, НСОз, составляющие свыше 90% их солевой массы, но и редкие и рассеянные элементы Sr, Li, Ni, Mn, Zn, Co, Cu, As, W, Mo, Sn, F и другие, находящиеся в подземных водах в повышенных концентрациях.
_О£ша.я__минерализация_в^эд_^орей и океанов не превышает 35— 40 г/л воды, вТтодзёмных водах~гл"убоких горизонтов она в десять раз больше — до 350 г/л и более. По данным В. И. Вернадского (1934) и А. П. Виноградова (1936), процентные соотношения между главнейшими компонентами в сухом остатке подземных рассолов и вод морских бассейнов весьма близки: хлор составляет 55%, натрий — 30, магний — 4, кальций — свыше 1, калий порядка 1% и т. д. В связи с этим исследователи многих стран все чаще обращаются к геохимии подземных вод для выяснения миграции и концентрации отдельных элементов. В настоящее время гидрохимические, радиологические и бактериологические методы используются как поисковые критерии для различных полезных ископаемых. Исследованиями советских ученых установлена прочная связь I, Sr, Ni и других микроэлементов с органическим веществом. Повышенное содержание Ni, Al, Zn, Sn и других металлов в воде характерно для кислой среды с концентрацией водородных ионов от 4,0 до 6,5. В подземных водах встречается также Си. Наиболее высокое ее содержание установлено в водах Коунрада (1,5) и других районов, к которым приурочены месторождения меди. Высокое содержание Мп (2,7%) наблюдается в подземных водах районов мар-.ганцевых месторождений. Mo, Bi, Co, Zn, Pb, As и другие элементы обнаружены в подземных водах полиметаллических месторождений. рН таких вод колеблется от 2,9 до 7,7. Щелочные воды с рН выше 8,0 в таких районах не встречены. Медь, извлекаемая в настоящее время из рудничных вод в отдельных странах, фиксируется только в кислых водах (рН-5,3). Исследования последних-лет в районах Южного Урала, Средней Азии, Забайкалья, Тувы и Дальнего Востока установили в подземных водах зоны окисления наличие ряда редких компонентов.
В зоне с замедленной циркуляцией подземных вод распространены сульфатные воды с общей минерализацией до 6 г/л. Они приурочены к переходной зоне (от окислительной к восстановительной среде) и имеют различную мощность. В районах повышенного залегания кристаллического фундамента она едва достигает 25— 400 м, в мульдах увеличивается до нескольких сот метров. В зоне распространения этих вод преобладают известково-глинисто-мер-гелистые породы, обогащенные гипсом. В водах резко преобладает сульфатный анион, меньше углекислоты и еще меньше хлора. Из
188
элементов, весьма распространенных в этих водах, можно отметить Sr, Cu, Ti, Al, Fe. Дозы их колеблются от 0,0001 до 0,001%. В породах и водах переходной зоны, как правило, отмечается низкое содержание органического вещестца.
В зоне с затрудненным водообменом содержатся высокоминерализованные хлоркальциевые воды. Минерализация их изменяется от нескольких десятков (в верхней зоне) до нескольких сот граммов на литр (в нижней). Они широко распространены в пределах Русской и Сибирской платформенных структур. Минерализация вод зависит не только от литологического состава пород, но и от активности водообмена. Так, в Брестской впадине, где отложения нижнего палеозоя хорошо промыты, она на глубине до 2000 м не превышает 10—12 г/л, в Припятской впадине на тех же глубинах минерализация достигает 250—300 г/л и более.
По данным Н. Д. Шустефа (1948), вода, выделенная из нефти, имеет большую плотность и минерализацию, чем пластовая вода.
Химизм подземных вод терригенной толщи девонских отложений юго-востока Татарской АССР характеризуется общей мине-р<1лизацией от 212 (в Нагорном)'до 235 г/л (в Бавлы) при плотности воды от 1,168 до 1,189. Концентрация водородных ионов изменяется от 4,0 до 5,81 (воды кислые). Содержание хлора колеблется от 132 до 137 г/л при величине сульфатов от 0,04 до 0,08, кальция — от 16,7 до 23,4 г/л и суммы натрия и калия — от 55,2 до 61,5 г/л.
Наличие редких и рассеянных элементов в водах отмечается в ряде районов СССР, Чехословакии, ГДР, Индии, Канады, Швеции, Норвегии, Финляндии и др. При большой мощности пород, насыщенных рассолами, и колоссальной площади их распространения запасы редких и рассеянных элементов в недрах значительные.
Судя по опубликованным в зарубежной литературе данным, в последние годы большое количество лития, например, добывается из рассолов подземных вод и озер.
ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К КАЧЕСТВУ ВОДЫ
Требования к качеству воды, предъявляемые различными отраслями народного хозяйства, не одинаковы. Так, воды, пригодные для питья, не всегда пригодны для технических целей, и наоборот. Для оценки пригодности подземных вод для тех или иных целей существуют определенные нормы. Однако нередко приходится считаться с гидрогеологическими особенностями отдельных районов и в случае отсутствия более подходящих водных источников отступать от установленных норм при условии, что вода не загрязнена органическими веществами.
Принято считать, что в воде, предназначенной для питьевых целей, может быть допущено следующее содержание основных химических компонентов (ГОСТ 2761—44, 2874—54).
Запах и привкус при 20° не более 2 баллов.
Сухой остаток не должен превышать 1000 иг/л.
Общая жесткость не более 7 мг-экв (в исключительных слу чаях до 14 мг-экв).
Содержание Ы2Об— до 20 мг/л.
Содержание МСЬ — следы.
Содержание NO3 — до 10 мг/л.
Содержание NH4 — следы.
Содержание С1 — не более 25—50 мг/л.
Содержание SO42~ — не более 100 мг//л.
Содержание окисного и закисного железа Fe2+ — Fe3+ — до 0,3 мг/л.
Суммарное содержание Fe и Мп — не более 0,5—1,0 мг/л.
Окисляемость: по СЬ до 2,5—3 мг/л.
по КМпСч — до 10,0 мг/л.
Содержание РЬ — не более 0,1 мг/л.
Содержание As — не более 0,05 мг/л.
Содержание F — не более 1,5 мг/л.
Содержание Си — не более 3,0 мг/л.
Содержание Zn — не более 5 мг/л.
Не должно быть Hg, шестивалентного С1, Ва и других ядо витых веществ.
Присутствие H2S — недопустимо.
рН —от 6,5 до 9,5.
Титр кишечной палочки должен быть не ниже 100.
Коли-тест должен быть не более 3 (3 палочки в 1 л воды).
В засушливых районах могут использоваться воды с сухим остатком до 2500—3000 мг/л, с содержанием иона С1 до 400—• 800 мг/л, иона SCu до 1000—1500, общей жесткости до 21 — 40 мг/экв.
При оценке подземных вод, используемых для технических целей (для питания паровых котлов, охлаждения двигателей, текстильной и бумажной промышленности, прачечных и бань), необходимо обращать особое внимание на жесткость воды. Жесткостью называют свойство воды, обусловленное содержанием в ней солей кальция и магния — Са(НСО3)2, Mg(HCOs)2, CaSO-j, СаСОз, СаС12, MgCl2.
Жесткая вода плохо взмыливается, дает накипь в паровых котлах, самоварах и чайниках, в жесткой воде медленно разваривается мясо и овощи и т. д.
Различают жесткость общую, обусловленную присутствием всех солей Са и Mg; постоянную — присутствуют все соли Са и Mg, за исключением бикарбонатов; временную, зависящую от бикарбонатов Са и Mg.
Определив общую и постоянную жесткость, можно по их разности определить и постоянную. Временной жесткость называется потому, что при кипячении воды бикарбонаты Са и Mg переходят в карбонатные соединения и выпадают в осадок. Кипяченая вода имеет только постоянную жесткость.
190
В настоящее время жесткость воды выражается в миллиграмм-эквивалентах. 1 мг-экв жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
По данным химического анализа жесткость воды может быть определена по формуле
![]()
где Н — жесткость воды в град; а — содержание СаО в мг/л; б — содержание MgO в мг/л.
О. А. Алекин природные воды по жесткости Подразделяет на несколько типов:
Град Тип (франц) мг • же
Очень мягкие ........ * 0 — 4,2 1,5
Мягкие .......... 4,2—8,4 1,5—3,0
Умеренно жесткие ...... 8,5 — 16,8 3—6
Жесткие ......... 16,8—25,2 6—9
Очень жесткие ...... >25,2 >9
В некоторых отраслях промышленности жесткие воды предварительно подвергают химической обработке, смягчают. Чаще всего для этого применяют содово-известковый способ. Смягчающим реагентом служит гашеная известь Са(ОН)2 и безводная сода Na2CO3. Действие гашеной извести заключается в том, что она переводит в нерастворимое состояние бикарбонаты Са и Mg и связывает свободную углекислоту. Безводная сода взаимодействует с сульфатами Са и Mg, переводя их в нерастворимые карбонаты.
Определение пригодности воды для паровых котлов основано па выяснении следующих явлений: накипеобразования, вспенивания и коррозии стенок котла.
Накипь на стенках паровых котлов образуется вследствие осаждения из воды А12О3, Fe2O3, Mg(OH)2, СаО, СаСО3, CaSO4, CaSiOs, MgSiOs. Слой накипи вследствие малой теплопроводности понижает коэффициент полезного действия котла, может привести к его перегреву, прогару металла и вызвать взрыв. Расход топлива по мер-е образования накипи увеличивается примерно на 1,5 — 2% на каждый миллиметр накипи. Накипеобразование оценивают количественно и качественно. Количественную оценку производят по общей массе котельных осадков Я0 и коэффициенту накипеобразования /Сн, выражающему отношение массы твердого камня Ян к общей массе котельных осадков Я0:
![]()
В зависимости от величины общей массы котельных осадков Я0 различают воды с очень малым осадком (Я0<125), с малым осадком (250>Я0>125), с большим осадком (500>Я0>250), с очень большим осадком (Я0>500).
По величине коэффициента накипеобразования Ks выделяют воды с мягким осадком (/Сн<0,25), с средним осадком (0,5>^СН> >0,25), с твердым осадком (/Сн>0,5).
191
Вспениванием называют процесс образования устойчивой пены на поверхности воды при кипении. Это явление сопровождается «бросанием» воды и сильным колебанием ее уровня, что создает неравномерность, порывистость процесса парообразования и вообще неспокойный характер работы парового котла. Считают, что причина вспенивания — образование на поверхности воды пленки с повышенной концентрацией хорошо растворимых солей натрия и калия.
Коррозия — разъедание стенок котла. В целях предупреждения коррозии в воде для паровых котлов должно быть N2Os<50 мг/л; С1<200мг/л, органических веществ <30 мг/л, CaSO4 и S1O2 — незначительное количество, растворенного С>2<5 мг/л. Сухого остатка воды — не >300 мг/л; недопустимо наличие агрессивной углекислоты, сероводорода; реакция воды должна быть щелочной.
Жесткость воды при применении в легко очищаемых котлах допускается менее 8° фран., в трудно очищаемых — менее 5°.
Коррозирующее действие грунтовых вод должно учитываться не только при использовании их в паровых котлах. Вследствие коррозии с течением времени разрушаются железные обсадные трубы буровых скважин, металлические части насосов, паровых турбин, сетки фильтров и т. д.
Очень высокой коррозионной способностью обладают сероводородные и углекислые воды, поэтому для каптажа углекислых вод обычно применяют чугунные трубы, а сероводородных—асбоцементные, из различных пластмасс, нержавеющей стали.
Грунтовые воды могут оказаться агрессивными по отношению к бетону (не только каптажных сооружений, но и вообще всяких бетонных сооружений, постоянно или временно находящихся ниже уровня воды). Агрессивное действие воды проявляется в разрушении бетона вследствие кристаллизации в нем новых соединений, сопровождающейся увеличением объема и выщелачиванием из бетона некоторых его составных частей, в той или иной мере растворимых в воде, и, в частности, карбоната кальция.
Растворяющая способность воды по отношению к СаС03 определяется прежде всего содержанием в ней агрессивной углекислоты. Обычно в природных водах присутствуют одновременно свободная углекислота и ионы НСОз~. Ионы СОз2~ при наличии свободной углекислоты не могут находиться в заметных количествах, так как они реагируют с углекислотой, образуя ионы НСО3~:
![]()
Углекислота в виде иона СО32~ называется связной, а в виде иона НСОз~ — полусвязной. Одна часть свободной углекислоты, содержащейся в воде, идет на растворение углекислого кальция, а другая, называемая равновесной углекислотой, остается в растворе и удерживает в растворе бикарбонат кальция. Количество рав-
192
новесной углекислоты определяется по уравнению
![]()
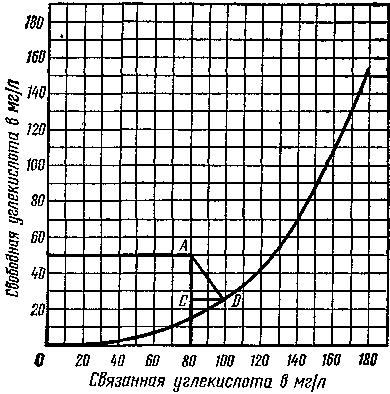
Если в воде имеется избыток свободной углекислоты по сравнению с равновесной, то при соприкосновении ее с СаСО3 происходит указанная выше реакция. Та часть свободной углекислоты, которая вступает в реакцию с СаСО3 и переводит его в раствор, и называется агрессивной углекислотой.
Рис. 81. График Лаптева для определения агрессивной углекислоты
Содержание в воде агрессивной углекислоты можно определить по графику Ф. Ф. Лаптева (рис. 81), который построен на основании определения свободной и связной углекислот. На график, по данным анализа, наносят точку А, ордината и аб-с-цисса которой соответствуют содержанию свободной и связной углекислот в исследуемой воде. Если эта точка оказывается на кривой или ниже ее, значит агрессивной углекислоты в воде нет, если выше кривой — агрессивная углекислота имеется. Для определения ее количества надо из точки А провести линию AD под углом 45° и построить на ней прямоугольн-ый треугольник ACD. Катет CD этого треугольника соответствует искомому количеству агрессивной углекислоты.
В природных водах могут находиться радиоактивные элементы. По количеству эманации радия Е. С. Бурксер выделяет следующие типы воды:
Радиоактивность,
Тип воды в эманах
Очень сильно радиоактивные. . . . > 10000
Сильно радиоактивные 1000—10000
Радиоактивные 100—1000
Слабо радиоактивные 10—100
Весьма слабо радиоактивные .... <10
В открытых водоемах и водотоках, а также в подземных водах в зависимости от степени их загрязненности находятся различные бактерии, количество которых исчисляется многими сотнями, ты-
7 Богомолов Г. В. 193
сячами, миллионами в 1 см3 воды и уменьшается с глубиною. Они могут быть безвредные и болезнетворные, возбуждающие различные желудочно-кишечные заболевания. Бактерии появляются в подземной воде или открытых водотоках в результате загрязнения их различными отбросами. Размеры бактерий колеблются от нескольких долей до единиц микрона. Так, например, размер бактерий, окисляющих метан, 2—3 мкм в длину при толщине 1,5—2 мк. Для оценки органического загрязнения воды пользуются коли-титром, под которым понимается объем воды, заключающий одну кишечную палочку (Bacterium colisommune). Кишечная палочка сама по себе безвредна, но она очень часто сопровождается весьма опасными болезнетворными бактериями — возбудителями брюшного тифа, холеры, дизентерии и т. д. В зависимости от содержания одной кишечной палочки воды классифицируют следующим образом:
Тип воды Вдда, мл
Здоровая 100
Достаточно здоровая 10
Сомнительная 1
Нездоровая 0,1
Совершенно нездоровая .... 0,01
