
- •Предисловие
- •Введение
- •Глава I развитие гидрогеологии и инженерной геологии
- •Глава II вода в атмосфере и на поверхности земли
- •Влажность воздуха
- •Температура воздуха
- •Атмосферные осадки
- •Испарение
- •Инфильтрация
- •Глава III вода в земной коре состояние воды в земной коре, понятие о подземных водах
- •Теории происхождения и формирования подземных вод
- •Глава IV физико-механические и водные свойства пород температурные зоны в земной коре
- •Механический (гранулометрический) состав горных пород
- •Виды воды в горных породах
- •Водные свойства горных пород
- •Механические свойства горных пород
- •Глава V
- •Классификация подземных вод
- •Верховодка
- •Грунтовые воды
- •Артезианские воды
- •Трещинные и карстовые воды
- •Подземные воды в районах многолетней мерзлоты
- •Минеральные воды
- •Режим подземных вод
- •Влияние леса и болот на режим подземных вод
- •Глава VI
- •Физические свойства подземных вод
- •Химический состав подземных вод
- •Химический анализ воды; отбор проб для анализа
- •Формы выражения химического анализа воды
- •Химическая характеристика и классификации подземных вод
- •Глава VII
- •Основные законы движения подземных вод
- •Расходы потока подземных вод и построение кривой депрессии
- •Приток воды к водозаборным сооружениям
- •Движение подземных вод в трещиноватых породах
- •Определение водопритока в карьеры
- •Глава VII!
- •Гидрогеологические наблюдения при разведочных работах
- •Определение водопроницаемости горных пород
- •Определение скорости движения подземных вод
- •Глава IX обводненность месторождений
- •Классификация месторождений полезных ископаемых по гидрогеологическим условиям и степени обводненности
- •9 Богомолов г. В. 257
- •Глава XI
- •Глава XII
- •Водоснабжение
- •Оценка запасов подземных вод и их охрана
- •Искусственное восполнение запасов подземных вод
- •Орошение
- •Осушение
- •Глава XIII
- •Глава VIII. Гидрогеологические исследования 227
- •Глава IX. Обводненность месторождений полезных ископаемых и борьба
- •Глава XI. Главнейшие физико-геологические явления, связанные с деятель ностью поверхностных и подземных вод 267
- •Глава XII. Инженерно-геологические и гидрогеологические исследования
- •Глава XIII. Применение геофизических методов при гидрогеологических и
Химический анализ воды; отбор проб для анализа
В настоящее время применяют два способа оценки физических свойств и химического состава подземных вод: 1) упрощенный химический анализ и определение физических свойств на месте при помощи походной химической лаборатории; 2) химический и бактериологический анализы в специально оборудованных стационарных лабораториях.
Для упрощения анализов широко применяется полевая гидрохимическая лаборатория, сконструированная А. А. Резниковым. Она позволяет определять качественно прозрачность, цвет, запах, вкус, нитрат-ион (NO3~), сероводород (H2S), количественно концентрацию водородных ионов (рН), железо окисное (Fe3+), железо ззкисное (Fe2+), нитрит-ион (NC>2~), аммоний-ион (NH4+), гидрокарбонат-ион (НСО3~), хлор-ион (С1-), сульфат-ион (SO42~), кальций-ион (Са2+), магний-ион (Mg2+), натрий-ион и калий-ион (Na+, К+), углекислоту свободную и агрессивную, жесткость общую и карбонатную, сумму минеральных веществ (сухой остаток) '.
В стационарных лабораториях производят сокращенный анализ по составу, близкому к полевому; цель его — контроль полевых анализов, выполняемых в массовом количестве.
В большинстве случаев в стационарных лабораториях произ-водят полный химический анализ, состав которого определяется целевым назначением воды. Так, для минеральных вод анализ включает количественное определение редких элементов (Вг, I, В, Si и др.), растворенных газов и радиоактивности.
Пробы воды для химического анализа отбираются из источников непосредственно в стеклянные бутылки; из буровых скважин пробы берутся с помощью батометров и пробоотборников.
Формы выражения химического анализа воды
Результаты химических анализов проб воды раньше выражали в виде окислов металла (Na2O, К2<Э) и ангидридов (SO3, C02 и т. д.). Такая форма выражения не давала правильного представления о составе воды. В настоящее время основная форма выражения химического анализа ионная. t При этом, поскольку в растворе молекулы солей распадаются на катионы и анионы, те и
1 Подробное описание методики производства химических анализов см.: Резников А. А., Муликовская Е. П., Соколов И. Ю. Методы анализа природных вод. 1970.
180
другие должны находиться в эквивалентных количествах. Чтобы результаты анализа воды, выраженные в ионной форме, перевести в эквивалентную, надо количество каждого найденного элемента, выраженное в мг/л, разделить на его эквивалентную массу (атомная масса элемента, деленная на его валентность). Например, 460 мг/л Na+ соответствует 460:23 = 20 молям Na, a 22,0 мг/л SCU2" составляют 240:48=5,0 молей SO4. Вместо деления на эквивалентную массу можно количество ионов, выраженное в мг/л, умножить на величину, обратную эквивалентной массе. В приведенных примерах в этом случае будем иметь следующее количество эквивалентов:
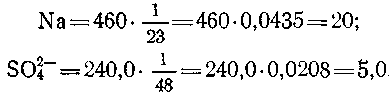
В табл. 10 приведены пересчетные коэффициенты для перевода результатов химических анализов из ионной формы (мг/л) в эквивалентную.
ТАБЛИЦА 10
Катионы |
Пересчетный коэффициент |
Анионы |
Пересчетный коэффициент |
Водород Н-+ |
0,9921 |
Гидроксил ОН~ |
0,0588 |
Натрий Na+ |
0,0435 |
Нитрат МО3- |
0,0161 |
Калий К+ |
0,0256 |
Нитрит МО2- |
0,0271 |
Аммоний МН4+ |
0,0554 |
Карбонат СОз2~ |
0,033 |
Кальций Са2+ |
0,0499 |
Гидрокарбонаг НСОз~ |
0,0164, |
Магний Mg2+ |
0,0822 |
Хлор С1~ |
0,0282 |
Барий Ва2+ |
0,0146 |
Бром Вг~ |
0,0125 |
Стронций Sr2+ |
0,0228 |
Иод I- |
0,0079 |
Медь Си2+ |
0,0315 |
Фтор f- |
0,0526 |
Цинк Zn2+ |
0,0306 |
Сульфат-ион S042- |
0,0208 |
Кадмий Cd2+ |
0,0178 |
Гидросульфид HS- |
0,0178 |
Алюминий А13+ |
0,1107 |
Тиосульфат-ион SjOs2" |
0,0316 |
Марганец Мп2+ |
0,0364 |
Гидрофосфат НРО42~ |
0,0216 |
Железо F3+ |
0,0537 |
Гидроарсенат HAsQt2" |
0,0250 |
Железо Fe2+ |
0,0858 |
Сульфит SO2- |
0,0302 |
Никель №2+ |
0,0341 |
Силикат Si032- |
0,0262 |
Кобальт Со2+ |
0,0339 |
|
|
Эквиваленты ионов можно выражать также в процентах от суммы анионов и катионов, принимая каждую сумму анионов и катионов за 50% или за 100%. Для примера в табл. 11 приводится анализ пробы воды, выраженный в мг/л, молях, в процентах молей. Предлагаемый солевой состав воды:

18!
ТАБЛИЦА 11
Ионы |
Содержание в 1 л воды |
||
мг |
МОЛИ |
°0 молей |
|
Катионы: Na + К+ Mg2+ Са2+ |
888,9 20,5 99,4 269,4 |
38,65 0,52 8,17 13,44 |
31,80 0,43 6,72 11,05 |
Итого ... |
1278,2 |
60,78 |
50,00 |
Анионы: С1- SQ2- нсо3- |
1514,9 756,0 128,1 |
42,72 15,92 2,14 |
35,17 13,10 1,73 |
Итого ... |
2343,9 |
60,78 |
50,00 |
Для правильного понимания роли природных вод в геологических процессах необходимо рассматривать их как сложный раствор, находящийся во взаимодействии с твердой и газообразной фазами литосферы, содержащий различные химические элементы.
Если природную воду выпаривать в фарфоровой чашке, то после этого в ней останется так называемый плотный остаток, количество которого выражают в мг/л или г/л. После прокаливания остатка при +105—110° С все органические вещества сгорают, в результате наблюдается некоторая потеря в массе. Образующийся после сгорания органических веществ остаток называют сухим, или прокаленным, и количество его выражают также в мг/л или г/л. Разность между массой плотного и сухого остатка называют потерей при прокаливании, ее обычно выражают в мг или в процентах к первоначальной массе. У подземных вод, мало загрязненных органическими соединениями, потеря при прокаливаниии не превышает 3—5%.
Следует иметь в виду, что при прокаливании плотного остатка происходит разложение карбонатов и выделение свободной углекислоты, вследствие чего потеря в массе получается несколько больше массы органических веществ. Поэтому для определения сухого остатка выделяющуюся свободную углекислоту определяют отдельно и вводят соответствующую поправку к массе остатка, полученного после прокаливания.
Результат химического анализа воды иногда выражают в графической форме в виде диаграммы-прямоугольника, графика-
182
квадрата и графика-треугольника или комбинации квадрата и двух треугольников. На диаграмме в определенном масштабе откладывают содержание ионов в процент-эквивалентах, на одной половине диаграммы показывают ионы металлов — катионы, на другой — ионы кислотных остатков — анионы.
График-квадрат предложен Н. И. Толстихиным (1928). На графике по горизонтали откладывают содержание катионов, а по вертикали—содержание анионов (в процент-эквивалентах).
Графики-треугольники (рис. 79) строятся отдельно для катионов (Na+ + K+, Ca2+ и Mg2+) и анионов (С1-, SO42- и НСО3~). На каждой стороне треугольника откладывают процент-эквиваленты перечисленных компонентов. Результат химического анализа воды,

Рис. 79. Графики-треугольники
как и на графике-квадрате, изобразится точкой, причем местоположение ее сразу указывает тип воды.
Во Франции и в ряде других стран Европы для изображения химического состава подземных вод пользуются логарифмической диаграммой, описанной впервые в 1948 г. Ж- Кастани и X. Шол-лером.
Логарифмическая диаграмма (рис. 80) состоит из семи вертикальных шкал. На шести из них нанесены компоненты в мг/л и на одной — в градусах — для dH; шкалы расположены на равном расстоянии друг от друга и обозначены соответственно Са, Mg, dH, Na, Cl, SO4, CO3. Двух вертикальных шкал по боковым рамкам диаграммы (в молях/л); трех вставных шкал: рН, коэффициента /С и свободной ССЬ; из пяти пунктирных линий, пронумерованных от I — до V и соответствующих стольким же классам воды по ее характеристике для потребления '.
Основные логарифмические шкалы, градуированные в мг/л, служат для выражения результатов химического анализа воды.
1 Подробное описание диаграммы см.: Богомолов Г. В. Гидрогеология с основами инженерной геологии. М., «Высшая школа», 1962.
183

Рис. 80. Логарифмическая диаграмма
