
4. Окислительно-восстановительные свойства кислот.
Окислительно-восстановительные свойства кислот. Всякая кислота диссоциирует с образованием ионов. Эти ионы, взаимодействуя с металлами, стоящими в ряду напряжений левее водорода, восстанавливаются до свободного водорода, например:
Н2+1SO4-2 + Mg0 Mg+2SO4-2 + H20
2Н+1 + SO4-2 + Mg0 Mg+2 + SO4-2 + H20
2Н+1 + Mg0 Mg+2 + + H20
Поэтому всякая кислота, взаимодействуя с металлом с выделением водорода, выступает в роли окислителя за счет восстановления ионов водорода.
Кроме того, у кислородных кислот центральный атом может понижать свою степень окисления, в результате чего анион этой кислоты также может выступать в роли окислителя. Так, в молекуле серной кислоты имеется атом серы в степени окисления +6, который может восстанавливаться до более низкой степени окисления. Чтобы особо выделить такие кислоты, мы называем их кислотами-окислителями. Это, например, концентрированная серная кислота, а также азотная кислота — как концентрированная, так и разбавленная. Окислительные свойства таких кислот приводят к тому, что при их действии на металлы водород вообще не выделяется. Это связано с тем, что окислителем в данном случае является не Н+ — а более сильный окислитель — анион кислоты. Поэтому кислоты-окислители могут окислять даже металлы, стоящие справа от водорода в ряду напряжений, неметаллы (например, серу, фосфор, углерод), а также некоторые сложные вещества, в частности сульфиды металлов.
Очень сильным окислителем является "царская водка": смесь одного объема концентрированной азотной кислоты с тремя объемами концентрированной соляной кислоты (т. е. насыщенного при комнатной температуре раствора хлороводорода в воде). Царская водка способна окислять даже металлы, стоящие в крайней правой части ряда напряжений, например золото и платину. Окислительные свойства царской водки связаны с наличием в ней промежуточного соединения - нитрозилхлорида N0Cl, образующегося при окислении НС1 азотной кислотой.
Составление уравнений овр методом электронного баланса.
При составлении уравнений ОВР нужно учесть, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. При написании уравнений ОВР используют два метода расстановки коэффициентов: метод электронного баланса и метод полуреакций.
Метод электронного баланса (окислительных чисел) рассмотрим на примере реакции
![]()
Для расстановки коэффициентов выполняем следующие действия.
1. Определяем элементы, атомы которых изменяют степень окисления:
![]()
2. Находим окислитель и восстановитель в данной ОВР и пишем отдельно электронные уравнения процессов окисления и восстановления:
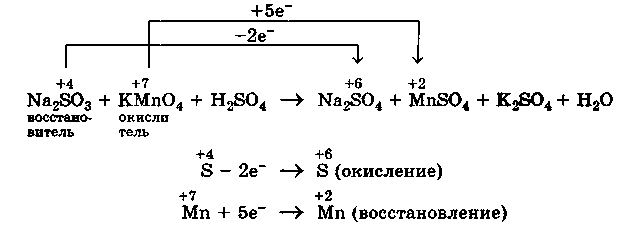
3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс):
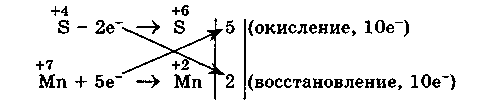
4. Коэффициенты 5 и 2 из электронных уравнений переносим в молекулярное уравнение ОВР:
![]()
5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения:
![]()
Mетод полуреакций (ионно-молекулярный метод) основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и малорастворимые вещества - в виде молекул. Степень окисления атомов не используют, а учитывают заряды реальных ионов и характер среды, в которой идет процесс окисления или восстановления. Алгебраическую сумму зарядов в левой и правой частях полуреакций (процессов окисления и восстановления) уравнивают с помощью определенного числа электронов, которые участвуют в процессе. После записи полуреакций окисления и восстановления уравнивают число электронов, отданных восстановителем и принятых окислителем с помощью дополнительных коэффициентов (как в методе электронного баланса). С учетом этих коэффициентов записывают сокращенное ионно-молекулярное уравнение, а затем и молекулярное уравнение ОВР.
Используем метод полуреакций для той же реакции:


Теперь уравниваем число электронов в полуреакциях окисления и восстановления и получаем» сокращенное ионно молекулярное уравнение ОВР:
Записываем молекулярное уравнение ОВР:
![]()
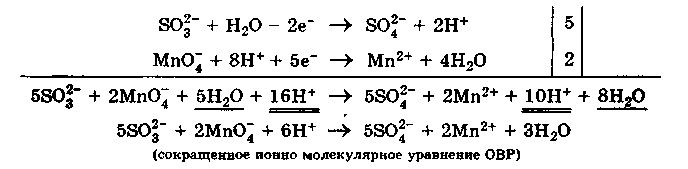
Метод полуреакций как метод составления уравнений ОВР учитывает роль среды в ходе ОВР, а также позволяет определить все продукты данной реакции.
Методом полуреакций составим уравнения реакций взаимодействия сульфита натрия Nа2SO4 с перманганатом калия КМпО4 в нейтральной и щелочной среде.
В нейтральной среде:
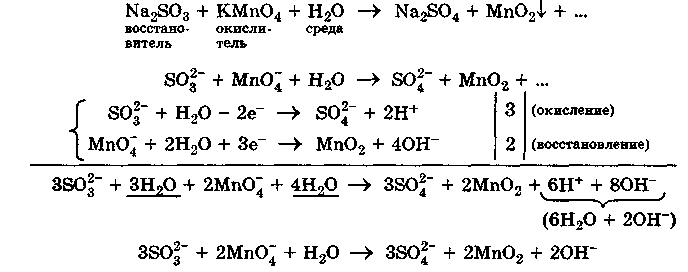
или
![]()
В щелочной среде:
л и
и
![]()
