
- •Что такое полная энергетическая светимость?
- •Как связаны полная энергетическая светимость ачт и его температура (закон Стефана-Больцмана)?
- •Как зависит от температуры длина волны, при которой спектральной плотности испускательной способности ачт имеет максимум (закон смещения Вина)?
- •Что такое тормозное рентгеновское излучение? Как его интенсивность зависит от длины волны?
- •Что такое коротковолновая граница спектра рентгеновского тормозного излучения. Как она зависит от энергии электронов?
- •В чем состоит эффект Комптона? Исходя из каких законов его можно объяснить?
- •Что такое спектральная серия в излучении атомов?
- •Что такое спектральные термы?
- •В чем состоит комбинационный принцип Ритца?
- •Напишите обобщенную формулу Бальмера для атомарного водорода?
- •В чем состоял опыт Резерфорда, на оснований которого была предложена ядерная модель атома?
- •Сформулируйте постулаты Бора для атомных систем.
- •Какое правило квантования предложил Бор для атомарного водорода?
- •В чем состоял опыт Франка и Герца, подтвердивший постулаты Бора?
- •Что такое волновые свойства частиц? Сформулируйте гипотезу де Бройля.
- •Какой вид имеет волновая функция для свободной частицы с заданным значением импульса?
- •В чем состоял опыт Девиссона и Джермера? Как он объясняется?
- •В чем состоял опыт Томпсона–Тартаковского? Как он объясняется?
- •Что такое электронография и нейтронография?
- •Как описывают состояние частицы в классической и квантовой механике? в чем различие?
- •Какими свойствами обладает волновая функция частицы?
- •В чем состоит принцип дополнительности?
- •В чем состоит принцип соответствия?
- •Сформулируйте временное уравнение Шредингера для свободной частицы.
- •Какой вид имеет волновая функция свободной частицы? Что можно сказать про квантование динамических характеристик ее движения?
- •Какой вид имеют решения одномерного уравнения Шредингера для частицы в потенциальной яме с бесконечно высокими стенками?
- •Как найти разрешенные уровни энергии для частицы в потенциальной яме с бесконечно высокими стенками?
- •Каковы разрешенные уровни энергии для частицы в потенциальной яме с бесконечно высокими стенками?
- •Что такое квантовое число, как характеристика состояния частицы в потенциальной яме?
- •Что такое связанные состояния атомной системы? Чем различается энергетический спектр свободных и связанных состояний?
- •Чем различается поведение классической и квантовой частиц, падающих на потенциальный барьер?
- •Что такое коэффициент прозрачности потенциального барьера?
- •Что такое операторы физически наблюдаемых? Приведите примеры.
- •Что такое собственные функции и собственные значения наблюдаемых?
- •Что такое операторы координаты, проекции импульса, момент импульса?
- •Что такое операторы кинетической, потенциальной и полной энергии?
- •В каком случае наблюдаются линейчатые, полосатые и сплошные энергетические спектры?
- •Каковы условия наблюдения спектров испускания и поглощения.
- •По какой формуле вычисляются разрешенные значения энергии квантового гармонического осциллятора? Что такое нулевые колебания?
- •Изобразите волновые функции квантового гармонического осциллятора, отвечающие трем нижним уровням энергии.
- •Что такое правило частот Бора для излучения и поглощения света.
- •Что такое правила отбора? Как в квантовой механике получаются эти правила?
- •Что такое опыт Штерна–Герлаха? Что доказывают его результаты?
- •Какие значения проекции момента импульса можно обнаружить у атомной системы с известным моментом импульса?
- •Что такое спин электрона? Какие значения может принимать его проекция?
- •Что такое принцип Паули для системы тождественных фермионов?
- •Изобразите схему энергетических уровней для электрона в атоме водорода.
- •Что такое вырождение энергетических уровней электрона в атоме водорода? Какова степень вырождения?
- •Каким правилам подчиняются энергетические переходы атома водорода, происходящие при излучении (поглощении) света?
- •Какие слагаемые входят в уравнение Шредингера для многоэлектронного атома?
- •Как задают состояние электронной оболочки многоэлектронного атома в приближение независимых электронов?
- •Что такое электронный паспорт многоэлектронного атома?
- •Что такое приближение независимых электронов для многоэлектронного атома?
- •Что такое главное квантовое число? Какие значения оно может принимать?
- •Что такое орбитальное квантовое число? Какие значения оно может принимать?
- •Что такое магнитное квантовое число? Какие значения оно может принимать?
- •Что такое спиновое квантовое число? Какие значения оно может принимать?
- •Чем различаются электронные оболочки и подоболочки?
- •Каково максимальное число электронов в состояниях с данным значением главного квантового числа?
- •Каково максимальное число электронов в состояниях с данным значением орбитального квантового числа?
- •Каким образом классифицируют одноэлектронных состояний?
- •Как конструируется волновая функция электронной оболочки многоэлектронного атома и одноэлектронных волновых функций?
- •Что такое запрет Паули для заполнения одноэлектронных состояний многоэлектронного атома?
- •Как вычисляется полная энергия электронной оболочки в одноэлектронном приближении?
- •Что такое основное состояние многоэлектронного атома? Каким найти электронную конфигурацию основного состояния?
- •Чем обусловлено отклонение от идеальной схемы заполнения электронных оболочек атомов?
- •Что такое ls–связь в многоэлектронном атоме?
- •Что такое учет энергии возмущения в изучении многоэлектронного атома?(не уверен)
- •Что такое мультиплетность?
- •Что общего и в чем различие в переходах отвечающих к и к линиям рентгеновского характеристического излучения?
- •Что общего и в чем различие в переходах отвечающих к и l линиям рентгеновского характеристического излучения?
- •Сформулируйте закон Мозли для характеристического рентгеновского излучения.
- •Что такое коэффициент поглощения рентгеновских лучей?
- •Чем отличается коэффициент поглощения от массового коэффициента поглощения рентгеновских лучей?
- •Как зависит коэффициент поглощения рентгеновского излучения от длины волны?
- •Как зависит коэффициент поглощения рентгеновского излучения от атомного номера поглотителя?
- •Что называется краем полос поглощения в случае рентгеновского излучения?
- •Как с помощью векторной модели определить полный магнитный момент атома? (чертеж-пример)
- •Что такое метод молекулярных пучков при изучении магниторезонансных явлений?
- •Перечислите основные типы двухатомных молекул? Чем они различаются?
- •Что такое энергия диссоциации? Укажите соответствующий переход в энергетическом состоянии молекулы.
- •Зависимость энергия электронной конфигурации молекулы от межъядерного расстояния.??????
- •Что такое вращательные, вращательно- колебательные, электронно- колебательные спектры молекул.
- •Чем различаются оптические спектры молекул и атомов?
- •Какие существуют виды молекулярных спектров излучения и поглощения?
- •Сформулируйте правила отбора для оптических спектров молекул. В чем отличие спектров симметричных и несимметричных молекул?
- •Чем различаются спонтанные и вынужденные переходы в атомной системе?
- •От чего зависит интенсивность спонтанных и вынужденных переходов в данной среде?
- •Чем вынужденное излучение отличается от спонтанного?
- •Что такое коэффициенты Эйнштейна?
- •Что такое инверсная населенность, зачем она нужна?
- •С формулируйте принципы, на которых основана работа квантовых генераторов, например: He-Ne лазера или лазера на рубине.
- •Чем бозоны отличаются от фермионов?
- •Что такое функция распределения частиц по энергетическим состояниям?
- •Что такое плотность электронных состояний?
- •Что такое функция распределения Бозе–Эйнштейна?
- •Что такое функция распределения Ферми–Дирака?
- •Чем вырожденный идеальный газ бозонов отличается от невырожденного идеального газа?
- •Чем идеальный вырожденный газ фермионов отличается от невырожденного идеального газа?
- •Какие существуют основные типы кристаллов?
- •Что происходит с энергетическими уровнями атомов (молекул) при объединении их в кристалл?
- •Что такое энергетические зоны? Как они возникают?
- •Чем различается заполнение энергетических зон электронами в проводниках, полупроводниках и изоляторах?
- •Что такое работа выхода для данного вещества? Покажите ее на энергетической схеме?
- •Где находится и как зависит от температуры уровень Ферми в примесных полупроводниках?
- •Как выглядят одноэлектронные волновые функции в идеальном кристалле (функции Блоха)?
- •Что такое квазиимпульс электрона в кристалле?
- •Что такое зоны Бриллюэна? Где они находятся? Как связаны с «длинами волн» одноэлектронных волновых функций?
- •Что такое эффективная масса электрона в кристалл?
- •Почему эффективная масса электрона в кристалле, вообще говоря тензор?
- •Выпишите основные уравнения динамики электронов в кристаллической решетке?
- •Что такое дырки? Каковы их заряд и масса?
- •Как связана электропроводность кристалла со структурой заполнения энергетических зон?
- •Как и почему зависит концентрация свободных носителей в проводнике и полупроводнике от температуры?
- •Чем определяется концентрация свободных электронов и “дырок” в полупроводниковом кристалле?
- •Что такое донорная и акцепторная примесь? Как они влияют на энергетический спектр электронов в полупроводнике?
- •Как и почему зависит подвижность свободных носителей в проводнике и полупроводнике от температуры.
- •Как зависит электропроводность металлов от температуры?
- •Как зависит электропроводность чистых полупроводников от температуры?
- •Как зависит электропроводность примесных полупроводников от температуры?
- •Что такое внутренний фотоэффект?
- •Сформулируйте закон Дюлонга-Пти.
- •Что такое фононы? Как определяется их энергии и квазиимпульс?
- •Почему при низкой температуре зависимость теплоемкости от температуры отклоняется от закона Дюлонга-Пти?
- •Почему электроны проводимости вносят очень малый вклад в теплоемкость металлического кристалла (по сравнению с колебаниями решеткой)?
- •Почему металлический кристалл имеет относительно большую теплопроводность?
- •Сформулируйте основные положения теории Дебая теплоемкости кристаллической решетки?
- •Как в теории Дебая вычисляется внутренняя энергия колебаний кристаллической решетки?
- •Что такое температура Дебая?
- •Учет ангармонизма колебаний атомов. Тепловое расширение.
- •Какие явления называются контактными?
- •Что такое внутренняя контактная разность потенциалов для контакта металл-металл?
- •Что такое внешняя контактная разность потенциалов для контакта металл-металл?
- •Какими свойствами обладает контакт металл-полупроводник?
- •Что такое р-n переход? Почему он обладает односторонней проводимостью?
- •Что такое термоЭдс? Чем она объясняется?
- •Что такое эффект Пельтье? Чем он объясняется?
- •В чем отличие вещества в сверхпроводящем состоянии от обычного проводника?
- •Физика атомного ядра. Элементарные частицы и фундаментальные взаимодействия
- •Из чего состоит атомное ядро?
- •Каков порядок размера ядра? Почему для стабильных ядер он ограничен сверху?
- •Что такое декремент массы протона, нейтрона, ядра?
- •Что такое энергия отдачи ядра?
Что такое принцип Паули для системы тождественных фермионов?
один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
Какие квантовые числа являются параметрами состояния для электрона в атоме водорода?
Главное n, целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень.
магнитное m - Это квантовое число принимает целые значения от -l до +l (где l — орбитальное квантовое число), то есть имеет ровно столько значений, сколько орбиталей существует на каждом подуровне.
Магнитное квантовое число (m) характеризует ориентацию в пространстве орбитального момента количества движения электрона или пространственное расположение атомной орбитали/
и орбитальное l- определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения от 0 до n-1
Изобразите схему энергетических уровней для электрона в атоме водорода.
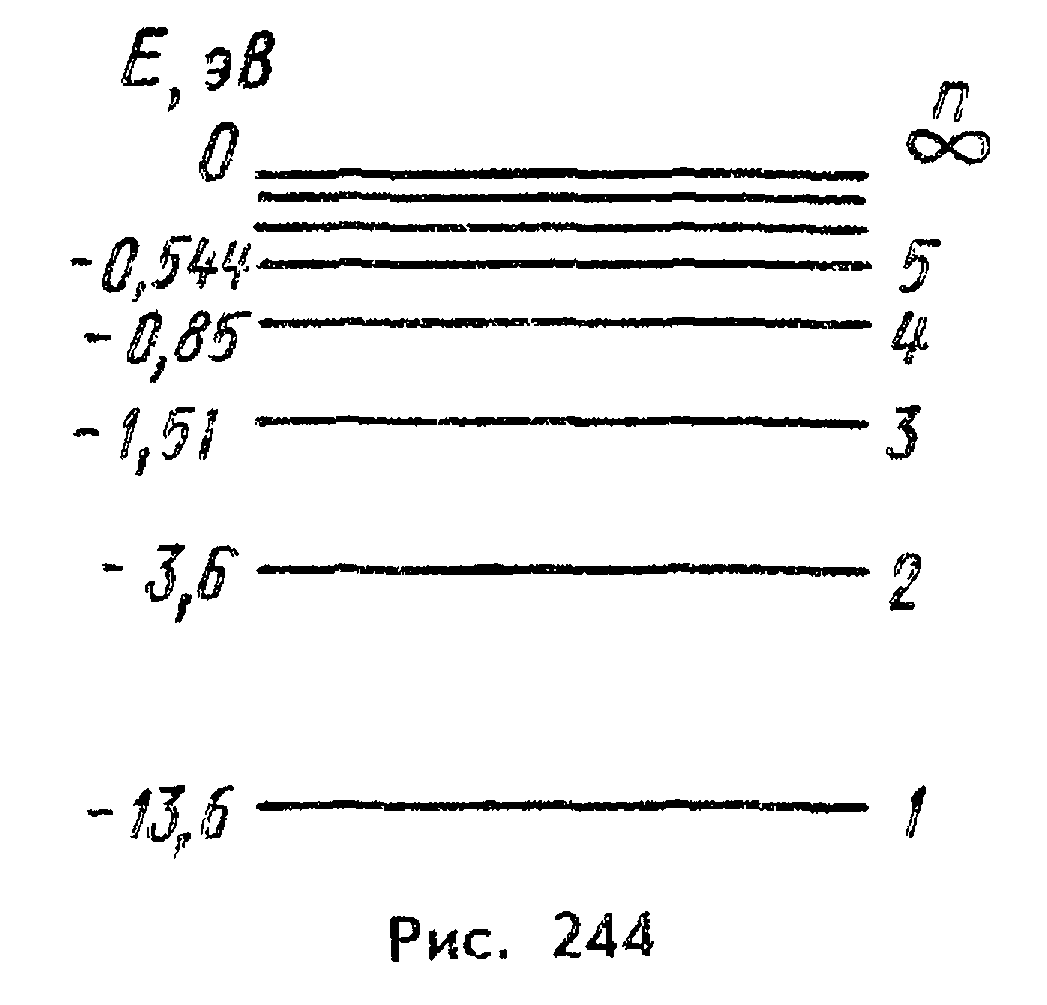
Что такое вырождение энергетических уровней электрона в атоме водорода? Какова степень вырождения?
существование двух или более стационарных состояний квантовой системы (атома, молекулы) с одинаковыми значениями энергии. Система, полная энергия к-рой определяется заданием оператора Я (гамильтониана), может иметь n стационарных состояний, для к-рых ур-ние Шрёдингера определяет соответствующие волновые ф-ции(i = 1, 2, ..., т)и одно значение энергии Е, одинаковое для всех n состояний. Энергетич. уровень с энергией Е при n не равным 1 наз. вырожденным, число n разл. независимых волновых ф-ций - кратностью вырождения уровня. О состояниях с волновыми ф-циями говорят как о состояниях, вырожденных по энергии, или вырожденных состояниях. Если одному значению энергии отвечает одно состояние, т.е. n=1, уровень наз. невырожденным.
Каким правилам подчиняются энергетические переходы атома водорода, происходящие при излучении (поглощении) света?
Первый постулат Бора: постулат стационарных состояний
Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия En. В стационарном состоянии атом не излучает.
Второй постулат Бора: правило частот
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний:
hvkn = Ek - En
Какие слагаемые входят в уравнение Шредингера для многоэлектронного атома?
В атоме водорода электрон находится в силовом поле, которое создается только ядром. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Точное решение уравнения Шредингера для таких сложных систем связано с большими затруднениями и, как правило, недостижимо. Поэтому состояние электронов в сложных атомах и в молекулах определяют путем приближенного решения уравнения Шредингера. Общим для всех приближенных методов решения этого уравнения является так называемое одноэлектронное приближение, т.е. предположение, что волновая функция многоэлектронной системы может быть представлена в виде суммы волновых функций отдельных электронов. Тогда уравнение Шредингера может решаться отдельно для каждого находящегося в атоме электрона, состояние которого, как и в атоме водорода, будет определяться значениями квантовых чисел n, l, m и s.
