
- •Содержание
- •Билет №1
- •2. Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме.
- •Билет№2.
- •1.Ферменты. Специфичность ферментов. Активный центр фермента.
- •2.Экзергонические и эндергонические биохимические реакции. Роль атф и других макроэргических фосфатов в сопряжении экзергонических процессов и эндергонических процессов.
- •3.Пути внутриклеточного метаболизма глюкозы. Гликолиз и глюконеогенез. Обратимые и необратимые реакции.
- •Билет №3
- •1.Регуляция активности ферментов. Проферменты. Изоферменты. Ингибиторы ферментов.
- •2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение.
- •3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо в одном из цитохромов имеется так же атом меди.
- •Билет№4
- •1.Ферментативный катализ
- •2.Митохондриальный транспорт
- •3.Аэробное окисление пирувата (окислительное декарбоксилирование пировиноградной кты).
- •Билет№5
- •1.Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментен. Уравнение Лайнуивера-Берка.
- •2.Окислительное фосфорилирование. Пункты сопряжения окисления и фосфорилирования. Атф-синтетаза митохондрий.
- •3 Субъединицы (γ,δ,ε) способствуют целостности атф-синтазы
- •3.Полное окисление глюкозы. Энергетический баланс
- •Билет№6
- •1.Аллостерические ферменты. Ингибиторы и активаторы аллостерических ферментов. Аллостерические центры.
- •Деградация жирных кислот: β-окисление
- •Билет№7
- •1.Опять ферменты
- •2. Ингибиторы и разъединители транспорта электронов окислительного фосфорилирования
- •3.Глюконеогенез
- •Билет №8
- •1. Витамины
- •2. Микросомальная цепь транспорта электронов
- •3. Глюкозолактонный цикл
- •1. Витамин в2
- •3.Гипергликемия
- •Билет 10
- •Билет 11
- •1. Витамин в6(пиридоксин, пиридоксаль, пиридоксамин)
- •3 Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 12
- •1.Биотин
- •2. Нарушение обмена гликогена
- •3. Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 13. Фолиевая кислота. Биологическая роль. Пути поступления в организм. Коферментная функция.
- •2.Катаболизм триацилглицеролов. Реакции, механизм регуляции активности триглицеридлипазы. Нейрогуморальная регуляция липолиза (адреналин, глюкагон, инсулин).
- •3.Трансаминирование амк. Аминотрансферазы. Отдельные аминотрансферазы. Реакции. Биохимическое значение трансаминирования амк.
- •Билет 14
- •1.Витамин в12. Биологическая роль. Пути попадания в организм. Коферментная функция.
- •3.Пути превращения аммиака в организме человека. Механизмы обезвреживания аммиака.
- •Билет №15
- •1.Витамин с.
- •2.Окисление пальмитиновой кослоты.
- •3.Биосинтез мочевины.
- •Билет №16
- •1.Витамин а.
- •2.Окисление ненасыщенных жирных кислот.
- •3.Превращение безазотистого скелета ак
- •Билет №17
- •1.Витамин д
- •2. Биосинтез высших жирных кислот.
- •3. Метаболизм ак с разветвленной цепью.
- •Билет №25 Репликация днк
- •Свойства процесса репликации:
- •Желчные кислоты
- •Стероидные гормоны
- •2.Специализированные пути метаболизма цикл. А,к- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина.
- •3.Биосинтез гема
- •Билет 19
- •2.Биосинтез пуриновых нуклеотидов
- •3.Основные закономерности генетического кода. Адапторная гипотеза ф. Крика и её развитие в wobble-гипотезе.
- •Билет №20
- •2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
- •Билет №21
- •Транскрипционные факторы: Механизмы действия тф , связавающиеся с днк, могут влиять на транскрипцию генов через несколько механизмов:
- •Билет№22
- •Билет 23
- •2. Полное окисление глюкозы. Энергетический баланс полного окисления глюкозы.
- •Билет№24
- •1.Антибиотические вещества, подавляющие синтез белка
- •24.2 Функционирование малат-аспартатного и глицерофосфатного шунта.
- •Билет №26
- •3. Окисление капроновой кислоты
- •Билет №27
- •Репликация
- •Билет 28
- •Билет29
- •29.2.Метаболизм аминокислот
- •Билет №30
- •1.Особенности молекулярной организации и экспрессии генома эукариот (экзоны, интроны, сплайсинг)
- •2.Образование кетоновых тел и их утилизация.
- •3.Цикл трикарбоновых кислот. Реакции
3. Окисление капроновой кислоты
так как имеется 6 атомов углерода, то при β-окислении образуется 3 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН, 1 молекула ФАДН2 и 1 молекула ГТФ, что эквивалентно 12 молекулам АТФ. Итак, 8 молекул ацетил-S-КоА обеспечат образование 3×12=36 молекул АТФ.
для капроновой кислоты число циклов β-окисления равно 2. В каждом цикле образуется 1 молекула ФАДН2 и 1 молекула НАДН. Поступая в дыхательную цепь, в сумме они "дадут" 5 молекул АТФ. Таким образом, в 7 циклах образуется 2×5=10 молекул АТФ.
двойных связей в капроновой кислоте нет.
на активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ.
Таким образом, суммируя, получаем 36+10-2 =44 молекул АТФ образуется при окислении капроновой кислоты.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся моле-
кул пирувата до СО2 и Н2О, то он окажется значительно большим. Как отмечалось, одна молекула НАДН (3 молекулы АТФ) * образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следователь- но, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции
гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз. Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении
могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитоондриального НАДН не способны проникать через мембрану внутрь митохондрий. Если функционирует малат-аспартатный механизм, то в результа-
те полного окисления одной молекулы глюкозы может образоваться не 36,
а 38 молекул АТФ.
Билет №27
27/1
Репликация
Механизм репликации ДНК хорошо исследован у бактерий E.coli. Он состоит из трёх различных ферментов - полимеразы 1, 2 и 3. Репликацию генома обеспечивает пол.3.
В эукариотических клетках найдено пять различных полимераз - альфа, бетта, гамма, сигма и эпселон. Пол. альфа эукариот соответствует пол.3 прокариот, пол. бетта - пол.1, а полимераза гамма ответствена за синтез митохондриальной ДНК.
Для того, чтобы ДНК-полимеразы могли реплицировать ДНК, требуется множество дополнительных белков:
1).Праймаза - это ни что иное, как РНК-полимераза, которая катализирует синтез короткого олигорибонуклеотида (4-10 нуклеотидов), т.е. праймера, с которого потом начинается синтез ДНК.
2).Хеликаза - выполняет функцию раскручивания двойной спирали ДНК.
3).ДНК-связывающие белки - препятствуют обратному скручеванию цепочек ДНК.
4).ДНК-лигаза - сшивает фрагменты Оказаки.
5).Топоизомеразы - снимают суперскручивание, разрезая цепочку ДНК.
Процесс репликации ДНК начинается в определённом месте хромосомы, требует праймер, идёт в направлении 5` - 3` на обоих цепочках одновременно и даёт точные копии цепочек.
Сначала идёт раскручивание двойной спирали ДНК с помощью хеликазы. Образовавшиеся на некоторое время одноцепочечные участки ДНК служат в качестве матрицы при репликации и стабилизируются при помощи особых белков, которые связываются с одной цпочкой ДНК и препятствуют обратному комплементарному взаимодействию цепей ДНК.
Потом праймаза катализирует синтез праймера. С праймера начинается синтез ДНК. Синтез ДНК идёт в направлении 5` - 3` посредством прикрепления 5`-фосфатной группы dНТФ к существующей свободной 3`-ОН группе праймера с последующим освобождением пирофосфата.
Синтез одной цепи осуществляется непрерывно, а другой - прерывисто.Цепочка, синтез которой осуществляется непрерывно, называется ведущая, а та, которой прерывисто, - отстающая. На отстающей цепи синтезируются короткие (100-200 нуклеотидов) фрагменты (Оказаки), которые затем сшиваются ДНК-лигазами.
Как получается так, что ДНК-полимераза копирует обе цепочки одновременно? ДНК-полимераза - это димер, ассоциированный с другими белками в репликационной вилке, которая называется реплисомой. Отстающая цепочка временно делает петлю через реплисому и ДНК-полимераза идёт вдоль двух цепочек одновременно.
Терминация наступает тогда, когда исчерпана ДНК-матрица.
Репарация
Репарация - это внутриклеточный процесс, обеспечивающий восстановление повреждённой структуры молекулы ДНК.
1).Эндонуклеаза - "узнаёт" повреждённый участок и рядом с ним разрывает нить ДНК.
2).Экзонуклеаза "вырезает" повреждённый участок.
3).ДНК-полимераза по принципу комплементарности синтезирует фрагмент ДНК на месте разрушенного.
4).Лигаза "сшивает" концы ресинтезированного участка с основной нитью ДНК.
Принципиально доказана возможность репарации молекулы ДНК при повреждении обоих цепей. При этом информация может быть считана с иРНК (фермент ревертаза).
фрагменты Оказаки- Фрагменты Оказаки (Okazaki fragment) — это относительно короткие фрагменты ДНК (с РНК-праймером на 5' конце), которые образуются на отстающей цепи в процессе репликации ДНК. Длина фрагментов Оказаки у E. coli составляет около 1000—2000 нуклеотидов, и обычно 100—200 нуклеотидов у эукариот.
Фрагменты Оказаки были описаны в 1968 году en:Reiji Okazaki, en:Tsuneko Okazaki, и соавторами при изучении репликации ДНК бактериофага у Escherichia coli.[1][2]
Каждый фрагмент Оказаки образуется рядом с репликационной вилкой после РНК-праймера, образуемого праймазой, и далее продолжается ДНК-полимеразой III в случае прокариот. У эукариот отстающая цепь синтезируется ДНК-полимеразой δ. Праймер позднее удаляется ферментом с эндонуклеазной активностью подобной РНКазе Н, flap-эндонуклеазами и геликазой/нуклеазой Dna2.
РЕПЛИКАЦИЯ (редупликация) - процесс самовоспроизведения макромолекул нуклеиновых кислот, обеспечивающий точное копирование генетической информации и передачу её из поколения в поколение. В основе механизма репликации лежит принцип матричного синтеза ДНК на ДНК или РНК на РНК. Репликация ДНК у эукариот осуществляется в ядре. В результате репликации, происходящей при участии ферментов, образуются две двойные спирали ДНК. Эти «дочерние» молекулы ничем не отличаются друг от друга и от исходной, материнской, молекулы ДНК. Репликация осуществляется на основе ряда принципов. Принцип комплементарности заключается в том, что каждая из двух цепей материнской молекулы ДНК служит матрицей для синтеза дополняющей её комплементарной цепи. Второй принцип - полуконсервативность. Он основан на том, что в результате репликации образуются две двойные дочерние спирали, в каждой из которых только половина или одна спираль воспроизводит одну из материнских спиралей, а вторая спираль в каждой из дочерних молекул достраивается по принципу комплементарности. Следующий принцип -антипараллельности - основан на том, что две комплементарные цепи в молекуле ДНК расположены в противоположных направлениях. И последний - принцип прерывистости. Он базируется на том, что репликация начинается не с одного конца спирали материнской ДНК, а одновременно в нескольких местах молекулы ДНК. Участок между двумя точками, в которых начинается синтез дочерних цепей, называют репликдном (он же считается единицей репликации
27/2
Гликоген служит в животном организме резервом углеводов, из которого по мере метаболической потребности могут высвобождаться глюкозофосфат или глюкоза. Хранение в организме собственно глюкозы неприемлемо из-за ее высокой растворимости: высокие концентрации глюкозы создают в клетке высоко гипертоническую среду, что приводит к притоку воды. Напротив, нерастворимый гликоген осмотически почти неактивен.
Баланс гликогена
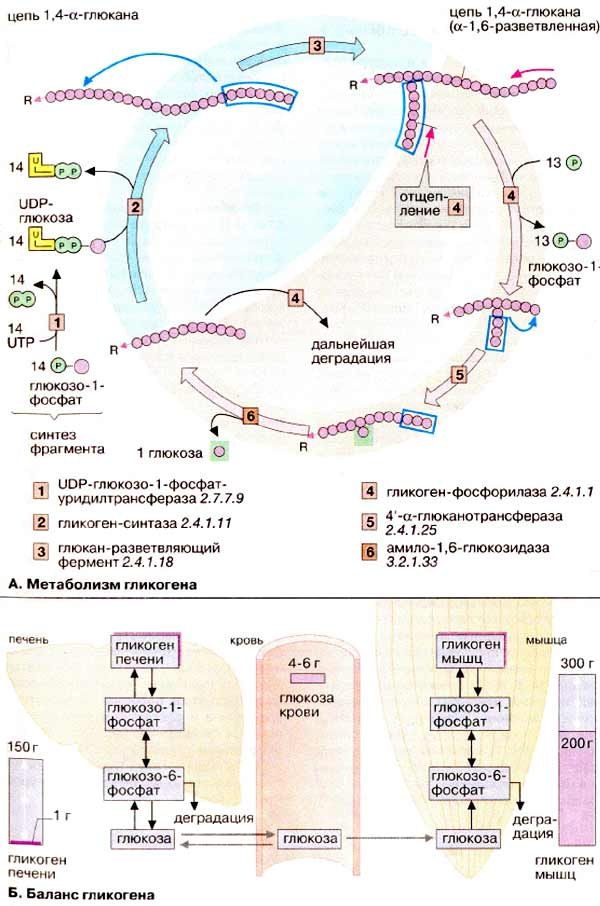
В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное — главным образом в мышцах. Содержание гликогена в других органах незначительно. Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови в фазе
Гликоген образуется из глюкозо-6-фосфата под влиянием фермента гликогенсинтетазы, существующей в активной и неактивной формах.
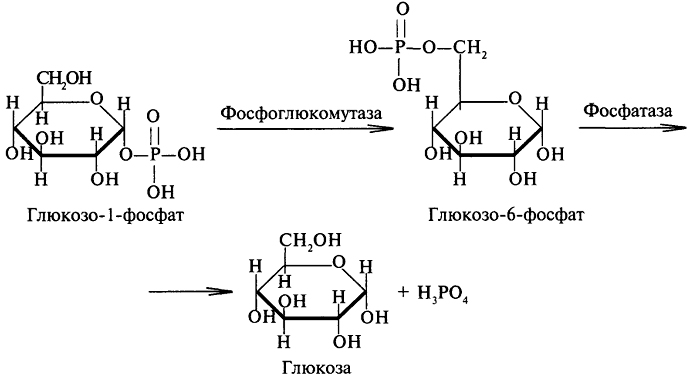
При распаде гликогена образуется глюкозо-1-фосфат, который при помощи фермента глюкозо-6-фосфатазы способен превращаться в глюкозо-6-фосфат. Последний дефосфорилируется и в виде эндогенной глюкозы поступает в кровоток. Поскольку глюкозо-6-фосфатаза имеется только в печени и отсутствует в мышцах, мышцы не могут быть поставщиком эндогенной глюкозы. Этот процесс — прерогатива печени. Мышечный гликоген, распадаясь, продуцирует пируват и лактат, которые метаболизируются в циклах Кребса и Кори.
Исходное вещество для синтеза гликогена - глюкозо-6-фосфат . Глюкозо-6-фосфат образуется главным образом из глюкозы путем ее фосфорилирования. В печени , мышцах и других тканях эту реакцию катализирует гексокиназа . В печени имеется особая форма гексокиназы - глюкокиназа , которая вступает в действие только при сильном повышении концентрации глюкозы в крови.
Глюкозо-6-фосфат может синтезироваться и из неуглеводных субстратов глюконеогенеза ( лактата , пирувата , аминокислот ).
В мышцах глюкозо-6-фосфат синтезируется преимущественно из глюкозы крови. Печень способна к интенсивному глюконеогенезу , особенно после мышечной работы, когда в крови накапливается много лактата . Глюкозо-6-фосфат превращается в глюкозо-1-фосфат , из которого синтезируются цепи гликогена. Образование альфа-1,4-связей катализирует гликогенсинтетаза ; для образования альфа-1,6-связей необходим 1,4-альфа-глюканветвящий фермент . Глюкозо-6-фосфат превращается не только в гликоген. В печени при гидролизе глюкозо-6-фосфата образуется глюкоза . Эта реакция катализируется глюкозо-6-фосфатазой .
Другие пути метаболизма глюкозо-6-фосфата: гликолиз (при этом образуются пируват и лактат) и пентозофосфатный путь (при этом образуется рибозо-5-фосфат ).
В норме между всеми процессами метаболизма глюкозо-6-фосфата поддерживается равновесие.
Расщепление гликогена (гликогенолиз) включает несколько этапов. Сначала фосфорилаза последовательно отщепляет остатки глюкозы от концов боковых цепей гликогена При этом фосфорилируются альфа-1,4-связи и образуются молекулы глюкозо-1-фосфата . Фосфорилаза атакует боковую цепь до тех пор, пока не дойдет до точки, отстоящей на 4 остатка глюкозы от места ветвления (т. е. от альфа-1,6-связи). Затем вступает в действие система отщепления боковых цепей гликогена. Первый фермент этой системы - 4-альфа-D-глюканотрансфераза - отщепляет 3 из 4 остатков глюкозы и переносит их на свободный конец другой боковой цепи. Второй фермент - амило-1,6-глюкозидаза - отщепляет от главной цепи четвертый остаток глюкозы. После этого главная цепь гликогена становится доступной для фосфорилазы. В реакции, катализируемой амило-1,6-глюкозидазой, образуется глюкоза .
В печени фосфорилаза находится как в активной, так и в неактивной форме. В активной фосфорилазе (фосфорилазе a) гидроксильная группа одного из остатков серина фосфорилирована. Под действием специфической фосфатазы ( протеинфосфатазы-1 ) фермент превращается в неактивную фосфорилазу b в результате гидролитического отщепления фосфата от остатка серина. Реактивация происходит путем рефосфорилирования за счет ATP при действии специфического фермента киназы фосфорилазы
Активность гликогенсинтетазы можно регулировать с помощью ряда метаболитов, которые являются ингибиторами или активаторами этого фермента. Так, аденозинтрифосфат (АТФ), аденозиндифосфат (АДФ), инозинтрифосфат, инозиндифосфат ингибируют синтетазу. Высокий уровень гликогена может предотвращать это блокирование. Представляет интерес действие иона Mg2+. Оказалось, что магний увеличивает сродство гликогенсинтетазы к глюкозо-6-фосфату (Г-6-Ф), предотвращая тем самым инги-бирование. В полиморфно-ядерных лейкоцитах человека 2 мкмоль АТФ блокируют переход гликогенсинтетазы при малом содержании гликогена. При высоких концентрациях АТФ ингибирование возрастает с 5 до 58%; 1 ммоль Г-6-Ф предотвращает блокирование АТФ при низких концентрациях гликогена лучше, чем при высоких. В связи с этим предполагают, что фосфотаза, катализирующая превращение гликогенсинтетазы, существует в двух формах. Одна форма при высоких концентрациях гликогена ингибируется АТФ, а другая при низких его концентрациях не ингиби-руется АТФ.
Регуляция активности гликогенсинтетазы тесно связана с регуляторной сетью клеточных метаболитов через субстраты гликолиза и цикла трикарбоновых кислот, которые активируют L-фор-му. Карбоксильные кислоты увеличивают сродство фермента Г-6-Ф. Однако действие этих кислот отличается от действия Г-6-Ф в отношении АТФ: они не защищают фермент от ее инги-бирующего действия.
Фосфоролиз является основным путем распада гликогена, его катализирует фермент гликогенфосфорилаза, относящийся к классу трансфераз. Гликогенфосфорилаза отщепляет остатки глюкозы с нередуцирующего конца гликогена и переносит их на молекулу фосфорной кислоты с образованием глюкозо-1-фосфата:
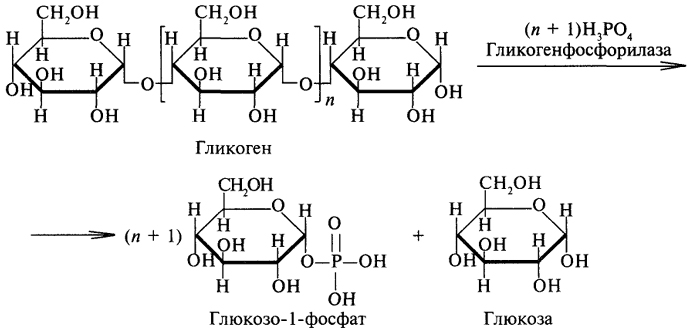
Глюкозо-1-фосфат быстро изомеризуется, превращаясь в глюкозо-6-фосфат, который в печени гидролизуется фосфатазами до глюкозы и фосфорной кислоты:
Процесс фосфоролиза гликогена тонко регулируется. Регуляция активности гликогенфосфорилазы носит каскадный характер, в котором можно выделить несколько видов регуляции ферментативной активности:
1) гормональная (глюкагон в печени, адреналин в мышцах);
2) аллостерическая;
3) протеинкиназные реакции (в данном случае - фосфорилирование бокового радикала серина в гликогенфосфорилазе).
Активность мышечной фосфорилазы увеличивается при определенной концентрации АМФ и ацетилхолина, а также в присутствии катионов кальция и натрия.
Снижение скорости фосфоролиза происходит при уменьшении запасов гликогена и фосфорной кислоты, а также при увеличении концентрации глюкозо-6-фосфата. Механизмы, снижающие скорость фосфоролиза гликогена, предохраняют организм от больших трат углеводных запасов (гликогена), которые могли бы привести к недостатку глюкозы, необходимой для работы головного мозга и сердечной мышцы.
27/3
Ферменты - особые белки, которые действуют как катализаторы в биологических системах.
Поскольку ферменты - белковые молекулы, следовательно, они обладают всеми свойствами, характерными для белков.
основные свойства ферментов как биологических катализаторов:
Специфичность
Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться"
. Субстратная специфичность способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
абсолютную субстратную специфичность; Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату
групповую субстратную специфичность;
стереоспецифичность. При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность
Б. Каталитическая эффективность
Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 108-1014.раз быстрее, чем некатализируемые реакции. Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт.
Количество молекул субстрата, превращённых в продукт с помощью одной молекулы фермента за 1 с, называют числом оборотов фермента, или молярной активностью.
В. Лабильность ферментов
способность к небольшим изменениям нативной конформации вследствие разрыва слабых связей. Поэтому воздействие денатурирующих агентов, способных изменять конформацию молекулы фермента, приводит к изменению конформации активного центра и снижению способности присоединять субстрат. В результате этого уменьшается каталитическая эффективность фермента.
Г. Способность ферментов к регуляции
Активность ферментов в клетке зависит от количества молекул субстрата, продукта, наличия кофакторов и коферментов. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной реакции является субстратом другой, образуя таким образом "метаболические пути.
