
- •Лекция №1
- •Классификация месторождений природного газа
- •Этапы разработки газовых и газоконденсатных месторождений
- •Режимы разработки месторождений природных газов
- •Режимы разработки месторождений природных газов
- •Особенности разработки газоконденсатных месторождений
- •Особенности притока газа к забою газовой скважины
- •Лекция 3
- •Состав и физико-химические свойства природных газов. Классификация природных газов
- •Газовые смеси. Плотность газов
- •Состав газовой смеси
- •Так появились уравнения состояния Битти - Бриджмена с пятью константами, Бенедикта – Вебба - Рубина с восемью константами и др.
- •Вязкость газов
- •Термодинамические характеристики газа
- •Опасные свойства природных газов
- •Взрывы газовоздушных смесей
- •Объём паров после испарения жидкости
- •Фазовые состояния углеводородных систем
- •Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
- •Упругость насыщенных паров
- •Термодинамические характеристики газа
- •Эффект Ранка
- •Состояние призабойной зоны пласта
- •Проницаемость призабойной зоны пласта
- •Классификация дисперсных систем по межфазному взаимодействию
- •Фильтрация дисперсных систем через пористые среды
- •Определение диаметра фонтанных труб газовой скважины
- •Принцип работы газлифта
- •Системы и конструкции газлифтных подъёмников
- •Разновидности газлифта, их технологические схемы
- •Преимущества и недостатки газлифтного способа добычи нефти
- •Оборудование газлифтных скважин
- •Пусковое давление
- •Методы снижения пускового давления
- •Тарировка газлифтных клапанов
- •Спуск и подъём съёмных клапанов, используемый инструмент
- •Торпедная перфорация
- •Сверлящая перфорация
- •3.Свабирование
- •4. Имплозия
- •Приборы для измерения давления
- •Устройства для измерения температуры
- •Устройства для измерения расхода природного газа
- •Подготовка скважины к газогидродинамическим исследованиям
- •Технология проведения исследований
- •Определение коэффициентов фильтрационного сопротивления "а" и "в"
- •Обработка результатов исследований газовой скважины на стационарных режимах
- •Пожары и фонтаны на нефтяных и газовых скважинах
- •Лекция №22
- •Средства и методы борьбы с пескопроявлением скважин
- •Лекция 23
- •Основные мероприятия по предупреждению и ликвидации обводнения газовых скважин
- •Классификация методов восстановления производительности обводняющихся скважин
- •Лекция №24
- •Лекция №25
- •Лекция №26
- •Основы ингибирования процесса гидратообразования
- •Ликвидация гидратов природных газов в газопроводах
- •Метод снижения давления в газопроводе
- •Метод устранения гидратов повышением их температуры
- •Устранение гидратных пробок с использованием
- •Метод сублимации гидрата
Эффект Ранка
Сущность эффекта Джозефа Ранка (1933 г) заключается в вихревом температурном разделении газового потока на холодный и горячий (центральный поток имеет более низкую температуру, чем исходный газ). Поясним этот эффект на примере вихревой трубы.
Согласно гипотезе Д.Ранка, в вихревой камере, непосредственно у сопла создается свободный вихрь, который по мере его движения вдоль трубы перестраивается в вынужденный за счёт сил трения между слоями газа. В результате перестройки потока газа происходит переток от осевых слоёв к периферийным, что приводит к охлаждению первых и нагреву вторых. Согласно предположению Д.Ранка, источником возникновения вихревого эффекта служат силы трения между слоями газа, и, в этой связи вихревой эффект невозможен для идеальных газов. Отечественными исследователями (Алексеев Т.С., Мартыновский В.С, Войтко А.И.)) высказано предположение, что вихревой эффект является результатом действия центробежных сил, возникающих неизбежно в любом вращающимся потоке газа и это ведет к тому, что сжатые периферийные слои газа нагреты сильнее, чем осевые (за счёт работы центробежных сил инерции). При этом следует ещё учитывать и повышение температуры торможения за счёт гашения окружной скорости вращающегося потока газа.
Вихревая труба в её основной модификации - это устройство, в котором сжатый газ при расширении разделяется на два потока - один более холодный, чем исходный, и второй - более горячий. В вихревой трубе нет никаких движущихся частей, её конструкция чрезвычайно проста.
На рисунке 7 показан общий вид вихревой трубы.

Рисунок 7. Общий вид вихревой трубы
Рассмотрим конструкцию вихревой камеры. Цилиндрическая труба 1 соединена с распределительной головкой 2, которая содержит сопловой ввод 3 (вихреобразователь), диафрагму 4 и трубу холодного потока 5. С противоположной стороны расположен корпус регулирующего вентиля 6 с конусом 7 и трубой 8 горячего потока.
Поток сжатого газа подводится к соплу 3. В сопловом вводе и затем в вихревой трубе сжатый газ расширяется и разделяется на два потока - холодный и горячий. Холодный поток (с температурой tх, значительно меньшей, чем температура tс сжатого потока) отводится через диафрагму 4 по трубе холодного потока. Внутреннюю поверхность вихреобразователя предпочтительно выполнять по спирали Архимеда, либо ввод газа в вихревую трубу осуществлять одновременно через несколько симметрично расположенных тангенциальных сопел.
Горячий поток (с температурой tг, значительно большей, чем tс) отводится с противоположного конца через вентиль 6 по трубе горячего потока.
Меняя положение конуса 7, можно изменять расходы и температуры холодного и горячего потоков. Для понижения температуры tх необходимо расход холодного потока уменьшить (вентиль 7 открывается). Для повышения температуры tг горячего потока, наоборот, вентиль 7 прикрывается.
Такова вихревая труба в её классическом виде. По мере совершенствования конструкций вихревых труб появились разнообразные её модификации, в частности такие, которые дают только холодный поток, или такие, где получают три потока - два холодных и один горячий; разработаны и такие трубы, в которых охлаждаемый объект помещается внутри них.
Однако принцип работы вихревой трубы и основные её элементы во всех модификациях сохраняются.
Образование холодного и горячего потоков может произойти только в том случае, если энергия входящего потока в вихревой трубе распределяется таким образом, чтобы некоторое ее количество отводилось от охлаждаемого потока и передавалось нагреваемому потоку. Суммарное количество энергии холодного и горячего потоков, отводимых из трубы (если она изолирована), по закону сохранения энергии равно количеству энергии поступающего сжатого газа. Перераспределение энергии является результатом сложных газодинамических процессов, происходящих внутри вихревой трубы. Прежде чем рассматривать эти процессы, необходимо представить некоторые внешние характеристики вихревой трубы.
Понижение температуры Δtх определяется по разности температур поступающего сжатого газа и получаемого холодного потока:
![]() (19)
(19)
а повышение температуры другой части потока составляет разность между температурами горячего потока tг и сжатого газа tc:
![]() (20)
(20)
Разности температур Δtх и Δtг при постоянных температуре tc и давлениях перед трубой и за ней изменяются в зависимости от соотношения масс потоков. Gх и Gг, выходящих соответственно через холодную и горячую стороны вихревой трубы. Масса получаемого холодного потока Gx или его доля μ = Gх/Gс (отношение массы холодного потока к массе суммарного количества газа, подведенного к вихревой трубе) регулируется изменением количества газа Gг, пропускаемого через вентиль на горячем конце трубы
Очевидно, что, например, при Gс = 1 кг/ч и доле холодного потока μ масса горячего потока будет равна 1 – μ. Значения Δtх и Δtг можно изменять в довольно широких пределах, однако во всех случаях должно соблюдаться условие сходимости энергетического баланса трубы.
В общем случае энергетический баланс имеет вид (рисунок 8)
![]() (21)
(21)
где Gc·ic - энергия потока, подведенного к трубе;
Gг·iг и Gх·iх - энергия, выносимая соответственно горячим и холодным потоками;
Qохл - количество тепла, отводимое от горячей части трубы при её естественном или искусственном охлаждении.
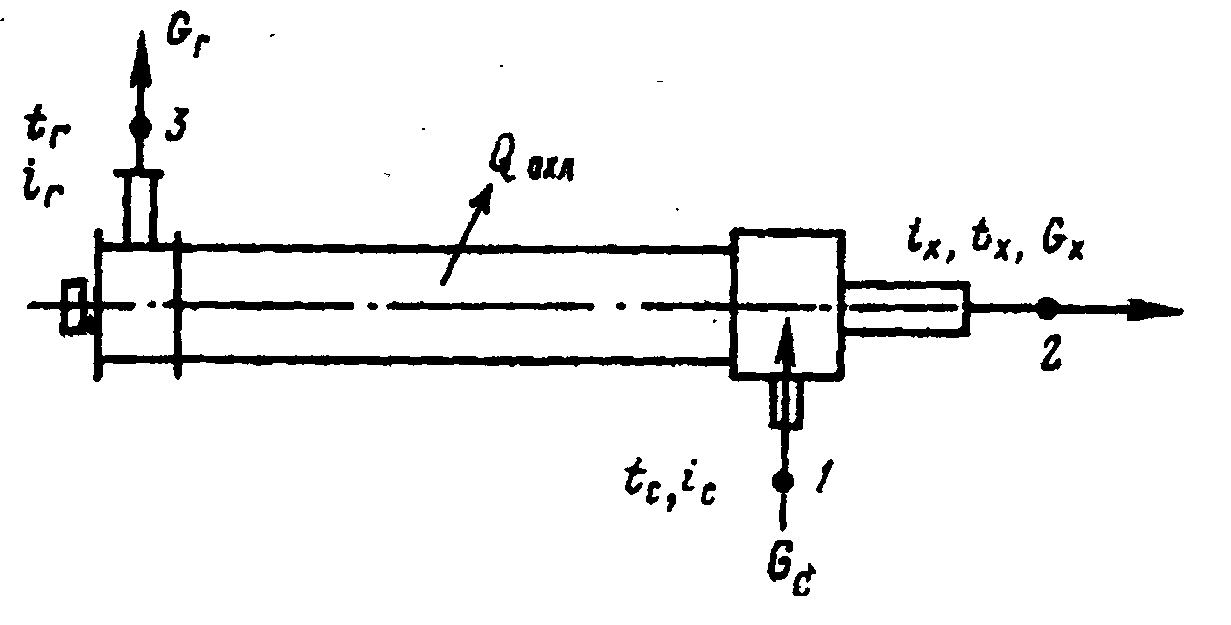
Рисунок 8. Энергетический баланс вихревой камеры
В большинстве случаев, если труба не охлаждается специально, величиной Qохл можно пренебречь (Qохл = 0). Такую трубу называют адиабатной (процесс протекает без теплообмена с внешней средой).
Диаметр вихревой трубы оптимальных размеров задается в большинстве случаев конструктивными соображениями, так чтобы осевые скорости холодного и горячего потоков газа не превышали 5 – 10 м/с. Оптимальная длина вихревой камеры составляет 20 – 30 её диаметров.
ЛЕКЦИЯ №7
Физико-химические свойства пластовых жидкостей.
Солеобразование в добывающих газовых скважинах.
Подземные воды встречаются в большинстве нефтяных, газовых и газоконденсатных месторождений, являются обычным их спутником и в основном определяют систему промыслового сбора и подготовки скважинной продукции. Ниже приведена промысловая классификация вод.
I. Чуждые воды по отношению к нефтяному и газовому (газоконденсатному) месторождению:
1. Верхние поверхностные воды (воды озер, рек, морей и океанов):
- верхние пресные поверхностные воды;
- верхние соленые поверхностные воды.
2. Верхние пластовые воды приурочены к чисто водоносным пластам, залегающим выше нефтегазоносных пластов:
- воды пластов пресноводного комплекса;
- минерализованные воды.
3. Нижние пластовые воды приурочены к чисто водоносным пластам, залегающим ниже нефтегазоносных пластов.
II. Собственно пластовые воды:
1. Промежуточные воды - приурочены к водоносным пропласткам, залегающим между нефтегазоносными пластами, являющимися одним объектом разработки.
2. Остаточные (связанные) воды – приурочены к нефтегазоносным пластам после миграции нефти и газа и замещения ими воды.
3. Подошвенные воды залегают в нижней, подошвенной части нефтегазоносного пласта в пределах всей структуры.
4. Собственно пластовые воды (подпирающие воды):
- краевые воды;
- крыльевые воды.
5. Закачиваемые воды.
6. Смешанные воды.
В общей химии существует много видов классификации вод. В нефтегазопромысловой практике наиболее часто используются классификации по Ч. Пальмеру и В.А. Сулину.
Следует отметить, что химический состав вод выражается в количествах отдельных ионов растворенных солей (ионная форма) в граммах или миллиграммах на 1 литр воды. Если состав воды представлен в эквивалентной форме, то для этого количество ионов делят на соответствующие эквиваленты. Эквивалентом называется отношение атомной или молекулярной массы иона к его валентности.
В таблице 1 приведены эквиваленты ионов содержащихся в водах нефтяных, газовых и газоконденсатных месторождений.
Таблица 1. Эквивалентность основных ионов вод
Ион |
Эквивалент |
Ион |
Эквивалент |
Ион |
Эквивалент |
Na+ |
23,0 |
H+ |
1,0 |
HCO3 - |
61,0 |
Mg2+ |
12,2 |
F3+ |
18,6 |
Br- |
79,9 |
Ca2+ |
20,0 |
F2+ |
27,9 |
I - |
126,9 |
K+ |
39,1 |
Cl- |
35,5 |
HS - |
33,0 |
NH4+ |
18,0 |
SO4 2- |
48,0 |
CO3 2- |
30,5 |
В
нефтегазопромысловой практике обычно
массы ионов умножают на величину,
обратную эквиваленту – переводной
коэффициент, и этом случае содержание
выражается в миллиграмм - эквивалентах
(мг-экв), а перед обозначением иона
ставится условное обозначение r
(реагирующая
величина) например,
![]() и т.д. Причём, суммы миллиграмм –
эквивалентов анионов
и т.д. Причём, суммы миллиграмм –
эквивалентов анионов
![]() и
катионов
и
катионов
![]() всегда
равны, поскольку ионы присутствуют в
воде в диссоциированном состоянии, т.е.
=
.
всегда
равны, поскольку ионы присутствуют в
воде в диссоциированном состоянии, т.е.
=
.
Химическая классификация вод по Ч. Пальмеру:
1. Первая соленость вод - в воде растворены соли, образовавшиеся в результате реакции сильных оснований и сильных кислот (хлориды натрия, сульфаты натрия и т.д.).
2. Вторая соленость вод - соли щелочноземельных металлов и сильных кислот (сульфаты магния и т.д.).
3. Третья соленость - соли "слабых" щелочей с трехвалентными катионами металлов и сильных кислот (хлориды и сульфиды железа, алюминия и т.д.).
4. Первая щелочность - соли щелочных металлов и "слабых" кислот (натриевая сода и т.д.).
5. Вторая щелочность - соли щелочноземельных металлов и "слабых" кислот (гидрокарбонаты кальция и магния).
6. Третья щелочность - соли "слабых" кислоты и "слабых" щелочей с трехвалентными катионами металлов (в пластовых водах встречаются крайне редко).
Химическая классификация вод по В.А. Сулину:
выделяет четыре типа пластовых вод по преобладанию различных анионов и катионов. Характерные отношения между ионами, положенные в основу классификации выражаются тремя коэффициентами, названными "генетическими":
![]() ;
;
![]() ;
;
![]() .
(1)
.
(1)
Генетические типы вод по В.А. Сулину приведены в таблице 2.
Таблица 2. Генетические типы пластовых вод
Тип воды |
Коэффициенты |
||
|
|
|
|
1. Сульфатнатриевый |
> 1 |
< 1 |
< 0 |
2. Гидрокарбонат-натриевый |
> 1 |
> 1 |
< 0 |
3. Хлоркальциевый |
< 1 |
< 0 |
> 1 |
4. Хлормагниевый |
< 1 |
< 0 |
< 1 |
В нефтяной гидрогеологии по содержанию солей в воде, они подразделяются на четыре класса: пресные – до 1 г/л; солоноватые – до 10 г/л; солёные – до 50 г/л; рассолы – более 50 г/л.
Минерализация и химический состав определяют все основные физико-химические свойства вод. Физико-химические свойства пластовых вод во многом совпадают с аналогичными свойствами нефти и газа, но отличаются по численным значениям:
1. Плотность пластовых вод:
rв = 1,0 - 1,5 г/см3.
2. Вязкость пластовых вод:
mв = 1,0 - 1,2 мПа·с.
3. Растворимость газа в пластовой воде:
aв = 1 - 5 м3/ м3.
4. Объёмный коэффициент пластовой воды:
bв = 1,00 - 1,05.
5. Тепловое расширение пластовой воды:
aв = (2 - 8)··10-4 ·С-1.
6. Сжимаемость пластовой воды:
bв = (2 - 5)·10-10·Па-1.
7. Минерализация пластовых вод - это массовое содержание растворенных солей в единице объёма воды:
М = 0 - 600 кг/м3.
Рассмотрим основные физические свойства пластовых вод.
Плотность воды напрямую связана с её минерализацией. Причём, с увеличением минерализации и давления плотность воды возрастает, а увеличением температуры – уменьшается. За эталон плотности воды принята плотность дистиллированной воды равная единицы при температуре 4 0С.
Воды, приуроченные к продуктивным пластам нефтяных, газовых и газоконденсатных месторождений, носят название пластовых.
Плотность пластовой воды определяется по выражению следующего вида
![]() (2)
(2)
где
![]() -
плотность воды при стандартных условиях
(t = 20 0С и Р = 0,1013 МПа);
-
плотность воды при стандартных условиях
(t = 20 0С и Р = 0,1013 МПа);
![]() - объёмный коэффициент пластовой воды.
- объёмный коэффициент пластовой воды.
В нефтегазопромысловой практике
плотность воды оценивается по величине
солености в градусах Бомэ (![]() ),
один градус которого соответствует 1%
массового содержания хлористого натрия
),
один градус которого соответствует 1%
массового содержания хлористого натрия
![]() в растворе. Определенную ареометром
величину солености пересчитывают на
плотность по выражению следующего вида
в растворе. Определенную ареометром
величину солености пересчитывают на
плотность по выражению следующего вида
![]() (3)
(3)
где
![]() -
плотность воды при температуре 15,5 0С,
г/см3,
-
плотность воды при температуре 15,5 0С,
г/см3,
![]() - соленость воды,
.
- соленость воды,
.
Для пересчёта можно воспользоваться таблицей 3.
Максимальную плотность вода имеет при температуре 276,98 К. Выше и ниже этой температуры плотность воды уменьшается порядка 10 %, т.е. при затвердевании вода не сжимается, а расширяется.
Таблица 3. Перевод градусов Вомэ в плотность
|
Плотность |
|
Плотность |
|
Плотность |
1 |
1,0069 |
11 |
1,0825 |
21 |
1,1703 |
2 |
1,0140 |
12 |
1,0907 |
22 |
1,1798 |
3 |
1,0212 |
13 |
1,0990 |
23 |
1,1898 |
4 |
1,0283 |
14 |
1,1074 |
24 |
1,1995 |
5 |
1,0358 |
15 |
1,1160 |
25 |
1,2095 |
6 |
1,0433 |
16 |
1,1247 |
26 |
1,2197 |
7 |
1,0509 |
17 |
1,1335 |
27 |
1,2301 |
8 |
1,0586 |
18 |
1,1425 |
28 |
1,2407 |
9 |
1.0679 |
19 |
1,1516 |
29 |
1,2515 |
10 |
1,0744 |
20 |
1,1609 |
30 |
1,2624 |
На рисунке 1 приведена зависимость плотности пластовых вод от их суммарной солёности.
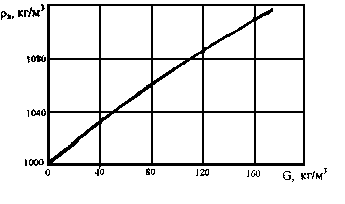
Рисунок 1. Зависимость плотности воды
![]() от количества растворенных в ней
минералов
от количества растворенных в ней
минералов
![]()
Основные физические параметры воды приведены в таблице 4.
Тепловое расширение воды характеризуется
коэффициентом теплового расширения,
представляющим собой зависимость
объёмного фактора от температуры.
Тепловое расширение воды при заданных
условиях определяется углом наклона
кривой (с размерностью![]() ).
).
Коэффициент теплового расширения пресной воды при постоянном давлении описывается зависимостью следующего вида
![]() (4)
(4)
где
![]() - коэффициент теплового расширения
воды,
- коэффициент теплового расширения
воды,![]() ;
;
V – объём воды, м3; ΔV – изменение объёма воды от температуры, м3.
Из уравнения (4) видно, что коэффициент теплового расширения воды характеризует изменение единицы объёма воды при изменении её температуры на 10С.
Таблица 4 - Основные физические параметры воды
Параметры |
Единица измерения |
Значения постоянных параметров |
Молекулярная масса |
- |
18,016 |
Температура максимальной плотности при Р = 0,1 МПа |
0С |
3,98 |
Плотность при Т = 273,00 К Т = 276,98 К Т = 293,00 К |
кг/м3 кг/м3 кг/м3 |
999,841 1000,000 998,203 |
Плотность льда |
кг/м3 |
916,800 |
Масса насыщенного пара при Т = 373 К и Р = 0,1 МПа |
кг/м3 |
597,400 |
Критическая температура воды |
К |
374,20 |
Критическое давление воды |
МПа |
21,85 |
Критическая плотность воды |
кг/м3 |
0,324 |
Удельная теплоёмкость при Р = 0,1 МПа Т = 373 К Т = 273 К |
|
4,18680 2,03897 |
Мольная теплоёмкость при Р = 0,1 МПа Т = 373 К Т = 273 К |
|
75,3624 75,5624 |
Скрытая теплота плавления льда при Т = 273 К |
|
333,688 |
Скрытая теплота парообразования при Т = 273 К |
|
6,0124 |
Вязкость воды при Т = 273 К Т = 273 К |
|
1,789 1,650 |
Поверхностное натяжение при Т = 293 К |
|
72,53 |
Удельная электропроводность при Т = 273,00 К Т = 276,98 К Т = 293,00 К |
|
1,5·10-8 4,3·10-8 18,7·10-8 |
Для пластовых вод коэффициент теплового
расширения изменяется в пределах
![]() ,
причём он возрастает с увеличением
температуры и уменьшается в ростом
пластового давления. На тепловое
расширение воды оказывают также влияние
минерализация и растворимость газа в
воде.
,
причём он возрастает с увеличением
температуры и уменьшается в ростом
пластового давления. На тепловое
расширение воды оказывают также влияние
минерализация и растворимость газа в
воде.
Характер изменения объёма воды от изменения температуры приведен на рисунке 2.
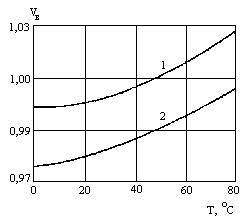
Рисунок 2. Зависимость объёма воды Vв от температуры при различных значениях давления:
1 – Р = 0,1 МПа; 2 – 50,0 МПа.
Сжимаемость пластовых вод характеризуется коэффициентом сжимаемости, который при постоянной температуре определяется по уравнению вида
![]() (5)
(5)
где
![]() -
коэффициент сжимаемости воды,
-
коэффициент сжимаемости воды,
![]() ;
;
V – объём воды, м3;
ΔV – изменение объёма воды от давления, м3.
Из уравнения (5) видно, коэффициент
сжимаемости воды
характеризует
изменение единицы объёма при изменении
давления на единицу. Коэффициент
сжимаемости воды
в пластовых условиях изменяется в
пределах
![]() ,
а при наличии растворенного в воде газа
он увеличивается.
,
а при наличии растворенного в воде газа
он увеличивается.
С учётом наличия растворенного воде газа коэффициент сжимаемости ориентировочно можно рассчитать по выражению следующего вида
![]() (6)
(6)
где![]() - коэффициент сжимаемости воды, содержащий
растворенный газ,
;
- коэффициент сжимаемости воды, содержащий
растворенный газ,
;
![]() -
коэффициент сжимаемости чистой воды,
-
коэффициент сжимаемости чистой воды,
![]() -
количество растворенного газа в воде,
м3/м3.
-
количество растворенного газа в воде,
м3/м3.
На рисунке 3 приведены зависимости сжимаемости чистой воды при различных давлениях.
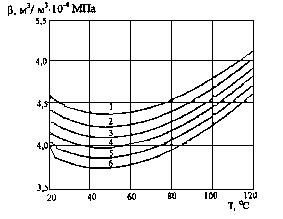
Рисунок 3. Зависимость сжимаемости чистой воды от температуры при давлениях:
1 – Р = 7 МПа; 2 – Р = 14 МПа; 3 – Р = 21 МПа;
4 – Р = 28 МПа; 5 – Р = 35 МПа; 6 – Р = 42 МПа;
В случае определения коэффициента сжимаемости соленой воды при давлении выше давления насыщения (раствор не полностью насыщен газом), применяю поправочный коэффициент, являющийся функцией только количества растворенного газа. Либо, можно использовать поправку, учитывающую влияние растворенного газа, определяемую из зависимостей приведенных на рисунке 4. Полученные по зависимостям данные затем умножают на множитель определяемые по формуле следующего вида
![]() (7)
(7)
где Г - газовый фактор, м3/м3.
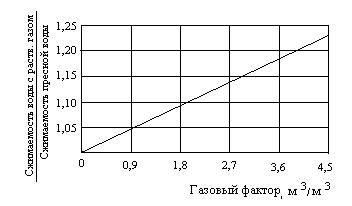
Рисунок 4. Поправочный коэффициент
![]() на
сжимаемость для учёта влияния растворенного
газа в сравнении с сжимаемостью пресной
воды
на
сжимаемость для учёта влияния растворенного
газа в сравнении с сжимаемостью пресной
воды
Растворимость газов в воде определяется
количеством газа, растворяющегося в 1
м3 при температуре 20 0С и
давлении Р = 0,1 МПа и характеризуется
коэффициентом![]()
![]() (8)
(8)
где
![]() -
коэффициент растворимости газа в воде;
-
коэффициент растворимости газа в воде;
![]() -
объём газа растворенного в воде при
нормальных условиях, м3;
-
объём газа растворенного в воде при
нормальных условиях, м3;
![]() -
масса воды, кг.
-
масса воды, кг.
Растворимость газа в пластовой воде зависит от её температуры, минерализации, составов растворенных солей и газов. Причём, растворимость газов в воде возрастает с ростом давления и уменьшается с увеличением температуры, а с ростом минерализации растворимость ухудшается.
В случае отсутствия данных о растворимости газа в пластовых водах конкретного месторождения следует воспользоваться значениями коэффициентов растворимости газов в дистиллированной воде с учётом температуры, и ввести поправку на минерализацию, используя формулу следующего вида
![]() (9)
(9)
где![]() -
мольные доли растворимости газа в
минерализованной и дистиллированной
водах;
-
мольные доли растворимости газа в
минерализованной и дистиллированной
водах;
К – коэффициент высаливания;
С – концентрация соли в грамм-эквивалентах на 1 л пластовой воды при температуре Т=293 К.
На рисунке 5 приведены графические зависимости определения коэффициента высаливания в зависимости от состава газа температуры.
В интервале температур![]() значение коэффициент высаливания К
будет равен соответственно: метана
значение коэффициент высаливания К
будет равен соответственно: метана
![]() ,
азота
,
азота![]() ,
этана
,
этана
![]() пропан
пропан![]() .
Для водных растворов хлористого натрия
.
Для водных растворов хлористого натрия![]() в интервале температур
в интервале температур
![]() коэффициент высаливания составляет К
= 1.
коэффициент высаливания составляет К
= 1.
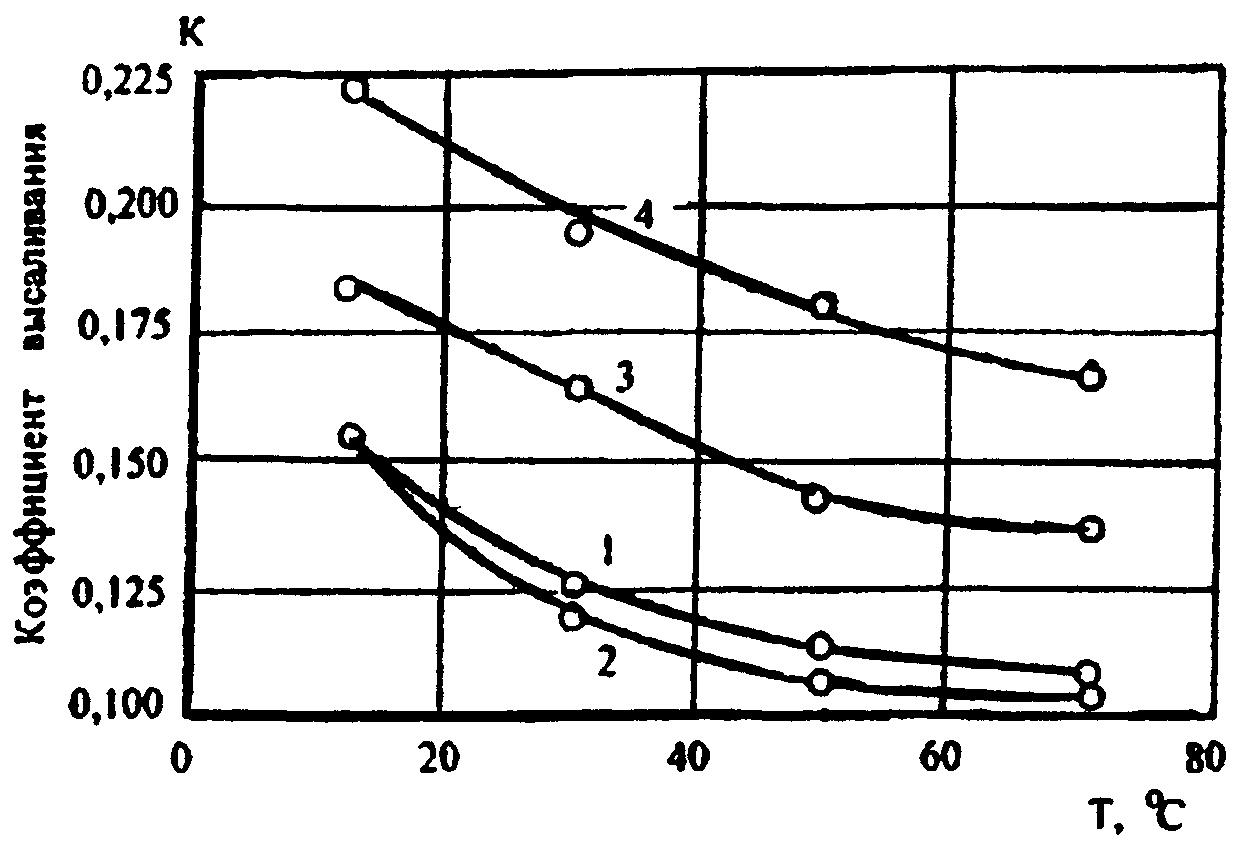
Рисунок 5. Зависимость коэффициента высаливания К от температуры для различных газов:
1 – метан; 2 – азот; 3 – этан; 4 – пропан.
В пластовых водах в растворенном
состоянии могут присутствовать СО2
и Н2S. В водах различной минерализации
при давлении Р = 0,1 МПа и
![]() растворимость СО2 составляет 0,2
– 1,7 м3/м3. При давлении Р =
0,1 МПа,
и минерализации воды
2 – 5 м воды растворимость Н2S в
воде изменяется в пределах 0,5 – 1,6 м3/м3.
растворимость СО2 составляет 0,2
– 1,7 м3/м3. При давлении Р =
0,1 МПа,
и минерализации воды
2 – 5 м воды растворимость Н2S в
воде изменяется в пределах 0,5 – 1,6 м3/м3.
На газовых месторождениях пластовые воды в основном насыщены метаном. На рисунке 6 приведена графическая зависимость растворимости метана в пластовой воде с условной соленостью хлористого натрия равной 20, 100, 200 и 300 кг/м3 при температурах 293, 313, 333 и 353 К.
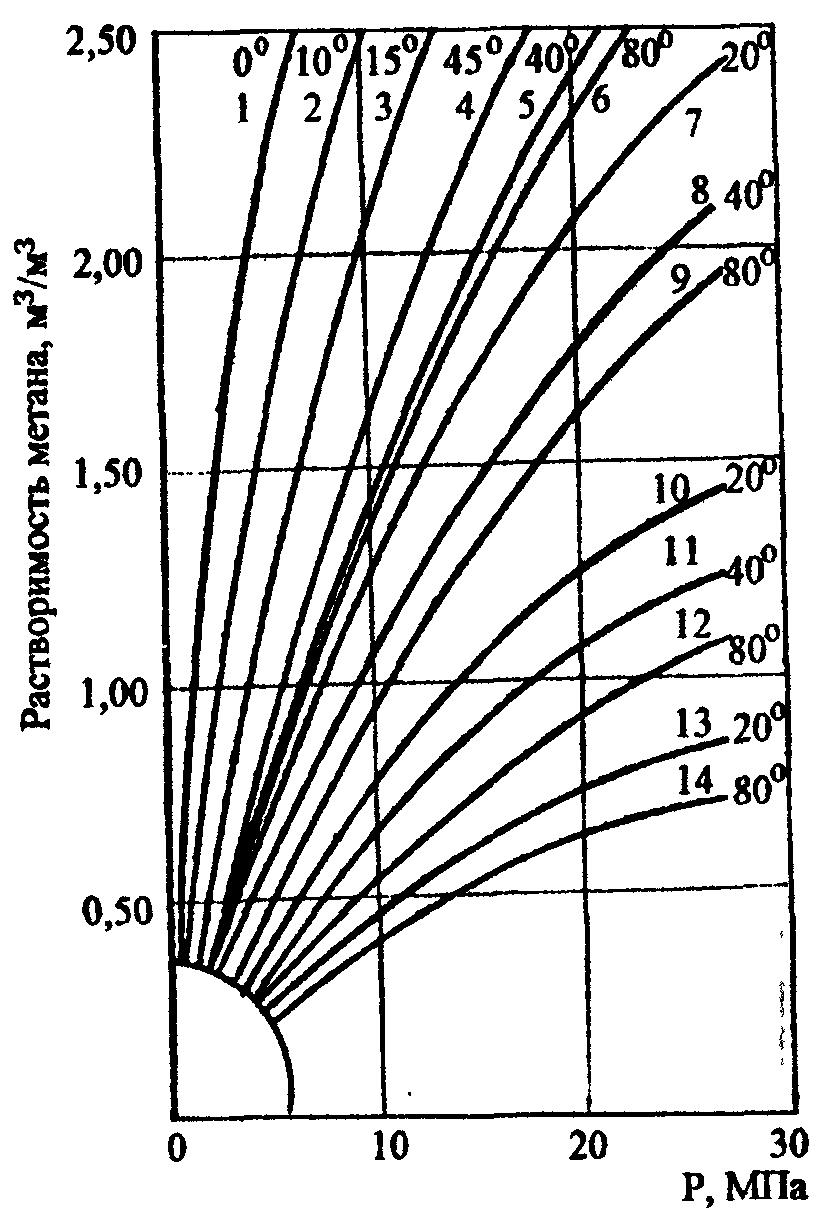
Рисунок 6. Зависимость растворимости метана в пластовой воде от давления с условной соленостью воды хлористым натрием ( ): 1 – 6 - условная соленость 20 кг/м3 ; 7 – 9 - условная соленость 200 кг/м3 и 13 – 14 - условная соленость 300 кг/м3 в различном диапазоне температур.
Растворимость природного газа в пресной воде приведена на рисунке 7.
Объёмный коэффициент пластовой воды
характеризует отношение удельного
объёма воды в пластовых условиях![]() кудельному объёму её в стандартных
условиях
кудельному объёму её в стандартных
условиях
![]()
![]() (10)
(10)
где
![]() -
плотности воды в пластовых и стандартных
условиях.
-
плотности воды в пластовых и стандартных
условиях.
Увеличение пластового давления ведет к уменьшению объёмного коэффициента, а повышение температуры ведет к его росту. С увеличением минерализации воды объёмный коэффициент снижается.
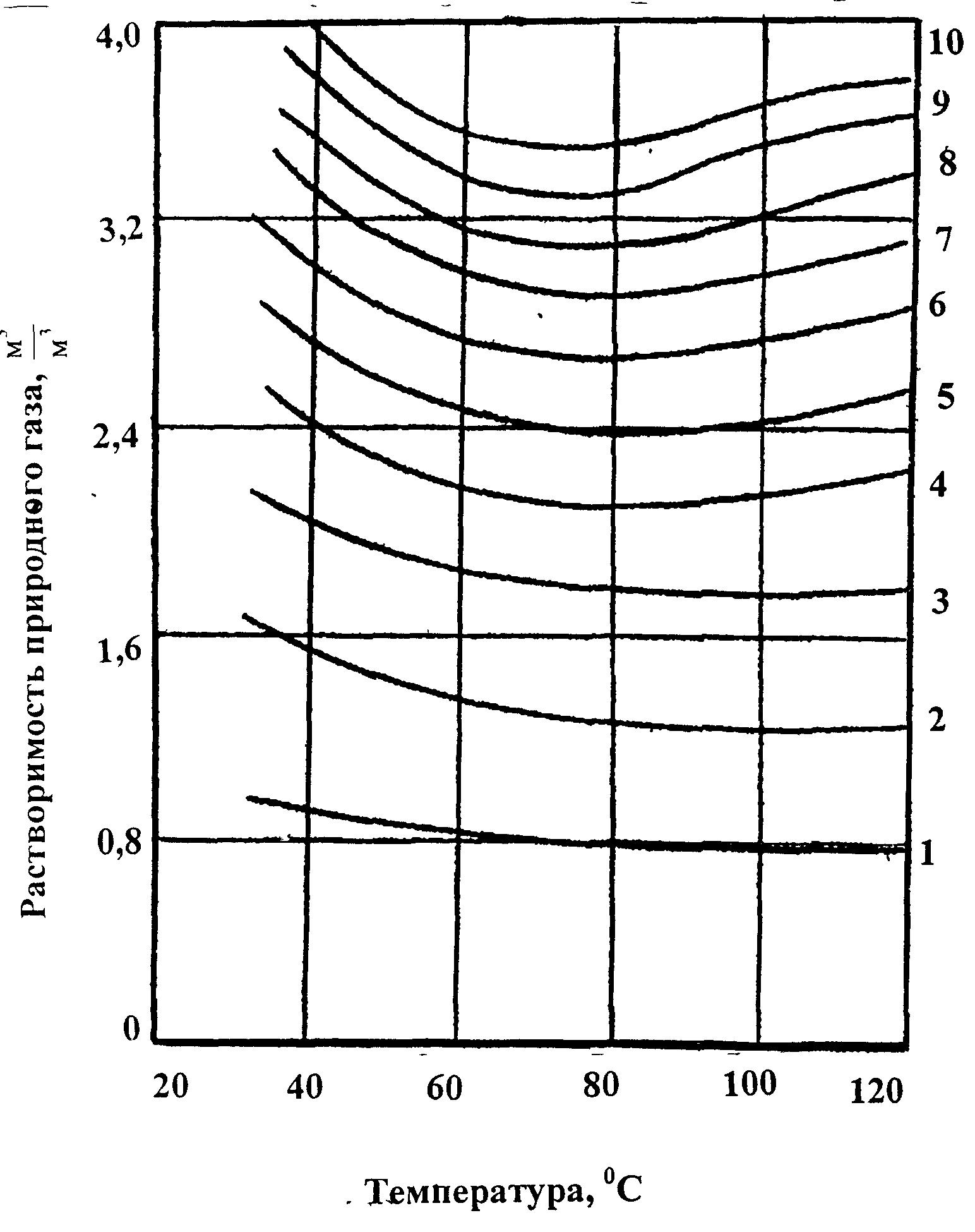
Рисунок 7. Зависимость растворимости природного газа в пресной воде от температуры при давлении:
1 – 3,5 МПа, 2 – 7,0 МПа; 3 – 10,5 МПа, 4 – 14,0 МПа,
5 – 17,5 МПа, 6 - 21,0 МПа, 7 – 24,5 МПа, 8 – 28,0 МПа,
9 - 31, 5 МПа, 10 – 35,0 МПа.
В таблице 3 приводятся значения объёмных коэффициентов для чистой и насыщенной природным газом воды.
Значение пластового объёмного коэффициента пресной воды , насыщенной газом, получают прибавлением этой разности к пластовому объёмному коэффициенту чистой воды определенному по графической зависимости приведенной на рисунке 7.
Таблица 3. Объёмные коэффициенты для чистой и
насыщенной природным газом воды
Абсолютное давление насыщения, МПа |
Значения пластового объёмного коэффициента от температуры, м3/м3 |
|||
310,8 К |
338,6 К |
366,3 К |
391,1 К |
|
Вода, насыщенная природным газом |
||||
35,2 |
0,9989 |
1,0126 |
1,0321 |
1,0522 |
28,1 |
1,0003 |
1,0140 |
1,0316 |
1,0537 |
21,1 |
1,0017 |
1,0154 |
1,0345 |
1,0552 |
14,1 |
1,0031 |
1,0168 |
1,0345 |
1,0568 |
7,0 |
1,2045 |
1,0183 |
1,0361 |
1,0584 |
Чистая вода |
||||
35,2 |
0,9910 |
1,0039 |
1,0210 |
1,0418 |
28,1 |
0,9938 |
1,0067 |
1,0240 |
1,0452 |
21,1 |
0,9966 |
1,0095 |
1,0271 |
1,0487 |
14,1 |
0,9995 |
1,0125 |
1,0304 |
1,0523 |
7,0 |
1,0025 |
1,0153 |
1,0335 |
1,0560 |
Давление насыщенного водяного пара |
1,0056 |
1,0187 |
1,0370 |
1,0598 |
В случае необходимости введения поправки на соленость, надо данные, полученные из рисунка 7, умножить на поправочный множитель, зависящий от солёности, определенный по рисунку 8.
Знание объёмного фактора необходимо использовать для оценки объёма воды в поровом пространстве продуктивного пласта.
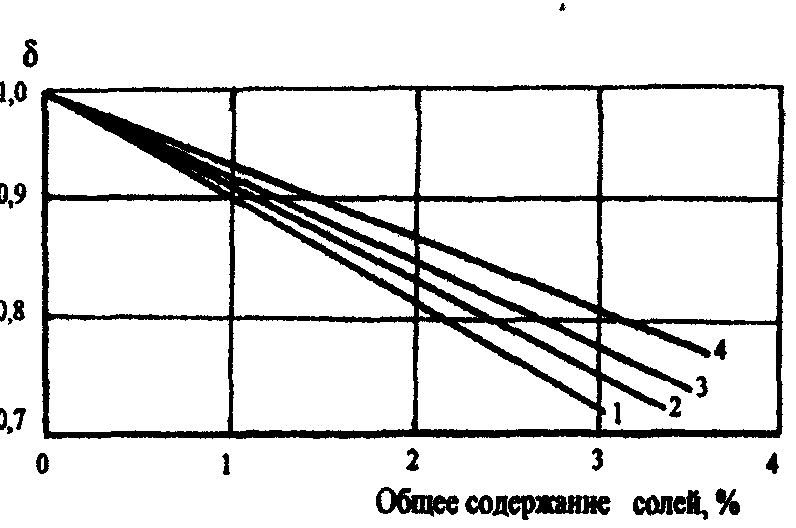
Рисунок 8. Поправка на солёность
![]() при
определении растворимости газа в
пластовой воде относительно его
растворимости в пресной воде при
различных температурах:
при
определении растворимости газа в
пластовой воде относительно его
растворимости в пресной воде при
различных температурах:
1 - Т= 40 0С; 2 – Т = 65 0С; 3 – Т = 95 0С; 4 - Т= 120 0С.
Вязкость пластовой воды в значительной мере зависит от температуры и концентрации растворенных солей (см. рис.9). Роль давления на вязкость пластовой воды незначительна. В связи с тем, что воде газы растворяются в незначительном объёме, её вязкость уменьшается незначительно при насыщении газом.
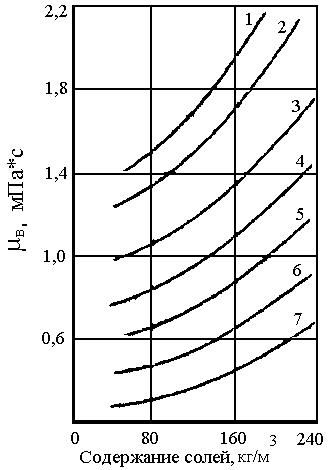
Рисунок 9. Зависимость вязкости
минерализованной воды
![]() от содержания солей при различных
значениях температуры:
от содержания солей при различных
значениях температуры:
1 – Т = 5 0С; 2 – Т = 10 0С; 3 – Т = 20 0С; 4 – Т = 30 0С;
5 – Т = 40 0С; 6 – Т = 50 0С; 7 – Т = 60 0С
Солеобразование в добывающих газовых скважинах
Разработка многих нефтяных и газовых месторождений серьезно осложнена выпадением неорганических солей из попутно извлекаемой воды в нефтегазопромысловом оборудовании и в разных зонах продуктивного пласта.
Образование неорганических отложений – это процесс выпадения в осадок и накопление осадков малорастворимых неорганических соединений, вызываемый пересыщением раствора по отношению к данному соединению. Под пересыщением понимается что, концентрация соединения в растворе выше равновесной концентрации.
Основные компоненты в большинстве отложений: карбонат кальция (СаСО3), сульфат кальция (гипс CaS04 2H20 и ангидрит САSO4), сульфат бария (ВаSO4) см. таблицу 4).
Таблица 4. Основные параметры неорганических соединений
Показатели |
Название неорганического соединения |
||||
Гипс |
Кальцит |
Барит |
Карбонат бария |
Гидро- ксид магния |
|
Химическая формула |
СаSO4·2H20 |
СаСО3 |
BaSO4 |
BaCO3 |
Mg(OH)2 |
Молекулярная масса |
172,17 |
100,09 |
233,40 |
197,35 |
58,32 |
Цвет |
- |
Бесцвет -ный |
- |
белый |
Бесцвет-ный |
Структура кристалла |
Моно клинная |
Триго нальная |
Ромби ческая |
Ромби ческая |
Триго нальная |
Плотность при Т=20 0С, г/см3 |
2,31 – 2,33 |
2,71 |
4,50 |
4,43 |
2,35 – 2,46 |
Растворимость в воде, г/100 г воды при температуре, 0С: 0 20 30 100 |
0,176 0,206 0,212 - |
Малораств. - - - |
- - - 0,00041 |
Малораств - - - |
- - - 0,004 |
Условия разложения |
Кислотными средами |
Кислотными средами. При нагревании разла- гается |
Барит плавится При Т=1580 0С |
Кислотными средами |
Кислотными средами. При нагревании разлагается |
В значительных количествах в составе отложений имеются различные примеси: сульфат стронция (SrS04), карбонат стронция (SrСОз), карбонат бария (ВаСО3), карбонат магния (MgC03), хлорид натрия, сульфат радия. Встречаются механические примеси продукты коррозии (окислы железа Fe2 O3, сульфид железа FeS) и др. В призабойной зоне нагнетательных скважин в составе неорганических осадков часто наблюдаются продукты жизнедеятельности бактерий.
Отложения чистых сульфатных или углекислых солей встречаются редко. Обычно они представлены смесью основного неорганического компонента с частицами нефти, силикатов, парафина, продуктами коррозии, примесями других солей.
Большинство отложений имеет кристаллическую структуру. Процесс их формирования представляет собой массовую кристаллизацию в сложных гидродинамических условиях, в широком интервале температур и пересыщений раствора солями в присутствии большого количества примесей, способных оказывать существенное влияние на характер (свойства) кристаллических осадков.
Образование кристаллических неорганических солей как процесс состоит из основных этапов: пересыщение раствора солями; зародышеобразование; рост кристаллов; перекристаллизация. Эти этапы могут протекать либо поочередно, либо одновременно.
Пересыщение раствора солями относительно какого-либо компонента связано увеличением концентрации последнего выше равновесной (растворимости). Условием возникновения этого процесса на нефтяных, газовых и газоконденсатных месторождениях является присутствие минерализованной попутно добываемой воды.
Несовместимость утилизируемых вод с пластовыми – одна из главных причин солеотложения на нефтяных и газовых месторождениях России. Рассмотрим основные причины солеотложения на нефтяных и газовых месторождениях.
1. Изменение термодинамических условий. В этом случае возможно образование карбонатов кальция по двум схемам
 (11)
(11)
![]() (12)
(12)
В пластовых водах
![]() ,
и образование СаСО3 происходит в
основном по схеме (11). Следует заметить,
что кальцит лучше растворятся в сравнении,
с другими неорганическими соля в воде
с уменьшением температуры. Например,
при температуре 100 0С его равновесная
концентрация равна 14 мг/л, то при
температуре 0 0С она составляет
85 мг/л.
,
и образование СаСО3 происходит в
основном по схеме (11). Следует заметить,
что кальцит лучше растворятся в сравнении,
с другими неорганическими соля в воде
с уменьшением температуры. Например,
при температуре 100 0С его равновесная
концентрация равна 14 мг/л, то при
температуре 0 0С она составляет
85 мг/л.
С падением давления и температуры, из раствора выпадает в осадок СаСО3, поскольку на направление реакции протекающей по уравнению (11) в большей степени оказывает влияние парциального давления углекислого газа, чем температура (см. таблицу 5).
Таблица 5. Зависимость растворимости СаСО2 от
парциального давления СО2
Показатель |
Значение |
|||
Парциальное давление СО2, МПа |
0,0001 |
0,01 |
0,1 |
1,0 |
Растворимость N, мг/л |
60 |
400 |
920 |
2125 |
Изменение температуры и давления может привести к перенасыщению растворов относительно сульфатов кальция и бария, причём максимальная растворимость достигается при температуре 40 0С. Дальнейший рост температуры вызывает снижение растворимости гипса, причём растворимость ангидрита снижается сильнее. Зависимость растворимости барита от температуры не столь велика. Следует отметить, что и зависимость равновесных концентраций сульфатов кальция и бария от давления также невелика, хотя как показывает опыт, снижение давление может привести к выпадению из раствора.
Снижение давления ведет к испарению части воды в газовую фазу, и как следствие, пересыщению водно-солевых систем.
2. Изменение химического состава пластовых вод в процессе разработки месторождения может наблюдаться при смешении закачиваемой и пластовой вод даже в условиях их химической совместимости. Это обстоятельство может привести к формированию попутнодобываемой воды совершенно нового состава в сравнении с пластовой. Реальные пластовые воды, закачиваемые и попутно добываемые воды это многокомпонентные водно-солевые составы. Т. о., изменение минерализации попутно добываемой воды в ряде случае ведет к её перенасыщению, и как следствие к появлению неорганических отложений.
Следует отметить, что существующие методы прогнозирования не в полной мере учитывают механизм и процессы, протекающие при солеотложении (адсорбция, гидродинамические эффекты и т.д.). В этой связи в промысловой практике в меньшей степени применяются методы предупреждения, а наибольшее распространения нашли методы их удаления.
ЛЕКЦИЯ № 8
Общие сведения о призабойной зоне пласта. Причины ухудшения коллекторских свойств ПЗП. Влияние фазовых превращений на движение многокомпонентных жидкостей в условиях пропитки дисперсиями (эмульсии, суспензии). Основные признаки дисперсных систем. Классификация систем по дисперсности. Классификация дисперсных систем по межфазному взаимодействию. Фильтрация дисперсных систем через пористые среды
Как говорил А.Эйнштейн, наука должна начинаться с фактов и кончаться фактами. Наиболее характерная особенность такого подхода – цикличность, так как она начинается и кончается фактами, и факты завершающие один цикл, оказываются началом следующего и так далее до бесконечности. Вот и мы с Вами обратимся к фактам.
Как известно разработка и эксплуатация газовых, газоконденсатных и нефтяных месторождений осуществляется на основе постоянного совершенствования техники и технологии производства и всемерного повышения их эффективности. А это связано в свою очередь с качественным и количественным учётом всех факторов при организации и проектировании мероприятий по повышению газоконденсатонефтеотдачи.
Первоначально обратимся к понятию призабойной зоны пласта (ПЗП). После вскрытия пласта скважиной по всей его толщине, вокруг ствола скважины возникает так называемая призабойная зона пласта, в которой произошли, происходят или могут происходить различные процессы, нарушившие или нарушающие первоначальное равновесное механическое или физико-химическое состояние горных пород. Радиус призабойной зоны пласта практически не возможно определить, и в этой связи выбирается условный средний радиус, ограничивающий по простиранию во всей его толщине, в которой происходят все процессы и явления, обусловленные вскрытие продуктивного пласта. При чем эта зона может иметь самую разнообразную конфигурацию.
Принципиальная схема призабойной зоны пласта приведена на рисунке 1.
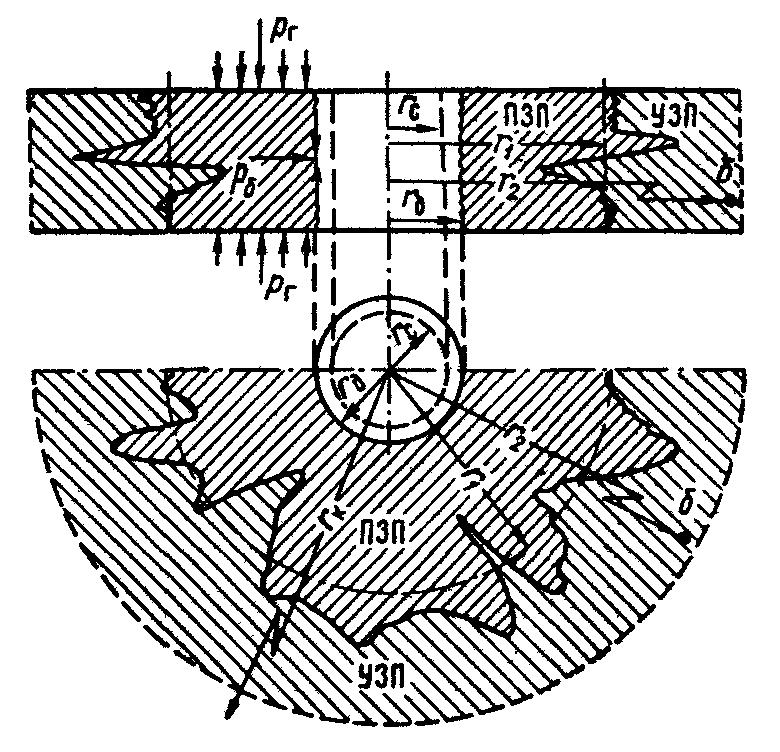
Рисунок 1. Схема призабойной зоны пласта.
ПЗП - призабойная зона пласта; УЗП - удаленная зона пласта; Р - равнодействующая вертикального горного давления;
Рд – равнодействующая горного бокового давления; rд - радиус скважин по долоту при бурении; rс - фактический радиус скважины; r1 - радиус призабойной .зоны пласта; r2 - расстояние произвольно взятой точки б удаленной зовы пласта от оси скважины; rк - радиус контура питания
